发酵鱼酱酸产GABA乳酸菌的分离筛选及发酵特性
刘 璐,吴江丽,杨金桃,唐忠月,曾雪峰*
(贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种由谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)催化谷氨酸合成的抑制性神经递质[1],普遍分布于动植物体内。研究表明,GABA不仅具有降低神经元性、防止神经细胞过热的作用,还具有防止动脉硬化、调节心律失常、降低血脂、增强肝功能等生理功效[2-4]。随着年龄的增长和精神压力不断变大会影响人体内谷氨酸转化为GBAB,并且当人体缺乏GABA时,会出现焦躁、失眠、疲劳等症状,而通过日常饮食摄入GABA是补充该功效物质的一种有效方式,因此GABA的大规模生产及其作为生物活性食品成分在现代食品工业中的应用成为人们关注的焦点。近年来,一些安全性高的微生物,如乳酸菌[5]、酵母菌[6]、曲霉菌[7]被用于发酵合成GABA。而利用微生物中GAD脱羧形成GABA,具有成本低、富集含量高、安全性高的优点[8]。
乳酸菌是动物肠道内的正常菌群,对人体安全有利[9],被认为是食品和药品行业合成GABA的首选对象。传统酸性发酵食品是产GABA乳酸菌重要的分离来源,许多研究表明乳酸菌具有GAD活性,可以催化谷氨酸脱羧产生GABA。很多研究者从泡菜、酸奶、干酪等发酵食品中分离出大量产GABA的植物乳杆菌[10-12]、短乳杆菌[13]、副干酪乳杆菌[14]、乳酸乳球菌[15]、布氏乳杆菌[16]等多种乳酸菌。Min等[17]从韩国泡菜中分离出一株高产GABA的短乳杆菌Lactbacillus brevis,因其较高的GABA产量,较好的环境适应性等特点,可作为发酵食品的潜在发酵剂进行应用。Di等[18]从干酪中分离出一株高产GABA的植物乳杆菌Lactbacillus plantarum,可用于生产功能性饮料或作为护肤品研发的新用途。Su等[19]从发酵水产品中分离出来的产GABA香肠乳杆菌Lactbacillus farciminis,会对发酵鱼产品中GABA积累有影响,可能有助于提高传统发酵渔业产品的健康效益和商业价值。
鱼酱酸是我国黔东南地区极具苗族原生态饮食文化特色的发酵调味品[20],其利用自身携带或环境中的微生物在自然条件下发酵而成,具有营养价值高、酸香浓郁、色泽鲜亮等特点。鱼酱酸中蕴含种类繁多、数量丰富、且具有较好发酵性能的乳酸菌,而酸性环境、富含底物谷氨酸为乳酸菌合成GABA提供了有利条件。当前关于鱼酱酸中产GABA的乳酸菌的研究还鲜有报道,本研究以鱼酱酸作为原料,筛选出发酵特性和益生效果较好、产GABA量高的乳酸菌用于鱼酱酸接种发酵,以此改进传统发酵工艺,提升产品品质,以期为实现富含GABA的鱼酱酸产品开发及工业化生产提供一定理论依据。
1 材料与方法
1.1 材料与试剂
无鳞小泥鳅、二荆条红辣椒、生姜、食盐、白酒市购。
MRS液体培养基 青岛海博生物公司;L-谷氨酸、L-谷氨酸标准品、GABA标准品、猪胆盐、赖氨酸、精氨酸、组氨酸、酪氨酸、RNA酶、溶菌酶 北京索莱宝科技有限公司;茚三酮 国药集团化学试剂有限公司;四硼酸钠 天津市永大化学试剂有限公司;次氯酸钠、溴甲酚紫 天津市致远化学试剂有限公司;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;琼脂糖 美国Biowest公司。
1.2 仪器与设备
XSS-2电子显微镜 奥林巴斯(中国)有限公司;DYY-6C电泳仪 北京六一生物技术有限公司;SW-CJ-10超净工作台 苏州净化有限公司;PHS-3E pH计、L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;A300梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 杭州朗基科学仪器有限公司;GIS-630凝胶成像仪 杭州米欧仪器有限公司。
1.3 方法
1.3.1 样品制备工艺流程
样品制备工艺流程如下:

1.3.2 鱼酱酸中优势乳酸菌初步鉴定
从发酵的鱼酱酸中取第1、3、5、9、15、21、30天样品,制成样液;依次进行梯度稀释,涂布后于37 ℃培养48 h。每个平板随机挑取5 个单菌落,进行划线培养,至菌株纯化[21-22]。观察分离纯化后的菌株菌落形态,进行革兰氏染色、过氧化氢酶实验、葡萄糖产酸产气实验完成对疑似乳酸菌菌株的初步鉴定。
1.3.3 产GABA菌株定性定量分析
L-谷氨酸液体培养基:在MRS液体培养基中加入10 g/L的L-谷氨酸,调节pH值至6.2~6.4,121 ℃灭菌15 min。
发酵培养液:取活化两代后的菌株菌液,接3%(V/V)于L-谷氨酸液体培养基中,37 ℃培养48 h,备用。
薄层色谱法:取发酵培养液1 mL,离心(16 000×g、15 min),取上清液。用毛细管取适量发酵上清液点于G型硅胶薄层板上。以正丁醇-冰醋酸-水(4∶1∶3,V/V)配制展开剂,添加0.4%茚三酮,做密闭上行展开,经90 ℃显色15 min。同时以L-谷氨酸液体培养基、1 g/L GABA标准液、1 g/LL-谷氨酸标准液作为对照。
Berthelot比色法:参考肖君荣[23]的方法,取发酵培养液1 mL,离心(16 000×g、15 min),取上清液600 μL,加入0.1 mol/L四硼酸钠缓冲液2 mL,6%苯酚溶液800 μL(V/V),混匀,再加入10%次氯酸钠溶液900 μL,振荡混匀,沸水浴10 min后,冰浴20 min,待出现蓝绿色后,加入60%乙醇溶液4 mL,振荡均匀,静置后于645 nm波长处测定其吸光度。
1.3.4 产GABA菌株鉴定
生理生化指标:进行产黏性、葡萄糖产气、明胶液化、硝酸盐还原、淀粉水解、产硫化氢等实验。
16S rDNA扩增:将明显具有产GABA能力的试验菌接入MRS液体培养基中,活化至两代,对其进行基因鉴定。按照天根细菌基因组DNA提取试剂盒说明书提取菌株的DNA,采用细菌通用引物27F:5’-AGAGTTTGATCCTGGCTCAG-3’;1492R:5’-CTACGGCTACCTTGTTACGA-3’,由生工生物工程(上海)股份有限公司合成。PCR反应体系(25 μL):2×T5 Direct PCR Mix 12.5 μL,正反向引物各1 μL,模板DNA 1.5 μL,ddH2O 9 μL。PCR反应条件:95 ℃预变性5 min,95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,30 个循环,72 ℃延伸10 min。PCR扩增产物经过2%琼脂糖电泳分析,送至生工生物工程(上海)股份有限公司进行测序。测序结果在NCBI上进行BLAST比对。
1.3.5 耐酸性实验
参考Zeng Xuefeng等[24]的方法稍作修改。吸取0.5 mL活化菌液转至装有10 mL磷酸盐缓冲液的试管中,滴加5 mol/L HCl溶液调节pH值至2.5,30 ℃恒温培养3 h,以平板活菌数计数法测定存活菌数,按照下式计算菌株存活率:

1.3.6 耐胆盐性实验
分别向MRS液体培养基中加入0.1%、0.2%、0.3%的猪胆盐,再分别接入1%(V/V)的活化菌液,37 ℃培养24 h后,于600 nm波长处测定其OD值,以不加猪胆盐的组作为对照。
1.3.7 氨基酸脱羧酶活性实验
吸取100 μL活化的菌液接至加入1%过滤灭菌后的酪氨酸、精氨酸、组氨酸、赖氨酸溶液的MRS液体培养基中(含0.6 g/L溴甲酚紫作为指示剂),未加菌液的作为对照组,37 ℃培养3~7 d,观察其颜色,培养基由黄色变为紫色,则为氨基酸脱羧酶阳性。
1.3.8 抑菌实验
1.3.8.1 菌液及发酵上清液的抑菌实验
采用纸片琼脂扩散法测定每株菌的抑菌性,以大肠杆菌和金黄色葡萄球菌作为指示菌,将0.1 mL活化的指示菌菌液接入营养琼脂培养基中进行涂布,使用无菌镊子在培养基上放置无菌的滤纸片(6 mm),吸取15 μL活化后的菌液点于无菌滤纸片上,平板置于4 ℃冰箱2 h,再经37 ℃培养24 h后观察并测量抑菌圈大小。参考胡彦新等[25]的方法并稍加改动,对经纸片琼脂扩散法已经显现出抑菌活性的菌株,其发酵液经4 ℃、10 000 r/min离心10 min,收集上清液,同样进行抑菌实验。
1.3.8.2 排除过氧化氢抑菌作用实验
用1 mol/L NaOH溶液和1 mol/L HCl溶液调节发酵上清液至过氧化氢酶的最适作用pH 7.0;将发酵上清液用1 mol/L过氧化氢酶处理于37 ℃水浴1 h,最后调节回对照pH值,以未经酶处理的发酵上清液作为对照,37 ℃培养24 h后观察抑菌圈大小[25]。
1.3.8.3 排除有机酸抑菌作用实验
取发酵上清液,用1 mol/L氢氧化钠溶液调pH 6.0,进行排除有机酸抑菌作用实验[25]。
1.3.8.4 蛋白酶敏感实验
将胰蛋白酶、胃蛋白酶、中性蛋白酶分别加入发酵上清液中至终质量浓度为1 mg/mL,利用1 mol/L NaOH溶液和1 mol/L HCl溶液调节pH值至各蛋白酶最适宜范围:胰蛋白酶pH 7,胃蛋白酶pH 2,中性蛋白酶pH 7,37 ℃水浴2 h,调回上清液初始pH值,37 ℃培养24 h后观察抑菌圈大小[25]。
1.3.9 菌株生长曲线、pH值及菌株产酸速率实验
分别以2%(V/V)的接种量将活化后的待测菌株接入MRS液体培养基中,37 ℃、150 r/min振荡培养,每隔2 h取样,测定其OD600nm和pH值,以时间为横坐标,绘制菌株生长曲线和pH值变化曲线。将筛选出的产GABA菌株分别接入MRS液体培养基中,37 ℃培养24 h,以无菌MRS液体培养基作为空白对照组,测定其pH值。
1.4 数据处理
2 结果与分析
2.1 鱼酱酸中优势乳酸菌的分离纯化及初步鉴定结果
从发酵鱼酱酸中分离纯化得到387 株疑似乳酸菌,菌株的菌落形态呈现出透明、不透明、白色、乳白色,表面光滑较圆,表面较圆微隆起。镜检结果为短棒状、杆状、长杆状、球状、链状,符合乳杆菌、乳球菌的形态学特征。对分离出的387 株菌进行革兰氏染色、葡萄糖产酸、接触酶实验。根据革兰氏染色阳性、可利用葡萄糖产酸、接触酶阴性的结果,有117 株符合乳酸菌的生理生化特点,可初步判断为乳酸菌。
2.2 产GABA菌株定性定量实验
将初筛得到的117 株菌接入L-谷氨酸液体培养基中,37 ℃发酵48 h,获得105 株浑浊度高、生长速率快的菌株,经薄层色谱定性得到15 株具有明显产GABA能力的菌株。如图1所示,分别为Y113、Y123、Y133、Y64、Y271、Y273、Y63、Y278、Y272、Y274、Y61、Y341、Y343、Y346、Y279,将这15 株菌作为实验菌株。

图1 部分菌株的发酵上清液薄层色谱图Fig.1 TLC profiles of fermentation supernatants of selected bacterial strains
利用Berthelot比色法对筛选出的15 株产GABA菌株进行定量分析,由图2可知:Y113、Y279及Y64产GABA的量较高,其质量浓度分别为0.239、0.209、0.192 mg/mL,说明鱼酱酸中蕴含具有产GABA能力的乳酸菌,其酸性环境及富含底物谷氨酸可以为合成GABA提供较好的条件。
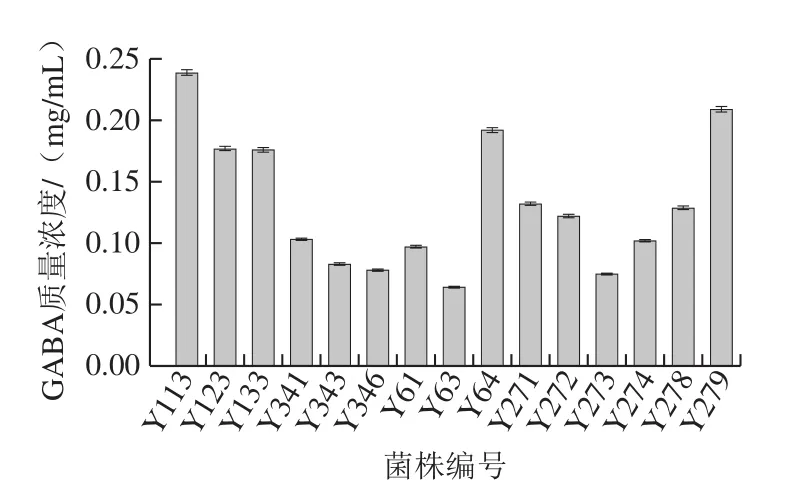
图2 15 株菌发酵48 h后GABA质量浓度Fig.2 GABA production by 15 strains after fermentation for 48 h
2.3 产GABA菌株的鉴定结果
2.3.1 生理生化鉴定
对15 株实验菌进行生理生化实验,菌株均不产气、不产H2S,明胶液化实验、硝酸盐还原实验、淀粉水解实验结果为阴性,符合乳酸菌生理生化特征。
2.3.2 16 S rDNA扩增和序列结果分析
对上述15 株产GABA菌株进行DNA提取及PCR扩增,琼脂糖电泳结果见图3。将16S rDNA基因序列结果在NCBI上进行BLAST比对,15 株实验菌与参考菌株同源性均在99%以上。如表1所示,共鉴定出4 个菌种。其中,11 株为植物乳杆菌,2 株为食窦魏斯氏菌,1 株为熊蜂魏斯氏菌,1 株为戊糖乳杆菌。同其他发酵产品类似,鱼酱酸发酵过程中除了存在能产GABA的植物乳杆菌,还存在能产GABA的魏斯氏菌,包括2 株食窦魏斯氏菌和1 株熊蜂魏斯氏菌。其中食窦魏斯氏菌Y113产GABA量较高于其他菌株,为0.239 mg/mL。Bao等[26]发现,接种食窦魏斯氏菌,同时添加低聚木糖作为益生元进行豆浆发酵,能提高GABA的含量,但并未明确是否是食窦魏斯氏菌的作用使其含量增加。魏斯氏菌多存在于酱油、豆豉、泡菜、酸奶、奶酪、香肠等发酵产品中,目前多被应用于食品、医药、微生物等领域,迄今为止有关食窦魏斯氏菌合成GABA的研究鲜有报道。

图3 15 株菌的16S rDNA扩增产物电泳图Fig.3 Electrophoresis of PCR-amplified 16S rDNA genes from 15 strains

表1 15 株菌的16S rDNA鉴定结果Table 1 Results of 16S rDNA identification of 15 strains
2.4 耐酸性实验结果
鱼酱酸发酵过程中由于各种微生物产生有机酸,使其体系的pH值逐渐降低。用于接菌发酵的菌株应具备较好的耐酸性,既能在酸性体系内展现其发酵特性,又能承受人体胃部的低酸性环境发挥其益生性。由表2可以看出,具有产GABA能力的15 株乳酸菌,耐酸性各不同,但均能在pH 2.5条件下存活,这表明在低酸性环境下也有较好的生长活力。其中Y113、Y123、Y133这3 株魏斯氏乳酸菌的耐酸能力低于其他菌株,这可能与其适宜在pH 3.0~9.5范围内生长有关[27]。此外,植物乳杆菌在鱼酱酸发酵后期逐渐成为优势菌种,快速产酸缩短发酵周期,其较强的耐酸能力可能是多种耐酸机制共同作用的结果,如中和过程、生物膜和细胞密度、质子泵、保护和修复细胞大分子、前期适应和交叉保护使用保护物质等[28]。
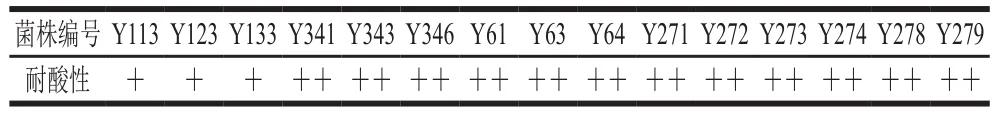
表2 15 株菌在pH 2.5培养基中培养3 h后的存活情况Table 2 Survival of 15 strains after cultured pH 2.5 medium for 3 h
2.5 耐胆盐性实验结果
小肠内胆盐质量分数在0.3%左右,一般食物通过需要1~4 h,因此作为接种发酵的菌株应具备一定的耐胆盐性,能在通过小肠时仍然保持活力发挥益生作用。有学者对发酵产品中的乳酸菌进行胆盐耐受性实验,发现大部分乳酸菌能够耐受0.2%~0.4%的胆盐,有些菌的胆盐耐受性更高[29-30]。由图4可以看出,15 株具有产GABA能力的乳酸菌在含质量分数0.3%的胆盐培养基中培养24 h后仍显示出较好的耐胆盐能力。其中,Y113、Y64、Y271、Y272、Y279显示出较强的耐受能力。高浓度的胆汁可溶解磷脂,破坏细胞膜脂质双层结构,引起裂解、细胞内物质丢失、葡萄糖摄取丧失和细胞死亡,除此之外,还会引起蛋白质错误折叠、DNA和RNA氧化损伤以及细胞内酸化。由于胆汁和胆盐产生的应激反应的复杂性,微生物胆盐耐受性就需要不同的耐受机制,包括外排泵的存在、胆盐水解酶的数量、细胞维持细胞内稳态的内在能力以及细胞膜结构和组成的改变[31]。乳酸菌较强的耐胆盐性可能与其菌体中脂肪酸的构成相关,饱和脂肪酸/不饱和脂肪酸比例高有利于菌株在含胆盐的环境中维持细胞的完整性[32]。同时,乳酸菌在胆盐存在环境中可以分泌胆盐水解酶来降低胆盐对自身细胞的危害。

图4 15 株菌在不同质量分数胆盐的培养基中培养24 h后的OD600 nm值Fig.4 OD600 nm measured for 15 strains cultured in medium with different concentrations of bile salts for 24 h
2.6 氨基酸脱羧酶活性实验结果
生物胺广泛存在于人体、动物、植物、微生物体内以及人类日常食品中,但是生物胺总量超过危害值时会引起中毒现象。发酵鱼制品的加工满足生物胺形成的几个条件[33]:大量游离氨基酸、具有氨基酸脱羧酶活性的微生物、适合具有脱羧酶活性及脱羧酶合成的微生物的生长环境。游离氨基酸在发酵过程中易被微生物产生的特定脱羧酶脱羧形成生物胺,而氨基酸脱羧酶呈阴性的菌株则能够很大程度降低发酵制品中生物胺的含量,提高产品的安全性。15 株产GABA乳酸菌中,均未出现培养基变为紫色的现象,说明菌株不具备氨基酸脱羧酶活性,无法促进生物胺的形成。将其用于接菌发酵,既能改进鱼酱酸发酵工艺,又可保障鱼酱酸的安全性。
2.7 抑菌实验结果
存在于传统发酵制品的乳酸菌可以产生一些抗菌物质,如细菌素。细菌素是一类新型天然防腐剂,它是由某些细菌在代谢过程通过核糖体合成机制产生的分泌在胞外的一类具有抑菌活性的多肽或前体多肽[34-35]。乳酸菌作为细菌素的主要产生菌株,可应用于接菌发酵或作为抑菌剂加入到食品中产生作用。如表3所示,15 株菌的菌液显示出明显的抑菌作用,很有可能是由于菌液中存在微生物竞争、过氧化氢或有机酸。为排除菌体或其代谢产物引起的抑菌作用,将离心所得上清液进行抑菌实验,排除有机酸、过氧化氢的抑菌实验。结果显示Y113、Y123、Y133未出现明显的抑菌圈,而其他菌株仍然具有抑菌性,这说明具有抑菌性的菌株可能是在生长代谢过程中产生了其他的抑菌物质。为进一步确定产生的抑菌物质是否具有蛋白质性质,使用胰蛋白酶、胃蛋白酶、中性蛋白酶对发酵上清液进行处理。结果显示其余12 株具有抑菌性的菌株,对蛋白酶较敏感,其发酵上清液基本无抑菌效果。这表明12 株菌可能产生蛋白质类的抑菌物质,若用于接菌发酵,可提升产品的安全性,但仍需对这些蛋白质类的抑菌物质作进一步的研究。
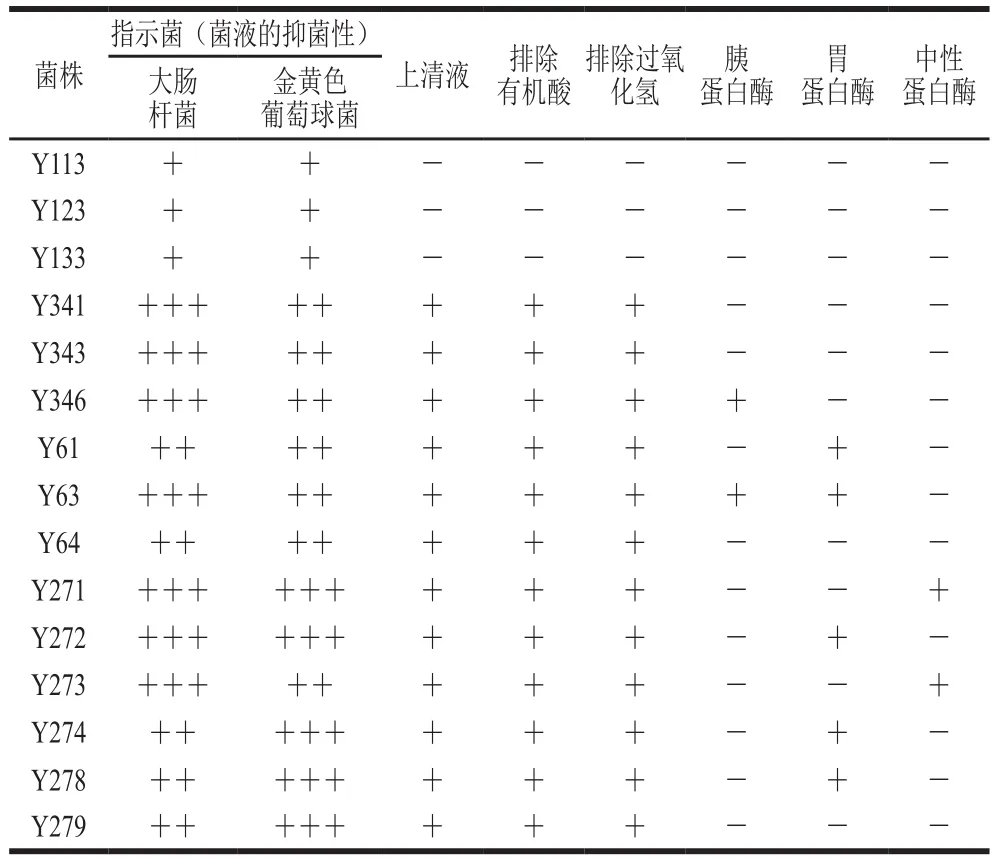
表3 15 株菌的抑菌性Table 3 Antibacterial activity of 15 strains
2.8 基于PCA的多变量分析
采用基于PCA的多变量分析对不同分离菌株的数据进行技术表征,以合成GABA的量、耐酸性、耐胆盐性、氨基酸脱羧酶活性、抑菌性为指标。如图5所示,不同菌株在GABA含量及发酵特性上存在显著差异。菌株Y64和菌株Y279在耐胆盐性、耐酸性、抑菌性上表现较佳,同时有较高的GABA合成能力,又兼具较好的发酵性能。3 株魏斯氏菌中Y113在GABA合成能力上表现更佳,但在发酵性能上稍欠缺。因此,选择菌株Y279、Y64和Y113进行菌株生长特性的研究。

图5 利用PCA筛选15 株菌中潜能菌株Fig.5 PCA plot for discrimination of 15 strains
2.9 生长曲线、pH值及产酸速率实验
经以上发酵特性实验,从15 株实验菌中得到一株耐酸、耐胆盐、无氨基酸脱羧酶活性,产GABA量最高的食窦魏斯氏菌Y113及2 株耐酸、耐胆盐、无氨基酸脱羧酶活性,具有较好的抑菌性、产GABA能力较好的植物乳杆菌Y64及Y279。对3 株产GABA乳酸菌进行生长曲线及pH值的测定,结果如图6所示,3 株菌培养至第2小时后进入对数生长期,当培养至第10小时后进入稳定生长期,说明3 株菌都能迅速达到适宜的活力,其中Y113在进入稳定期时出现下降趋势,可能是因为此时的生长条件、渗透环境或pH值不适宜菌株生长,促使菌体发生自溶。pH值变化趋势同生长曲线的趋势基本吻合,3 株菌在进入对数生长期后pH值迅速降低,其中2 株植物乳杆菌Y64和Y279呈现出快速产酸的能力。
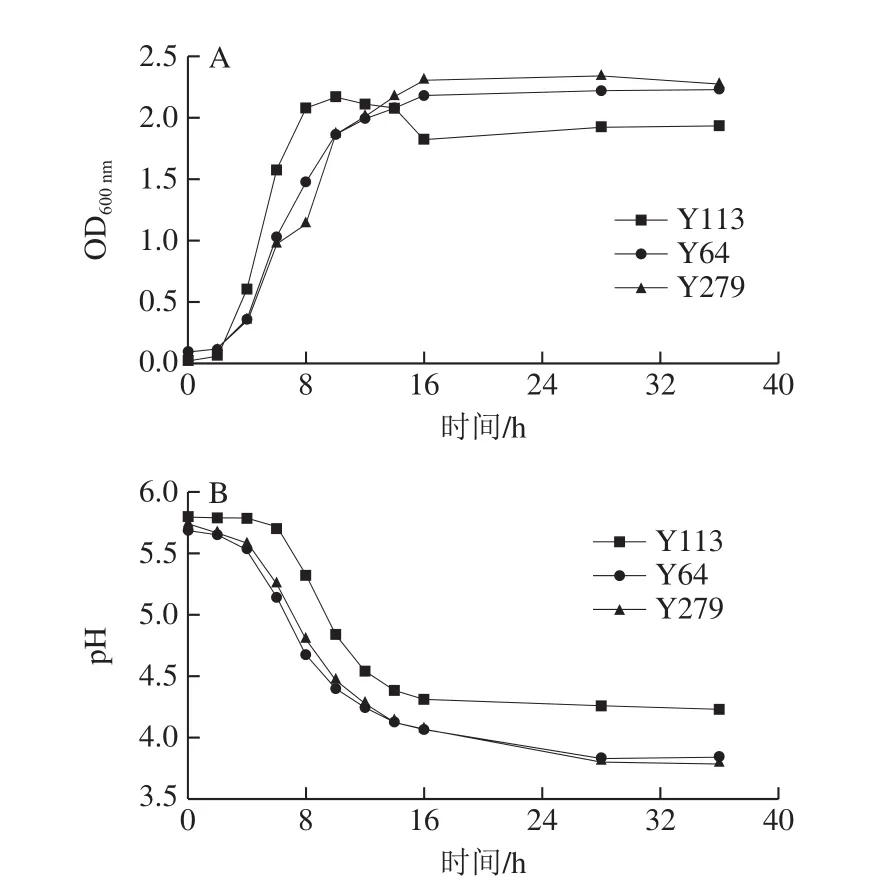
图6 3 株菌的生长曲线(A)和pH值(B)Fig.6 Growth curves (A) and acid production curves (B) of three selected strains
用于接种发酵的菌株应具有较好的产酸能力,乳酸菌利用碳水化合物快速发酵产生有机酸和抑菌物质,这样既可在发酵过程中抑制其他有害微生物的生长繁殖,又可缩短发酵周期,促进营养物质及色泽风味的形成。以菌株培养36 h内的产酸情况作为评价菌株产酸速率的指标,3 株菌株在37 ℃、36 h内的产酸速率如图7所示,Y113、Y64及Y279快速产酸,使所在体系pH值迅速下降。植物乳杆菌具有更高的产酸速率,3 株菌比较,Y113、Y64、Y279在第36小时的pH值分别为4.23、3.84和3.79。从pH值下降的趋势也可以看出,植物乳杆菌产酸速率快于食窦魏斯氏菌,显示出更快的产酸速率。因此,选用植物乳杆菌Y279或Y64进行接种发酵,可以缩短发酵周期,保障产品的安全性。

图7 3 株菌在36 h内的产酸速率Fig.7 Acid-producing activity of three strains
3 结 论
鱼酱酸蕴含产GABA乳酸菌与它优良品质的形成之间有密切联系,但此前并未对其产GABA乳酸菌进行研究。本研究从发酵鱼酱酸中筛选出117 株革兰氏染色阳性、接触酶阴性、可利用葡萄糖产酸的疑似乳酸菌。利用薄层色谱法及比色法对117 株疑似乳酸菌进行定性定量,得到15 株具有明显产GABA能力的菌株,经过生理生化实验得出15 株产GABA菌株均不产黏性、不产气、不产H2S,过氧化氢酶实验、明胶液化实验、硝酸盐还原实验、淀粉水解实验结果均为阴性。对这15 株产GABA菌株进行一系列发酵特性实验,得到一株产GABA量最高的食窦魏斯氏菌Y113及2 株发酵性能和益生效果优良,产GABA量较高的植物乳杆菌Y279和Y64。基于菌株Y279在发酵性能、益生效果和产GABA能力上的表现较为优秀,可将其用于鱼酱酸进行接种发酵。本研究为改善鱼酱酸发酵工艺,筛选出可应用于接种发酵的产GABA乳酸菌,对提升产品风味、营养价值,工业化生产提供了一定的理论依据。

