氨基酸对植物乳杆菌KLDS1.0391生长及细菌素合成的影响
赵 乐,张晓桐,刘利军,谢水琪,靳奇文,孟祥晨*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
植物乳杆菌(Lactobacillus plantarum)作为具有重要经济价值的乳酸菌被广泛应用于食品发酵与保鲜防腐领域,由于其代谢过程中会产生具有广谱抑菌特性、对热稳定且易被蛋白酶水解的细菌素,因而有作为天然食品生物防腐剂的巨大应用潜力[1]。有研究发现前体物质或代谢中间产物往往具有诱导目标产物合成的作用,又因为细菌素是蛋白质或多肽类物质,因此氨基酸可以作为合成细菌素的外源诱导物[2]。本课题组系统研究了L.plantarumKLDS1.0391产细菌素的特点[3],其所产细菌素N末端的氨基酸组成为缬氨酸-脯氨酸-酪氨酸-甘氨酸,但还不清楚该菌细菌素合成是否受上述氨基酸调节。有研究称,氨基酸不仅是细菌素的合成底物,还可能发挥着其他一些功能,如对细菌素合成、释放及调控过程中相关酶的诱导[4]。Vazquez等[5]在研究多种氨基酸及其组合方式对Nisin合成的影响时发现,生物质能的产生依赖于多种相互作用,而细菌素的产生仅受半胱氨酸和色氨酸的刺激,其中脯氨酸抑制Nisin的合成。易华西[6]在研究氨基酸种类及外源添加物对细菌素合成量的影响时,发现只有半胱氨酸和甘氨酸可显著诱导细菌素Bac-J23的合成。目前,氨基酸在调节信号分子的产生及调控细菌素合成相关基因的表达等方面的报道还很有限,且氨基酸对细菌素加工和释放过程中的转运蛋白、信号肽及组氨酸蛋白激酶等具有诱导作用也仅处于猜测阶段。因此,氨基酸对乳酸菌细菌素的调控机理还有待于进一步研究。
本研究旨在通过测定L.plantarumKLDS1.0391菌株在氨基酸胁迫下的生长及细菌素合成情况,并从基因水平上分析氨基酸对细菌素结构基因、群体感应相关基因及氨基酸代谢关键基因表达的影响,旨在为进一步研究氨基酸对细菌素的调控作用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
L.plantarumKLDS1.0391野生型菌株保藏于乳品科学教育部重点实验室;枯草芽孢杆菌(Bacillus subtilis)ATCC6633,购于中国药品生物制品检定所。
1.1.2 培养基
MRS培养基及LB培养基参考文献[7]配制;化学成分确定培养基(chemically defined medium,CDM)参照Vazquez等[5]的方法进行配制。
1.1.3 试剂
Primer ScriptTMRT Reagent Kit with gDNA Eraser反转录试剂盒、TB Green®Premix ExTaq™ II实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)试剂盒、DL5000/2000 DNA Marker 宝生物工程有限公司;细菌基因组DNA提取试剂盒、培养细胞/细菌总RNA提取试剂盒、dNTPs、TaqDNA polymerase天根生化科技有限公司;过氧化氢酶、乳酸(均为色谱纯) 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
2695高效液相色谱仪 美国Waters公司;Uvmini-1240紫外分光光度计 日本岛津公司;光学显微镜 上海光学仪器一厂;GL-21M高速冷冻离心机上海市离心机械研究所;DYY-10C型电泳仪 北京市六一仪器厂;凝胶成像系统 美国UVP公司;9700 PCR扩增仪 美国Applied Biosystem公司;Step One PlusTMreal-time PCR仪 美国Thermo Fisher公司;1000超微量分光光度计 美国Nanodrop公司;LGJ-1冷冻干燥机上海医用分析仪器厂。
1.3 方法
1.3.1 菌株的活化与培养
取-80 ℃冰箱中保藏的L.plantarumKLDS1.0391接种至MRS培养基中于37 ℃培养16 h,B.subtilisATCC6633接种至LB培养基中于30 ℃、120 r/min振荡培养16 h,活化3 代后用于实验。
1.3.2 氨基酸缺失对L.plantarumKLDS1.0391生长及细菌素合成的影响
取10 mL培养至稳定期的菌液,经离心后用磷酸盐缓冲液洗涤菌体3 次后重悬于该缓冲液中,再以2%接种量分别接种于MRS、CDM和20 种氨基酸分别单缺失的CDM中,37 ℃培养28 h,每隔2 h取样,在波长600 nm处测定光密度值(OD600nm),同时采用平板菌落计数法计数活菌数,绘制生长曲线,另取20 mL菌液用于细菌素效价测定。
1.3.3 细菌素效价的测定
菌液排除酸和过氧化氢的干扰,并经膜过滤后冻干浓缩,以B.subtilis作为上层指示菌,利用双层平板打孔法测量抑菌圈直径[8],并进行细菌素效价的换算[9],同时记录能观察到明显抑菌圈的最高稀释倍数(D)。抑菌圈直径与稀释度关系见式(1):

式中:R为抑菌圈直径/mm;d为稀释度,即上样量/稀释倍数;a、b为待测系数。
抑菌圈直径与细菌素效价的换算见式(2):

据此获得37 ℃条件下L.plantarumKLDS1.0391在CDM培养24 h的细菌素抑菌活性标准曲线:y=9.421 1x+0.693 9,其中,y代表抑菌圈直径(mm),x代表稀释度的对数值。
1.3.4 乳酸含量的测定
分别取在20 种氨基酸单缺失的CDM中培养24 h后的发酵液各1.5 mL,12 000 r/min离心15 min,将发酵上清液经0.22 μm滤膜过滤后,采用高效液相色谱法测定乳酸含量,以全CDM为对照。
色谱条件[10]:色谱柱:Biorad Aminex HPX-87H(300 mm×7.8 mm);流动相:5 mmol/L硫酸溶液;检测波长:254 nm;流速:0.5 mL/min;柱温:65 ℃;进样量:10 μL。
在上述条件下,获得乳酸保留时间为(14.54±0.02)min,标准曲线为y=920 334x-37 495,R2=0.998 9,其中y表示乳酸液相色谱中的峰面积(mV·s),x表示乳酸的质量浓度(g/L)。
1.3.5 赖氨酸胁迫对L.plantarumKLDS1.0391生长及细菌素合成的影响
调节CDM中赖氨酸质量浓度分别为0.0、0.1、0.2、0.5、1.0、2.0、5.0、10.0 g/L,以2%接种量接种L.plantarumKLDS1.0391,37 ℃培养24 h后,测定细菌素效价并采用平板菌落法计数活菌数量。
1.3.6 real-time PCR测定基因相对表达量
1.3.6.1 菌体收集
将L.plantarumKLDS1.0391以2%接种量分别接种至全CDM、赖氨酸单缺失的CDM,以及赖氨酸添加量分别为0.1、1.0、2.0 g/L的CDM中,37 ℃培养24 h后,取500 μL于4 ℃、12 000 r/min离心2 min后收集菌体。
1.3.6.2 RNA的提取及逆转录
按照天根RNA prep Pure培养细胞/细菌总RNA提取试剂盒说明书提取菌体总RNA,根据所提取的RNA浓度,通过去除基因组DNA反应对即将逆转录的RNA含量进行归一化。具体按Primer ScriptTMRT Reagent Kit with gDNA Eraser试剂盒说明书在冰浴条件下混合体系并合成cDNA,合成后于-20 ℃保存。
1.3.6.3 real-time PCR引物设计
采用Primer 5.0软件设计real-time PCR所用引物(表1),部分引物的设计参照文献[11]。

表1 real-time PCR引物及条件Table 1 Real-time PCR primers and conditions
1.3.6.4 real-time PCR扩增实验
以16S rDNA作为内参基因,反应体系为20 μL,反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃延伸30 s,共进行40 个循环,并记录循环阈值(Ct值)。以2-ΔΔCt相对定量法分析不同样品基因的表达差异。
1.4 数据分析
2 结果与分析
2.1 L.plantarum KLDS1.0391在MRS与CDM中的生长及抑菌活性
L.plantarumKLDS1.0391在CDM和MRS中生长的迟滞期分别为0~2 h和0~4 h,前者在10 h后进入稳定期,后者在12 h后进入稳定期(图1)。菌株在MRS和CDM中培养24 h时OD600nm分别为1.79±0.02和1.32±0.01,抑菌圈直径分别为(23.36±0.32)mm和(19.99±0.45)mm。虽然L.plantarumKLDS1.0391在MRS培养基中比CDM中生长能力更强,但CDM的组成成分明确,培养24 h时菌体浓度满足后续实验要求,所以选择CDM作为后续氨基酸单缺失实验的基础培养基。由于抑菌活性在培养24 h时达到最大(图1),因此选择培养24 h取样测定抑菌活性。

图1 L.plantarum KLDS1.0391在MRS与CDM中的生长及抑菌活性Fig.1 Growth and antibacterial activity of L.plantarum KLDS1.0391 in MRS and CDM
2.2 氨基酸单缺失对L.plantarum KLDS1.0391生长和抑菌活性的影响
采用单个氨基酸遗漏技术探究氨基酸对L.plantarumKLDS1.0391生长的影响,结果见图2。研究发现大部分情况下该菌能够在单独缺失一种氨基酸的培养基中生长良好,并于9~10 h达到对数期末期。苯丙氨酸家族氨基酸中(图2A),除色氨酸的缺失不利于菌体生长外,其余氨基酸的缺失对菌体生长影响较小;丙酮酸家族氨基酸中(图2B),缬氨酸和丙氨酸的缺失会严重抑制该菌生长,培养12 h时OD600nm分别为0.55±0.01和0.54±0.02,而亮氨酸和异亮氨酸的缺失对KLDS1.0391的生长基本没有影响,发酵12 h时OD600nm分别为0.94±0.01和0.93±0.02,菌株基本保持了在全CDM中的生长水平;丝氨酸家族氨基酸中(图2E),甘氨酸的缺失导致该菌生长迟缓,培养12 h时OD600nm仅为0.50±0.01。结果表明,当CDM中缺失丙氨酸(图2B)、天冬氨酸(图2C)、缬氨酸(图2B)、甘氨酸(图2E)或谷氨酸(图2D)会严重阻碍L.plantarumKLDS1.0391的生长,培养14 h后OD600nm仅维持在0.50~0.65之间,推测上述5 种氨基酸为L.plantarumKLDS1.0391生长的必需氨基酸。


图2 L.plantarum KLDS1.0391在缺失单氨基酸的CDM中的生长Fig.2 Growth of L.plantarum KLDS1.0391 in CDM medium deficient in single amino acids
图3结果表明,天冬氨酸、组氨酸、异亮氨酸、亮氨酸、脯氨酸、苏氨酸、酪氨酸、天冬酰胺及谷氨酰胺缺失,导致L.plantarumKLDS1.0391菌落总数和细菌素合成量均显著降低(P<0.05);谷氨酸、甘氨酸、丙氨酸、半胱氨酸、精氨酸、苯丙氨酸、丝氨酸、色氨酸及缬氨酸缺失仅影响菌体生长,对细菌素合成无明显影响。经平板菌落总数计数发现,与全CDM相比,当培养基中分别缺失赖氨酸和甲硫氨酸,活菌数分别下降了3.09%和2.28%,但两者发酵上清液的抑菌活性则分别降低了44.21%和34.10%(图3)。由此推测,由于赖氨酸和甲硫氨酸单缺失导致的生长稍缓慢不是该菌细菌素合成量显著下降的主要原因。

图3 L.plantarum KLDS1.0391在氨基酸单缺失的CDM中培养24 h后的活菌数量及抑菌活性Fig.3 Antibacterial activity of L.plantarum KLDS1.0391 cultured in CDM medium deficient in single amino acids for 24 h
2.3 氨基酸单缺失对L.plantarum KLDS1.0391培养上清液乳酸含量的影响
与全CDM相比,赖氨酸、酪氨酸、异亮氨酸、亮氨酸、甲硫氨酸、天冬氨酸、天冬酰胺、脯氨酸及苏氨酸这9 种氨基酸分别单缺失后,乳酸含量升高。其中,赖氨酸及甲硫氨酸单缺失后细菌素抑菌活性下降,而乳酸含量较全CDM对照组分别提高了5.10%及4.20%。其余11 种氨基酸的单缺失均导致乳酸含量下降,其中丙氨酸单缺失后乳酸含量较对照组下降了16.16%。由此推测,氨基酸单缺失使得胞内碳源代谢重新定向,不同氨基酸的缺失导致碳源流向乳酸合成支路的流量存在较大差异。

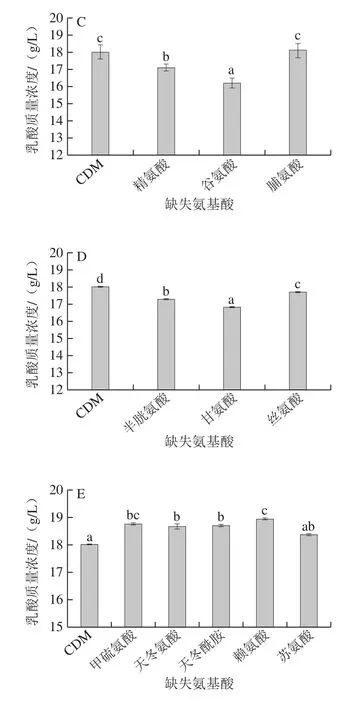
图4 L.plantarum KLDS1.0391在氨基酸单缺失的CDM中培养24 h后的乳酸含量Fig.4 Lactic acid content in the culture supernatant of L.plantarum KLDS1.0391 cultured in CDM medium deficient in single amino acids for 24 h
2.4 外源赖氨酸对L.plantarum KLDS1.0391生长和抑菌活性的影响
上述研究结果表明,赖氨酸显著影响该菌株抑菌活性,因此进一步研究了外源添加不同质量浓度赖氨酸对该菌生长及抑菌活性的影响,结果表明:菌体数量随外源赖氨酸添加量变化无显著差异(P>0.05)(图5A)。在赖氨酸质量浓度达到2.0 g/L前,随其质量浓度递增细菌素合成量也随之增大(图5B)。当赖氨酸质量浓度为0.1 g/L和1.0 g/L时,细菌素抑菌活性分别为1 638.54 AU/mL和2 002.83 AU/mL。继续增至2.0 g/L时,抑菌活性达到最大值2 260.98 AU/mL。当赖氨酸质量浓度超过2.0 g/L后,随其质量浓度的升高抑菌活性反而下降。当其质量浓度增至5.0 g/L和10.0 g/L时,抑菌活性分别为2 232.11 AU/mL和1 993.49 AU/mL。该结果显示,过量赖氨酸会产生反馈抑制效果,胁迫或抑制细菌素的合成分泌。由此表明赖氨酸对菌体生长无显著影响,但却与细菌素分泌表达密切关联。

图5 L.plantarum KLDS1.0391在添加赖氨酸CDM中培养24 h后的菌体数量(A)及抑菌活性(B)Fig.5 Growth (A) and antibacterial activity (B) of L.plantarum KLDS1.0391 cultured in CDM medium supplemented with Lys
2.5 赖氨酸胁迫对L.plantarum KLDS1.0391相关基因表达的影响
2.5.1 菌株在赖氨酸缺失CDM中培养时相关基因的表达L.plantarumKLDS1.0391在缺失赖氨酸的培养基中培养至24 h时,细菌素结构基因plnEF、群体感应调节基因plnD与plNC8HK的表达量均显著下调,而编码赖氨酸合成途径中关键酶的基因dapG和yclM表达量却显著上调(图6)。其中基因plnEF、plnD与plNC8HK分别下调33%、18%和23%(P<0.01),而基因dapG和yclM分别上调至对照组的2.46 倍和1.74 倍。表明基因dapG和yclM在氨基酸合成通路中起协同作用,赖氨酸缺失后二者表达上调进而合成蛋白质以保证菌株正常生长代谢。

图6 L.plantarum KLDS1.0391在赖氨酸缺失CDM中培养24 h后相关基因的表达Fig.6 Expression of related genes in L.plantarum KLDS1.0391 cultured in Lys-deficient CDM for 24 h
2.5.2 菌株在添加赖氨酸CDM中培养时相关基因的表达菌株在赖氨酸质量浓度为0.1 g/L条件下培养24 h后,基因plnEF、plnD与plNC8HK分别上调至对照组的1.49、1.22 倍和1.30 倍(图7);当赖氨酸质量浓度增至2.0 g/L时,上述基因分别上调2.10、1.72 倍和1.81 倍(P<0.01)。研究结果显示,CDM中,随赖氨酸添加量增大,细菌素合成相关基因上调水平也随之增加。而基因dapG和yclM却受诱导表达下调,当赖氨酸质量浓度为1.0 g/L时,二者分别下调65%和50%;当外源添加2.0 g/L赖氨酸后,二者则分别下调69%和58%。综上,与细菌素及氨基酸合成相关的基因上下调倍数具有浓度依赖性。
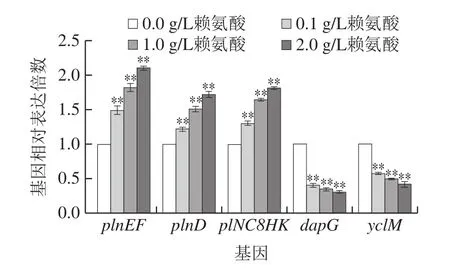
图7 L.plantarum KLDS1.0391在添加赖氨酸CDM中培养24 h后相关基因的表达Fig.7 Expression of related genes in L.plantarum KLDS1.0391 cultured in CDM medium supplemented with Lys for 24 h
3 讨 论
本研究发现L.plantarumKLDS1.0391在单氨基酸缺失CDM中的生长较全CDM均有所下降,这可能是由于营养物质不全或氨基酸未能达到最佳比例,导致菌体代谢效率下降进而影响生长繁殖。Chopin[12]研究发现谷氨酸、丙氨酸、半胱氨酸、组氨酸、亮氨酸及异亮氨酸6 种氨基酸是大部分乳酸菌生长的必需氨基酸,而Amoroso等[13]研究了4 株不同酒酒球菌对氨基酸的需求,结果表明大多数乳酸菌生长所不可或缺的氨基酸分别是天冬酰胺、异亮氨酸、半胱氨酸和酪氨酸。本实验结果表明,丙氨酸、天冬氨酸、缬氨酸、甘氨酸和精氨酸是L.plantarumKLDS1.0391生长的必需氨基酸,由此可以看出菌株对不同氨基酸的需求模式因种属差异而有明显不同。本研究中,亮氨酸和异亮氨酸的缺失几乎不影响该菌株生长,由氨基酸代谢通路可知,异亮氨酸可经苏氨酸脱氨或苏氨酸脱氨基酶催化天冬氨酸等多种途径合成[14],因此该菌株在外源缺失异亮氨酸时还可正常代谢。Chen He等[15]研究发现谷氨酸和赖氨酸对Streptococcus thermophilus的生长有显著促进作用,且活菌数与氨基酸浓度呈正比关系。本实验谷氨酸家族氨基酸中,除谷氨酸的缺失显著影响L.plantarumKLDS1.0391的生长外,其余氨基酸的缺失对菌体生长影响不大,这与Chen He等[15]的研究结果基本一致。L.plantarumKLDS1.0391在甘氨酸缺失后菌体几乎停止生长,稳定期末期OD600nm仅为0.50±0.01,有研究报道甘氨酸可调控胞内多种代谢途径,如糖异生、嘌呤合成、谷胱甘肽的合成途径等[16],由此推测甘氨酸缺失可间接导致胞内能源物质减少进而影响菌体生长。Stuart等[17]研究发现精氨酸能够作为菌株代谢合成某些生长必需营养因子的前体物质,精氨酸会通过代谢产能(ADI途径)进而促进菌体量增加。本研究发现当培养基中缺失精氨酸时,L.plantarumKLDS1.0391的生长速率减缓,再次说明精氨酸可通过ADI途径为菌体生长提供某种重要前体物质及能量。
目前,可通过筛选细菌素高产菌株[18]、优化发酵条件[19]、异源表达[20]、胁迫刺激和诱导调控等技术使乳酸菌细菌素高效表达[21],但多数研究都聚焦于遗传学方法[22],而通过外源物质诱导提高细菌素是基于代谢及转录水平的调控且不涉及安全问题,因此有必要系统的研究培养基成分对细菌素的调控。Kuipers[23]和Diep[24]等发现单个氨基酸可诱导细菌素或相关肽的合成,本研究发现一定浓度的赖氨酸对细菌素合成起正向调控作用。除此之外,Yi Huaxi等[2]研究发现半胱氨酸和甘氨酸能提高细菌素产量;Devuyst[25]验证了半胱氨酸在用量低于0.1%时对Nisin的合成起正向诱导作用;Vazquez等[5]认为仅半胱氨酸和色氨酸能够刺激Nisin的合成,这与Devuyst[25]的结果存在差异,由此表明,诱导细菌素合成的外源氨基酸可因菌属种类而存在较大差异。本研究发现赖氨酸的缺失对菌体生长无显著影响,但却导致细菌素合成量显著下降(P<0.05)。Devuyst[25]与Vazquez等[5]认为氨基酸不仅作为细菌素合成的前体,还可能作为诱导剂诱导细菌素合成及分泌过程中相关酶的活性。综上推测,赖氨酸可能作为底物直接参与L.plantarumKLDS1.0391细菌素的合成,还可能对细菌素加工释放相关酶及蛋白具有诱导作用。
前期课题组将L.plantarumKLDS1.0391全基因组测序结果与5 种完全测序的L.plantarum(WCFS1、NC8、ZJ316、LZ206等)进行比对,发现其细菌素基因簇包含plnBD、plnEFI、plnGHSTUV和plnXY4 个操纵子[26]。其中,plnEF编码细菌素结构蛋白,plNC8HK编码组氨酸蛋白激酶,plnD编码细胞质感应调节蛋白[11]。研究结果显示:菌株在赖氨酸单独缺失下培养24 h后,基因plnEF、plNC8HK和plnD均显著下调(P<0.01),而添加一定质量浓度的赖氨酸后三者显著上调(P<0.01),表明赖氨酸会显著影响双组分调控系统,进而控制细菌素的合成。天冬氨酸及谷氨酸代谢途径是合成赖氨酸、甲硫氨酸以及异亮氨酸等多种分支氨基酸的有效途径,因此研究氨基酸合成代谢途径中的关键基因,可进一步深入了解氨基酸调控细菌素合成的机制。Jakobsen等[27]研究发现过表达编码天冬氨酸激酶的基因dapG、lysC和yclM,野生型甲醇杆菌MGA3中赖氨酸产量增加。Nardal等[28]克隆并测序了甲醇杆菌天冬氨酸代谢途径中的8 个基因以阐明它们对赖氨酸合成的调控作用,其中dapG编码天冬氨酸激酶I蛋白,yclM编码天冬氨酸激酶III蛋白。本研究发现,合成赖氨酸和甲硫氨酸的关键基因dapG和yclM在赖氨酸单独缺失后,两者表达均显著上调,表明氨基酸缺失时,为保证菌体正常生长代谢,细菌需新合成蛋白质替代受损或功能失常的蛋白质进而抵御氨基酸缺失;而培养基中一定质量浓度的赖氨酸胁迫导致上述两种基因表达下调,表明外源赖氨酸对二者的表达起反馈抑制作用。
目前,随着生物信息学的快速发展,采用转录组、蛋白质组及代谢组等多组学技术研究乳酸菌功能性代谢产物的合成机理,已被广泛应用于食品领域[29]。有报道称,氨基酸对其他微生物的代谢产物具有调控作用。甲硫氨酸可诱导异青霉素N合成酶等进而刺激头孢菌素C的合成,色氨酸既可作为麦角生物碱合成的底物,也可作为外源诱导物发挥作用[30]。本实验发现,赖氨酸显著影响L.plantarumKLDS1.0391细菌素的合成,但具体作用机制还有待利用生物信息学进一步阐明。
4 结 论
结果表明,天冬氨酸、组氨酸、异亮氨酸、亮氨酸、脯氨酸、苏氨酸、酪氨酸、天冬酰胺及谷氨酰胺缺失后菌株的生长能力及细菌素合成量均显著降低(P<0.05)。赖氨酸缺失及过量对菌体生长无显著影响,但却显著影响细菌素的合成。当外源赖氨酸质量浓度达到2.0 g/L前,细菌素抑菌活性随赖氨酸添加量的增大而增大,赖氨酸可能作为细菌素合成底物正向诱导该菌细菌素合成。当赖氨酸质量浓度超过2.0 g/L后,过量赖氨酸对细菌素合成起反馈抑制作用。基因dapG和yclM在氨基酸合成通路中起协同作用,赖氨酸缺失后二者表达显著上调进而合成蛋白质以保证菌株正常代谢。

