基于酸度控制的吸收光谱法测定饮料中共存的柠檬黄和日落黄
江 虹,庞向东,蒋 翠,冉红杰,付 玲,刘 璐
(长江师范学院化学化工学院,重庆 408100)
食品中常用色素分为天然色素和合成色素两大类,合成色素具有价廉、色鲜且不易褪色的优点,在食品工业中得到广泛应用。但合成色素若食用过多,会对人体产生一定的不安全性或危害性(如头痛、腹泻、哮喘、过敏甚至致癌等),因此,对食品中合成色素进行研究有着重要意义。为了保障人们的身体健康及饮食安全,GB 2760—2014《食品添加剂使用标准》中对添加剂的使用作出专项的限量规定,明确指出,饮料中柠檬黄和日落黄的加入量不得超过0.10 g/kg,可见,建立快速、简便检测食品中共存色素的方法具有重要的研究意义。近年来,国内外对柠檬黄和日落黄的检测研究主要有电化学法[1-9]、高效液相色谱法[10-16]、高效薄层色谱法[17]、荧光法[18]及分光光度法[19-26]等,GB 5009.35—2016《食品中合成着色剂的测定》采用高效液相色谱法,这些方法通常需对共存色素进行吸附分离处理后进行测定,操作较为复杂。所报道的分光光度法除用较复杂的吸附分离处理外,还可根据吸收曲线的重叠情况采用较复杂的解联立方程组的办法解决共存色素的含量检测问题[23-26]。本实验以乙基紫作为探针,采用控制酸度的吸收光谱法研究饮料中共存色素——柠檬黄与日落黄的含量问题,此法不需分离,只需在同一体系中控制溶液酸度,便可直接测定共存的柠檬黄和日落黄。
1 材料与方法
1.1 材料与试剂
饮料:橙味、苹果味、香蕉味、柠檬味、橙味、苏打味、橙蜜味、橙味、橙汁、青柠汁(编号依次为1#~10#),均购自本地超市。
柠檬黄标准物质(≥98%,Lot:A3J6L1)、日落黄标准物质(≥98%,Lot:JN1103RA14)均为北京盛世康普化工技术研究院生产,由北京普析科技有限公司提供。
乙基紫(分析纯) 成都艾科达化学试剂有限公司;盐酸(HCl)、氨水(NH3·H2O)(均为分析纯) 重庆川东化工(集团)有限公司;氨丁三醇(Tris)(分析纯)河南天孚化工有限公司;实验用水为自制超纯水。
1.2 仪器与设备
U-3010型紫外-可见分光光度计 日本日立公司;KQ-200VDE型超声波清洗机 昆山市超声仪器有限公司;PHS-3C型酸度计 上海虹益仪器仪表有限公司。
1.3 方法
1.3.1 溶液配制
柠檬黄、日落黄标准溶液:分别准确称取一定量的柠檬黄和日落黄标准物质(精确至±0.000 1 g),用水溶解并分别定容至250 mL,配成1.00×10-3mol/L贮备液,操作液为1.00×10-4mol/L,存于4 ℃冰箱中;乙基紫溶液:准确称取适量乙基紫,用水溶解并定容至500 mL,配成1.00×10-3mol/L;HCl溶液:0.10 mol/L;Tris溶液:0.20 mol/L;Tris-HCl溶液:用酸度计测定,配成pH 3.5~9.5。
1.3.2 样品处理
精密移取1#~10#饮料各30.0 mL,并准确称其质量(精确至±0.000 1 g),分别置于小烧杯中,45 ℃超声20 min,加适量水,搅拌,再超声10 min,用NH3·H2O调至中性,再超声10 min,取出,冷至室温,定量转移至100 mL容量瓶中,用水定容。
1.3.3 实验方法
精密移取适量柠檬黄(或日落黄)标准溶液,置于10 mL具塞比色管中,加入1.00 mL pH 5.69 Tris-HCl溶液(柠檬黄体系)和1.00 mL pH 8.68 Tris-HCl溶液(日落黄体系),再各加入2.00 mL乙基紫溶液,用水定容至10 mL,摇匀,待反应10 min后,以试剂空白作参比,在波长506 nm处测定柠檬黄体系溶液的吸光度,在波长646 nm处测定日落黄体系溶液的吸光度。
1.4 数据处理
采用Excel软件进行数据统计,Origin软件制图。
2 结果与分析
2.1 吸收光谱特征
反应机理:乙基紫是一种三苯甲烷类的碱性染料,在溶液中以阳离子形式存在;柠檬黄结构上有磺酸根离子和羧酸根离子,日落黄结构上有磺酸根离子,在溶液中Na+离去后,均以阴离子形式存于溶液中;于是阴、阳离子以静电引力相作用分别生成乙基紫-柠檬黄和乙基紫-日落黄的二元离子缔合物,其体系吸收光谱见表1。

表1 柠檬黄-乙基紫体系与日落黄-乙基紫体系在不同酸度下的吸收光谱特征Table 1 Absorption spectral characteristics of tartrazine-ethyl violet system and sunset yellow-ethyl violet system under different acidities
从图1A可知,单独的柠檬黄溶液和单独的日落黄溶液分别在波长426 nm和480 nm处有一较大的吸收峰(曲线1和曲线2),两曲线间有重叠(即相互间有干扰),因此不能直接分别测定2 种物质的含量。

图1 柠檬黄-乙基紫体系与日落黄-乙基紫体系的吸收光谱Fig.1 Absorption spectra of tartrazine-ethyl violet system and sunset yellow-ethyl violet system
如果在柠檬黄和日落黄的pH 5.69 Tris-HCl溶液中加入乙基紫溶液,乙基紫与柠檬黄和日落黄均可以静电引力结合生成离子缔合物,在光谱曲线上出现具有多个特征吸收峰的新光谱,图1A中曲线4和曲线5,与曲线3的吸收峰(594 nm)比较,曲线4和曲线5均有波移现象,这说明乙基紫与柠檬黄和日落黄均可反应生成新物质。再比较曲线4和曲线5可知,柠檬黄体系在酸性条件(pH 5.69)下波长506 nm处有一较大的负吸收峰,而日落黄在此处的吸收几乎近于0;柠檬黄体系在波长420 nm和波长655 nm处分别还有一较大的正吸收峰,但日落黄在此两波长下也有较大吸收;故可选择在波长506 nm处测定柠檬黄,日落黄不干扰。日落黄体系在pH 5.69酸性条件下,虽有较大特征吸收峰,但柠檬黄也有较大吸收,对其干扰严重,因此在酸性条件下不能单独测定共存的日落黄。
由图1B可知,在pH 8.68 Tris-HCl条件下,乙基紫可与柠檬黄和日落黄反应,柠檬黄体系出现2 个较大的负吸收峰(曲线2),日落黄体系出现1 个较大的正吸收峰(曲线1)。比较曲线1和曲线2可知,在此弱碱性条件下,均不能在波长496 nm和波长626 nm处单独测定柠檬黄(日落黄有干扰),但可以在波长646 nm处单独测定日落黄(柠檬黄的吸光度近于0,不干扰日落黄的测定)。
从图1C可知,在波长506 nm处,柠檬黄在一定范围内的质量浓度与体系的负吸光强度有良好的线性关系,可用于柠檬黄的定量分析。从图1D可知,在波长646 nm处,日落黄在一定范围内的质量浓度与体系吸光度也有良好的线性关系,可用于日落黄的定量分析。故可以在波长506 nm处,pH 5.69 Tris-HCl条件下,单独测定共存的柠檬黄(日落黄不干扰);在波长646 nm处,pH 8.68 Tris-HCl条件下,单独测定共存的日落黄(柠檬黄不干扰)。
2.2 适宜条件的选择
2.2.1 溶液酸度及用量
考察柠檬黄、日落黄标准操作液为1.00 mL,乙基紫溶液为2.00 mL时,1.00 mL不同pH值的Tris-HCl溶液对波长506 nm和波长646 nm处的柠檬黄-乙基紫体系与日落黄-乙基紫体系吸光度绝对值(|A|)的影响,见图2。可知,在波长506 nm及pH 5.69的Tris-HCl条件下,柠檬黄体系有相对最大的|A|(曲线1),日落黄体系的|A|近于0(曲线2),即在pH 5.69条件下,可以在波长506 nm处测定柠檬黄,日落黄不干扰;在波长646 nm及pH 8.68 Tris-HCl条件下,柠檬黄体系的|A|近于0(曲线4),而日落黄体系则有相对最大的|A|(曲线3),即在pH 8.68 条件下,可以在波长646 nm 处测定日落黄,柠檬黄不干扰。同时考察pH 5.69和pH 8.68的用量对各体系|A|的影响,结果表明,最适宜的用量均为1.00 mL。实验选用1.00 mL pH 5.69 Tris-HCl(柠檬黄体系)和1.00 mL pH 8.68 Tris-HCl(日落黄体系)分别在波长506 nm测定柠檬黄和在波长646 nm测定日落黄。

图2 溶液pH值对吸光度绝对值的影响Fig.2 Effect of solution pH on absolute absorbance value
2.2.2 乙基紫溶液的用量
考察柠檬黄、日落黄标准操作液为1.00 mL,pH 5.69(柠檬黄体系)和pH 8.68(日落黄体系)Tris-HCl溶液1.00 mL时,乙基紫溶液用量对波长506 nm处的柠檬黄体系和波长646 nm处的日落黄体系|A|的影响,见图3。两体系的乙基紫溶液用量为2.00 mL时,体系|A|相对最大,大于或小于2.00 mL,|A|有不同程度降低(表明乙基紫加入不够使反应不完全,或乙基紫加入过量,使自身聚集增强,从而导致|A|降低),故实验选用乙基紫的适宜用量为2.00 mL。
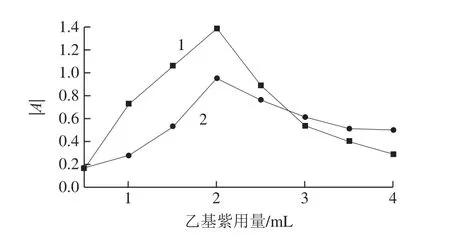
图3 乙基紫用量对吸光度绝对值的影响Fig.3 Effect of ethyl violet dosage on absolute absorbance value
2.2.3 反应时间及缔合物的稳定性
在上述选定的条件下,考察5~80 min对柠檬黄体系(506 nm,pH 5.69)及日落黄体系(646 nm,pH 8.68)对|A|的影响。结果表明:两体系在10 min内均可反应完全,生成缔合物的稳定时间至少1 h。故两体系的测定时间选在10 min后的稳定区进行。
2.3 标准曲线及灵敏度
准确移取0.00、0.20、0.60、1.00、1.40、1.80 mL 1.00×10-4mol/L柠檬黄标准溶液和0.00、0.20、0.60、1.00、1.40 mL 1.00×10-4mol/L日落黄标准溶液,按实验方法加入其他试剂溶液并用水定容,在选定时间及各体系波长下测定各溶液的吸光度。标准曲线及相关参数见表2。可见,该方法有较高灵敏度,可用于柠檬黄和日落黄的定量分析。

表2 日落黄和柠檬黄的标准曲线相关参数Table 2 Analytical figures of merit of absorption spectrometry for determination of sunset yellow and tartrazine
2.4 方法的选择性
考察波长506 nm处的柠檬黄体系(pH 5.69)和波长646 nm处的日落黄体系(pH 8.68)在相对误差不大于±5%时,某些共存物对柠檬黄(5.34 mg/L)及日落黄(4.52 mg/L)测定的影响。结果表明:100 倍的K+、Na+、NH4+、NO3-、Cl-、葡萄糖、蔗糖、甜蜜素、安赛蜜、L-亮氨酸、L-赖氨酸、L-组氨酸、D-苏氨酸、L-谷氨酸;50 倍的麦芽糖、D-果糖、D-色氨酸、L-白氨酸、甘氨酸、柠檬酸三钠、抗坏血酸、姜黄素、诱惑红;20 倍的Ba2+、Sr2+、Fe2+、Sn2+、Pb2+、Ca2+、Mg2+、C2O42-、CO32-、尿素、淀粉、胭脂红、赤藓红;3 倍的Fe3+、Al3+等不干扰测定。可见,柠檬黄体系和日落黄体系均有良好的选择性。
2.5 样品分析及加标回收实验
2.5.1 样液测定
取1.3.2节的1#~10#待测液各2.00 mL,按实验方法加入乙基紫溶液和各体系最佳酸度的Tris-HCl溶液(柠檬黄体系pH 5.65,日落黄体系pH 8.68),在波长506 nm处测定样液中柠檬黄含量,在波长646 nm处测定样液中日落黄含量,最后求出原始饮料中共存的柠檬黄和日落黄含量,并参考文献[23-26]和GB 5009.35—2016作对照实验,结果表明,其准确度和精密度均无显著性差异,本法与国标法的显著性检验结果见表3。

表3 饮料样品分析结果(n=5)Table 3 Comparison of results of absorption spectrometry and the national standard method for sunset yellow and tartrazine in beverage samples (n = 5)
2.5.2 回收实验结果
准确移取1#~10#饮料各30.0 mL并准确称量后分别置于小烧杯中,准确加入一定量的柠檬黄和日落黄标准贮备液,在45 ℃超声20 min,后续操作同样液的制备,最后转移至100 mL容量瓶中,用水定容。取该液2.00 mL,按实验方法测定各加标回收率,见表4。结果表明,方法有较高的准确度和精密度。

表4 饮料样品的加标回收实验(n=5)Table 4 Spiked recoveries of sunset yellow and tartrazine in beverage samples (n = 5)

续表4
3 结 论
建立乙基紫作为探针测定共存色素——柠檬黄和日落黄含量的酸度控制吸收光谱法,简便、快速,无需分离和进行复杂的数学处理,只需控制溶液酸度,便可达到分别测定共存物柠檬黄和日落黄的目的。方法有较高灵敏度、较宽线性范围和良好的选择性,准确度和精密度满足定量分析要求。该法适于饮料中共存柠檬黄和日落黄的定量分析。

