一种快速检测Hg2+的比率荧光传感器构建
贾宝珠,戚凯欣,樊怡飞,蔡美玲,廖彩霞,罗双子,古宗婷,蔡常宇,韦晓群,徐振林,罗 林,*
(1.广东第二师范学院生物与食品工程学院,广东 广州 510303;2.广东省食品质量安全重点实验室,华南农业大学食品学院,广东 广州 510642)
随经济的发展,重金属离子在各领域得到了广泛的应用,但与此同时也带来了环境污染与食品安全问题。我国是农业出口大国,而农产品中重金属污染成为我国食品贸易亟待解决的巨大障碍[1]。其中汞离子(Hg2+)是常见的剧毒重金属离子之一,其可通过水、空气和土壤等方式进行迁移,并以食物链的形式进入人体,在肝脏、肾脏、脑部等器官富集,从而危害人体的生命健康[2]。1956年日本因工业废水的排放造成食品、水源污染的“水俣病”[3]。因此,从贸易利益和国民食品安全的角度出发,世界各国对食品中Hg2+残留的监测日益严格,这也要求Hg2+的检测技术不断进步。
传统检测重金属离子主要基于仪器分析法,如原子吸收光谱法[4-8]、电感耦合等离子体发射光谱法[9-11]。仪器法准确度高、精密度好、检出限低,但是操作繁琐、设备成本高、较难用于现场的快速检测。随着纳米科技近些年的快速发展,利用纳米材料构建检测重金属离子的传感器已成为研究热点之一,其中荧光传感器由于灵敏度高、操作简便更备受关注。然而,现今检测Hg2+的荧光传感器大多为“turn-off”模式(荧光猝灭型)[12-13]和“turn-on”模式(荧光猝灭型)[14-16]。此类以单一荧光强度为检测信号的荧光传感器,易受探针浓度、pH值等外界环境因素的干扰,导致其精确度相对较弱。而通过测定在同一激发波长下两个发射强度比值变化的比率荧光传感器,由于两个发射峰强度受到的外界干扰一样,两者的比值一定程度上抵消了外界干扰因素,具有自带内标效应,因此该类传感器具有更高精密度、信噪比及灵敏度,已成为当前热门研究方向。Zhang Zhenzhen等[17]构建了基于荧光染料掺杂的镧系配位聚合物颗粒为Hg2+探针的比率荧光传感器,然而该传感器存在探针合成步骤复杂、有机染料荧光稳定性差等缺陷。
近年来新型荧光纳米材料如碳量子点、硅量子点、金属纳米簇等地不断涌现,因其具有生物相容性好、荧光光稳定性强、量子产率高等优点,已成为构建荧光探针的优选材料[18-20]。本研究通过水热法一步合成硅掺杂碳量子点(silicon-doped carbon quantum dots,Si-CDs),以溶菌酶(lysozyme,Lys)为配体及还原剂在碱性条件下还原氯金酸制备Lys稳定的金纳米簇(Lys-AuNCs),并以这两种荧光材料构建了一种能够快速、准确检测Hg2+的比率荧光传感器。其原理如图1所示,发蓝色荧光的Si-CDs的荧光强度(I470)不受Hg2+的影响作为比率荧光传感器的参比荧光信号;基于Au+-Hg2+间的亲金效应,Hg2+可高效猝灭Lys-AuNCs的红色荧光(I670),因此,以发红色荧光的Lys-AuNCs作为比率荧光传感器的响应荧光信号,通过荧光强度比值(I670/I470)即可对Hg2+浓度实现快速、准确的检测。

图1 比率荧光传感器检测Hg2+原理示意图Fig.1 Schematic diagram of the ratometric fluorescence sensor for Hg2+ determination
1 材料与方法
1.1 材料与试剂
华南农业大学鄱阳湖湖水、超市销售的屈臣氏矿泉水以及实验室自来水。
3-氨丙基三甲氧基硅烷、氯金酸 美国西格玛奥德里奇公司;柠檬酸、NaOH、磷酸二氢钠(NaH2PO4·2H2O)、磷酸氢二钠(Na2HPO4·12H2O)国药集团化学试剂有限公司;Lys 上海源叶生物科技有限公司。
1.2 仪器与设备
MS 3 basic旋涡混匀振荡器 德国IKA公司;SSW-600-2S电热恒温水槽 上海博讯实业有限公司;SpectraMax i3x多功能微孔板检测平台 美国分子仪器有限公司;Tecnai 12高分辨透射电子显微镜 荷兰FEI公司;ME 104电子分析天平、FE28-Standard pH酸度计德国梅特勒-托利多仪器有限公司;Unique R10超纯水净化仪 厦门锐思捷水纯化技术有限公司。
1.3 方法
1.3.1 Lys稳定的金纳米簇的制备
参照文献[21]方法合成。100 μL 10 mg/mL Lys溶液和100 μL 4 mmol/L HAuCl4溶液加到100 μL的水中混匀。大约5 min之后,加入10 μL 1 mol/L NaOH溶液,在37 ℃搅拌反应过夜。反应混合物用蒸馏水透析48 h,得到棕褐色溶液即为制备完成Lys-AuNCs溶液。
1.3.2 Si-CDs的制备
为实验前期制备[22],合成方法如下:量取10 mLN-β-(氨乙基)-γ-氨丙基三甲氧基硅烷于100 mL三颈烧瓶中,用氮气脱气5 min后,加热至240 ℃,在剧烈搅拌下迅速加入0.5 g无水柠檬酸,保持该温度加热1 min,最终产物用石油醚洗涤3 次,得到约2 mL碳量子点。
1.3.3 比率荧光传感器的构建
将合成的Si-CDs和Lys-AuNCs溶液进行不同倍数稀释。分别取50 μL不同稀释倍数的Si-CDs和Lys-AuNCs进行不同浓度配比的混合,再加入200 μL的磷酸盐缓冲溶液(phosphate buffer saline,PBS)(0.01 mol/L,pH 6.0),于室温下充分振荡,利用两者在缓冲液中相互作用,构建I670/I470约为1∶1的Si-CDs@Lys-AuNCs比率荧光探针。
1.3.4 标准曲线的建立
先配制质量浓度为0、0.002、0.004、0.008、0.010、0.012、0.016 mg/L的Hg2+溶液,取100 μL不同质量浓度Hg2+溶液、100 μL Si-CDs@Lys-AuNCs混合液与200 μL PBS(0.01 mol/L,pH 6.0)混合,室温下静置4 min后进行荧光光谱测试。在370 nm激发波长下,设定光源激发狭缝宽与发射狭缝宽分别为9、15 nm,扫描400~750 nm波长范围内荧光强度变化。通过计算双峰荧光强度比值与Hg2+浓度变化关系,并建立标准曲线。
1.3.5 比率荧光传感器的选择性
为考察其他金属离子如Mn2+、K+、Ca2+、Mg2+、Zn2+、Fe2+、Fe3+、Co2+、Cu2+、Ni2+、Pb2+、Ba2+、Na+对比率荧光传感器是否有干扰作用,首先,配制浓度为100 nmol/L的上述金属离子盐溶液及50 nmol/L的Hg2+溶液,再分别取100 μL不同金属离子溶液、100 μL Si-CDs@Lys-AuNCs混合液与200 μL PBS(0.01 mol/L,pH 6.0)混合,室温下充分振荡,同时设置空白对照组,进行荧光光谱分析。通过计算双峰荧光强度比值与不同金属离子的变化关系,判断比率荧光传感器对Hg2+的选择性情况。
1.3.6 实际样品分析
将华南农业大学鄱阳湖湖水、屈臣氏矿泉水以及实验室自来水用0.2 μm微孔滤膜过滤后用所建立的荧光传感器进行测定。并向每个水样中分别添加0.000 8、0.002、0.012 mg/L三个水平的Hg2+,用0.2 μm微孔滤膜过滤后用所建立的荧光传感器进行测定。
1.4 数据处理
每组数据均重复3 次,采用Excel 2016软件进行数据统计分析,使用Origin 2017软件绘制结果图。
2 结果与分析
2.1 Lys-AuNCs与Si-CDs的表征
如图2A插图所示,合成的Lys-AuNCs为深棕色溶液,在365 nm紫外灯照射下发射强烈红色荧光。Lys-AuNCs分别在370 nm与500 nm左右具有两个最佳激发峰,并且在650 nm处有一个被认为由自由电子的带内跃迁所引发的近红外发射峰[23],这些特点均与报道的Lys-AuNCs的荧光光谱相符[21]。透射电镜图(图2B)显示,Lys-AuNCs在水中分散性较好,平均粒径约2.0 nm。Si-CDs的水溶液为无色透明溶液,在365 nm紫外等照射发蓝色荧光。Si-CDs的最佳激发波长在370 nm左右,在此激发波长下,470 nm处有1 个发射峰(图3A)。透射电镜图显示平均粒径在2.2 nm左右,与文献[22]报道相符。

图2 Lys-AuNCs的荧光激发与发射光谱图(A)以及透射电镜图(B)Fig.2 Fluorescence excitation and emission spectra (A) and TEM image of Lys-AuNCs (B)

图3 Si-CDs的荧光激发与发射光谱图(A)及透射电镜图(B)Fig.3 Fluorescence excitation and emission spectra (A) and TEM image of Si-CDs (B)
2.2 比率荧光传感器可行性验证
由2.1节可知,Si-CDs与Lys-AuNCs均在370 nm左右有最佳激发波长,这是构建单一激发双发射比率荧光探针的必要条件。将Si-CDs与Lys-AuNCs混合构建荧光探针Si-CDs@Lys-AuNCs。图4A显示在370 nm激发下,荧光探针Si-CDs@Lys-AuNCs分别在470 nm与670 nm处具有两个分离度很好的荧光发射峰。对Si-CDs、Lys-AuNCs及Si-CDs@Lys-AuNCs的紫外-可见吸收光谱进行扫描测试,发现Si-CDs与Lys-AuNCs混合后,Si-CDs在353 nm的特征吸收峰没有发生红移或蓝移(图4B);与此同时,对Si-CDs与Lys-AuNCs混合后0、10、20、30、40 min后的荧光光谱进行测定,发现荧光光谱基本没有发生变化,说明Lys-AuNCs和Si-CDs之间没有发生反应或相互作用(图4C)。将荧光探针Si-CDs@Lys-AuNCs与不同质量浓度Hg2+相互作用,结果如图4D所示,隶属于Si-CDs在470 nm处的发射峰强度在不同Hg2+质量浓度下保持稳定,因此,470 nm的荧光信号可作为比率荧光传感器的参比信号;而隶属于Lys-AuNCs在670 nm的发射峰强度随着Hg2+质量浓度升高而逐渐减弱。Hg2+对金纳米簇荧光猝灭机理已有报道:Xie Jianping等[24]发现由于Hg2+与Au+之间的高亲和嗜金属效应,Hg2+可以显著猝灭牛血清蛋白稳定的金纳米簇(BSA-AuNCs)的荧光。综上可知,基于Si-CDs与Lys-AuNCs构建检测Hg2+的比率荧光传感器完全可行。


图4 Si-CDs@Lys-AuNCs的荧光光谱和紫外-可见光谱Fig.4 Fluorescence emission spectra and UV-vis absorption spectra of Si-CDs@Lys-AuNCs
2.3 比率荧光传感器的优化
为保证传感器的最佳检测性能,对传感体系所处的pH值、反应时间对Hg2+检测的影响进行探究。采样不同pH值(4.0、5.0、6.0、7.0、8.0、9.0)的PBS(0.01 mol/L)作为基底溶液进行Hg2+测定实验,分别对加入Hg2+前后体系的比率荧光信号(I670/I470)进行采集。图5A显示,当不存在Hg2+时,体系的I670/I470值比较稳定受pH值的影响较小。在加入Hg2+后,由于Hg2+对Lys-AuNCs的荧光猝灭作用,体系的I670/I470值均会减小,但是在pH值偏碱性时(pH>7.0),Hg2+由于易生产沉淀对Lys-AuNCs猝灭效果明显减弱导致I670/I470值在Hg2+加入前后的降低幅度减小,从而影响检测灵敏度。当pH值为6.0时,比率荧光信号在Hg2+加入后降低幅度最大,因此,选择pH 6.0的PBS作为该传感体系的基底缓冲液。

图5 加入Hg2+(50 nmol/L)后pH值(A)和反应时间(B)对体系比率荧光信号变化的影响Fig.5 Effect of buffer pH (A) and reaction time (B) on variation in ratiometric fluorescence signal after the addition of Hg2+ (50 nmol/L)
与此同时,为保证在最短时间对Hg2+进行准确测定,对反应时间进行优化。将Hg2+与比率荧光探针Si-CDs@Lys-AuNCs混合后,记录体系的I670/I470值随作用时间变化情况。由图5B可知,Hg2+加入后的4 min以内,体系的I670/I470值随时间延长而逐渐降低,说明Hg2+在与荧光探针反应,猝灭Lys-AuNCs;当反应时间超过4 min,体系的I670/I470值基本趋于稳定,说明反应基本完成。因此,选择4 min作为最佳反应时间。
2.4 标准曲线与检出限
在最优条件下,将不同质量浓度的Hg2+(0、0.002、0.004、0.008、0.010、0.012、0.016 mg/L)标准溶液与比率荧光探针Si-CDs@Lys-AuNCs混合,通过荧光光谱仪记录荧光发射光谱,计算I670/I470值并建立其与Hg2+质量浓度关系。图6A显示,随Hg2+质量浓度的增加,470 nm波长处Si-CDs的蓝色荧光强度(I470)不随Hg2+质量浓度的变化而变化,而670 nm波长处Lys-AuNC的红色荧光强度(I670)随Hg2+质量浓度的增加而逐渐减弱。同等条件下的基于单一荧光信号测定的传感器与比率荧光传感器比较,单一荧光信号的传感器易受外界温度、浓度、pH值、激发强度等众多难以控制因素的干扰;而比率荧光信号传感器因其自带内标,通过两峰荧光强度的比值作为因变量,可极大地削弱其他干扰因素的影响,使得对目标分析物的定量检测更加精确、更加灵敏。图6B显示,I670/I470与Hg2+质量浓度在0~0.016 mg/L范围内呈良好线性关系,其线性关系式为I670/I470= 1.35-64.18C(Hg2+),R2=0.999,计算检出限(3σ)为0.001 mg/L,σ为20 次空白测定信号的标准偏差。与已报道的Hg2+检测方法比较(表1),可以看到本研究建立的传感器具有较好的灵敏度。
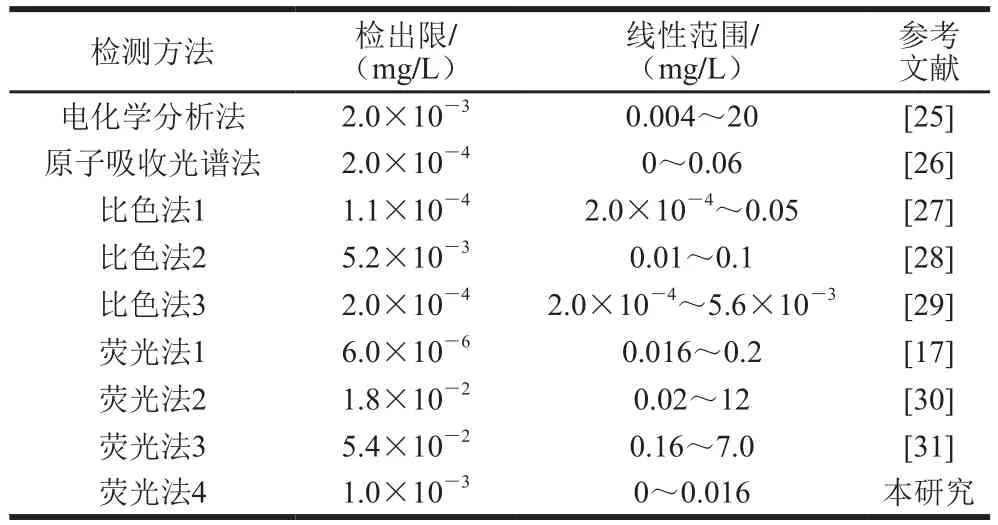
表1 不同方法对Hg2+的检测性能比较Table 1 Comparsion of figures of merit of different Hg2+ detection methods
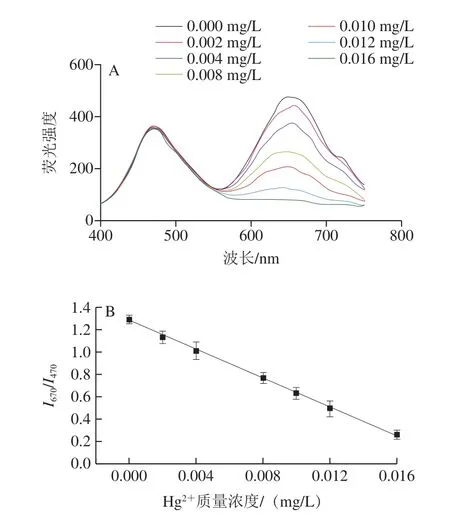
图6 比率荧光传感器对不同质量浓度Hg2+标准溶液(0~0.016 mg/L)荧光光谱的响应(A)和比率荧光信号与Hg2+质量浓度关系图(B)Fig.6 Fluorescence emission spectra of the sensor in the presence of various concentrations of Hg2+ (from 0 to 0.016 mg/L) (A) and linear plot of (I670/I470) versus Hg2+ concentration (B)
2.5 比率荧光传感器对Hg2+的选择性
探究比率荧光传感器对其他金属离子与Hg2+的响应情况,以便考察比率荧光传感器对Hg2+的选择性。如图7所示,在其他实验相同条件下,选择100 nmol/L Mn2+、K+、Ca2+、Mg2+、Zn2+、Fe3+、Fe2+、Co2+、Cu2+、Ni2+、Pb2+、Ba2+、Na+以及无金属离子的空白组与50 nmol/L Hg2+进行对比实验,发现浓度仅为50 nmol/L的Hg2+能明显猝灭670 nm波长处Lys-AuNCs的荧光峰值。浓度更高的其他金属离子(100 nmol/L)与空白组响应情况相接近,猝灭670 nm波长处的荧光能力较弱。由此可说明,其他金属离子对该传感器检测Hg2+的影响很小,即本研究所建立的比率荧光传感器对Hg2+具有较好的选择性。

图7 比率荧光传感器对不同金属离子的选择性(50 nmol/L Hg2+和100 nmol/L其他金属离子)荧光光谱图(A)及比率荧光信号响应情况(B)Fig.7 Fluorescence emission spectra of the sensor (A) and I670/I470 values observed (B) in the presence of 50 nmol/L of Hg2+ or 100 nmol/L of different other metal ions
2.6 实际样品中Hg2+的检测
为考察所建立比率荧光传感器在实际样品检测中的准确性,分别选取湖水、自来水、矿泉水为实际样品,探究该比率荧光传感器对这些样品中Hg2+的响应情况。将Hg2+标准溶液添加前后的水样经过简单处理分别用所建立的比率荧光传感器进行测定。如表2所示,该传感器在3 种实际水样中也能对Hg2+产生准确、灵敏的响应,回收率在94.3%~115.0%之间,变异系数不大于10.3%,表明本研究所建立的Hg2+比率荧光传感器可用于实际样品的检测。

表2 实际样品中Hg2+的检测结果与加标回收率(n=3)Table 2 Recoveries of Hg2+ spiked in different water samples (n = 3)
3 结 论
本研究利用对Hg2+稳定的Si-CDs和对Hg2+敏感响应的Lys-AuNCs分别作为参比荧光团与响应荧光团,构建了一种单一激发双发射的比率荧光探针实现快速、准确、灵敏地对Hg2+进行测定。在最优条件下,检测线性范围为0~0.016 mg/L,检出限为0.001 mg/L。GB 2762—2017《食品中污染物限量本标准》规定饮用水中汞限量为0.001 mg/L,因此,该感器的灵敏度满足国标限量标准的需求。在实际湖水、自来水、矿泉水3 种水样的加标回收实验,回收率范围在94.3%~115.0%之间。综上可知,本研究所建立Hg2+比率荧光传感器具有较好的检测性能与实际应用价值。

