蛋白质氧化对中华管鞭虾肌肉品质特性的影响
祁雪儿,毛俊龙,姚 慧,齐 贺,武天昕,水珊珊,张 宾*
(浙江海洋大学食品与药学学院,浙江 舟山 316022)
中华管鞭虾(Solenocera crassicornis)俗称红虾,因其外壳呈橙红色、各腹节后缘有红色横带及尾扇结尾处为红色而得名。中华管鞭虾为亚热带、热带暖水品种,在我国东海、黄海南部及南海均有分布,是浙江近海海域的优势虾类资源品种[1]。中华管鞭虾水分含量高,营养价值丰富,氨基酸、脂类、微量元素含量多,对心脏活动和心血管系统有重要的调节、保护作用,并且有降低胆固醇、舒张动脉等功效[2]。中华管鞭虾肉质红润,肥嫩鲜美,容易消化,老小皆宜,深受消费者青睐[3]。但是,在加工、流通和贮藏过程中,中华管鞭虾不可避免地受到温度、光、射线、氧、水分和催化剂等外界环境的影响,导致营养成分和品质质量降低[4]。
长期以来,脂质氧化、微生物和酶的作用被认为是导致食品腐败变质的主要原因,而近几年关于蛋白质氧化所引起的食品品质劣变也被人们关注。蛋白质氧化不仅可以降低肉的食用品质,如嫩度、多汁性、风味和色泽等,还会影响肉的功能性,如凝胶性、乳化性[5]。李银等[6]分析了羟自由基氧化体系中H2O2浓度对蛋白氧化程度及肌原纤维蛋白凝胶白度、持水力、质构特性与弹性模量等特征指标的影响。结果表明,随H2O2浓度的增加,肌原纤维蛋白中羰基值上升,蛋白氧化程度加剧,凝胶白度、保水性、硬度、咀嚼性及弹性模量则与H2O2浓度呈显著负相关。朱文慧等[7]对秘鲁鱿鱼进行氧化,同样发现在羟自由基氧化体系中,氧化剂浓度越高,氧化程度就越高,肌原纤维结构破坏越严重,保水性越低。
因此,本实验采用羟自由基氧化体系对中华管鞭虾蛋白进行氧化,通过测定其基本理化性质、蛋白性质及组织结构等,阐明蛋白质氧化对中华管鞭虾肌肉品质特性的影响规律,进一步揭示蛋白氧化对中华管鞭虾肉品质的影响机制,旨在为其在贮藏加工过程中控制蛋白氧化、提高品质特性提供理论参考。
1 材料与方法
1.1 材料与试剂
冰鲜中华管鞭虾,平均质量(13±2)g,购于浙江舟山水产交易市场,1 h内运至实验室。
氯化铁、过氧化氢、抗坏血酸、氧化镁、硼酸、甲基红-乙醇指示剂(均为分析纯) 国药化学试剂有限公司。
1.2 仪器与设备
CR-10型便携式色差仪 日本柯尼卡美能达公司;HD-3A型水分活度测定仪 常州德杜精密仪器有限公司;MS-Pro型物性测试仪 美国FTC公司;751UVGD型紫外-可见分光光度计 上海第三分析仪器厂;CF-16RN高速冷冻多用途离心机 日本日立公司;MDF-U53V型超低温冰箱 日本Sanyo公司。
1.3 方法
1.3.1 样品处理
将冰鲜中华管鞭虾去除头、壳,不去虾线,保持虾仁整体完整;将不同浓度羟自由基氧化溶液(固定0.01 mmol/L FeCl3,0.1 mmol/L抗坏血酸,共设置4 个H2O2浓度,分别为0.5、1.0、2.0 mmol/L和4.0 mmol/L)置于4 ℃冰箱中预冷后,将制备虾仁完全浸没于氧化溶液中,在4 ℃保持1、3、5 h和7 h进行氧化处理,然后用1 mmol/L乙二胺四乙酸溶液终止氧化反应;取出处理后虾仁,采用蒸馏水进行淋洗,纱布轻轻拭去表面水分,进行品质特性指标测定。同时,采用蒸馏水溶液作为空白对照处理。
1.3.2 pH值测定
按GB/T 5009.237—2016《食品pH值的测定》[8]方法进行测定。称取约2 g虾仁样品于烧杯中,高速均质30 s后,加入25 mL蒸馏水,静置30 min,过滤,PHS-3C型pH计测定滤液pH值。
1.3.3 水分活度和水分含量测定
采用水分活度仪测定水分活度。取约2 g虾仁切碎后,均匀平铺于样品盒中,将样品盒放入HD-3A型水分活度测定仪感应器中,分析虾仁肌肉中水分活度。
水分含量测定参考GB 5009.3—2016《食品中水分的测定》[9]直接干燥法。将约2 g虾仁至于101~105 ℃进行干燥处理,通过干燥前后质量变化计算虾仁中水分含量。
1.3.4 质构特性分析
采用TPA模型进行测定。选取虾仁背部第2节肌肉,测试探头为P/50,测试速率为1.0 mm/s,样品变形为30%,保持时间为3 s。采用FTC-PRO软件从每个样品产生的力-时间曲线中,计算虾仁肌肉组织弹性和咀嚼性。
1.3.5 色差测定
采用CR-10型色差仪,以虾仁肌肉第2节为测试点,测定虾仁表面的L*值和a*值。L*为正值表示偏白,a*为正值表示偏红。
1.3.6 挥发性盐基氮(total volatile basic nitrogen,TVB-N)值测定
参考GB 5009.228—2016《食品中挥发性盐基氮的测定》[10]方法进行。
1.3.7 扫描电镜观察分析
参考崔宏博等[11]方法。选取虾仁背部第2节肌肉,将样品切成5 mm×5 mm×5 mm块状,置于2.5%戊二醛溶液中,4 ℃固定过夜后,浸泡于0.1 mol/L磷酸盐缓冲液(pH 7.2)中30 min;依次用30%、50%、70%、80%、90%和100%乙醇溶液进行梯度脱水后,再用叔丁醇置换脱水30 min;将脱水后样品进行冷冻干燥,离子溅射仪喷金后,用扫描电镜观察肌肉组织结构。
1.3.8 苏木精-伊红染色观察分析
参考荣建华等[12]方法,采用苏木精-伊红染色观察虾仁肌肉组织。选取虾仁背部第2节肌肉,取1 cm×1 cm×0.5 cm肌肉块,浸泡于4%多聚甲醛固定液中,室温下过夜固定,然后用苏木精-伊红进行染色,显微镜观察虾仁肌肉组织结构。
1.3.9 肌原纤维蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
参照Laemmli[13]的不连续电泳方法,选用分离胶10%,浓缩胶5%,电极缓冲液含0.05 mol/L Tris、0.384 mol/L甘氨酸、0.1% SDS(pH 8.3)。电泳采用1 mm凝胶板;上样量为12 μL;开始电泳时电压为80 V,待样品进入分离胶后改为120 V;电泳结束后,取出胶片用考马斯亮蓝染色30 min,再用固定液固定30 min,然后用甲醇-冰醋酸脱色液脱至透明。电泳胶片置于天能凝胶成像仪摄像,结合Tanon软件进行分析和处理。
1.4 数据分析
采用Origin 8.5、SPSS 13.0软件进行作图及数据分析,结果表示为±s(采用SNK法分析差异显著性,P<0.05,差异显著)。
2 结果与分析
2.1 羟自由基氧化对中华管鞭虾肌肉pH值的影响
肌肉pH值是水产品鲜度的重要评价指标[14]。如图1所示,随着体系中H2O2浓度和氧化处理时间的不断延长,处理后虾仁肌肉组织pH值不断升高,并且氧化组的pH值明显高于蒸馏水组(P<0.05)。在4.0 mmol/L H2O2浓度下,1 h氧化时间的pH值最低为7.01,3~5 h氧化时间的pH值分别为7.22和7.25,7 h氧化时间的pH值最高,为7.37,未高于2.0 mmol/L H2O2浓度组可能是因为样品存在一定差异。氧化时间不变(7 h)时,随着H2O2浓度的增加,pH值整体呈上升趋势。可能的原因是虾仁中蛋白质和非蛋白质的含氮物质在羟自由基体系下发生氧化分解,产生氨与胺类等大量碱性物质,虾仁进入腐败阶段,积累大量的氨与胺类化合物,进而导致pH值逐渐上升[15]。

图1 羟自由基氧化对中华管鞭虾肌肉pH值的影响Fig.1 Effect of hydroxyl radical oxidation on pH of S.crassicornis muscle
2.2 羟自由基氧化对中华管鞭虾肌肉水分含量和水分活度的影响
由图2A可知,在相同的氧化时间下,水分含量随着H2O2浓度的增加而减少。在4.0 mmol/L H2O2浓度下,氧化过程中,水分质量分数从80.64%上升至85.29%,在5 h达到最大值。这可能是因为氧化导致肌原纤维横向收缩,肌细胞径向减小、肌细胞间隙加大,浓度差使较多的水分向肌肉内部扩散,肌肉吸水能力增强,导致水分在肌肉组织内的扩散通道增加[16-17]。氧化7 h,水分质量分数又降至83.05%,其原因可能是由于细胞膜的蛋白质氧化后严重变性,对其产生了轻微的破坏作用,内部水分在渗透压的作用下流出,导致水分含量降低[18]。

图2 羟自由基氧化对中华管鞭虾肌肉水分含量(A)和水分活度(B)的影响Fig.2 Effect of hydroxyl radical oxidation on water content (A) and water activity (B) in S.crassicornis muscle
水分活度不仅可表征食品中水分被微生物所利用的程度,也可反映食品品质特性[19-20]。由图2B可知,氧化组的水分活度显著低于蒸馏水组(P<0.05)。在相同的氧化时间下,水分活度基本上是随着H2O2浓度的增加而降低,且各测定点间变化差异显著(P<0.05),表明H2O2浓度对蛋白质的氧化程度有较大影响。在相同的氧化浓度下,氧化时间在0~3 h内,水分活度呈增加趋势,氧化时间在3~7 h时,水分活度呈现先增加后降低趋势。氧化期间,虾仁水分活度出现波动,可能是由于肌肉组织中的水分含量增加,在氢键作用下,虾仁中的水分与其他成分的结合程度上升,导致水分活度发生变化。随后水分活度持续快速下降,则可能是因为虾仁中水分含量降低所致[21]。由上可推测,随着氧化程度的增加,虾仁中的水分含量和水分活度会逐渐降低,导致其感官性状和口感变差。
2.3 羟自由基氧化对中华管鞭虾肌肉质构特性的影响
不同程度的氧化会造成蛋白质变性和肌纤维损伤,致使肌肉组织口感变差、弹性和咀嚼性等下降[22]。羟自由基氧化体系处理对中华管鞭虾肌肉质构特性的影响如图3A所示。总体来看,弹性和咀嚼性均因氧化程度的增加而降低。其中肌肉弹性与肌肉间的结合力大小密切相关,肌肉间结合力越大,肌肉组织破坏程度越小、弹性越大[23]。随着氧化时间的延长和氧化剂浓度的增加,经羟自由基氧化系统氧化和未经氧化虾仁的弹性均呈下降趋势,且经氧化处理的虾仁弹性下降速度较快,同一时间不同浓度间变化差异显著(P<0.05)。低浓度(0.5 mmol/L)氧化初期的弹性值为0.66 mm,氧化7 h后,弹性值显著降低至0.43 mm。高浓度(4.0 mmol/L)氧化初期的弹性值为0.64 mm,氧化7 h后,弹性值降为0.33 mm,与蒸馏水组(0.43 mm)相比降低了23.26%。这可能是氧化处理使肌球蛋白和肌动蛋白发生一定程度的变性,时间延长后,虾仁明显变软,肌纤维破裂,组织结构遭到严重破坏,肌肉发生自溶,同时部分肌肉内源酶活性的作用使肌球蛋白和肌动蛋白等的分解程度增大,肌肉间细胞结合力降低,导致弹性降低[24]。
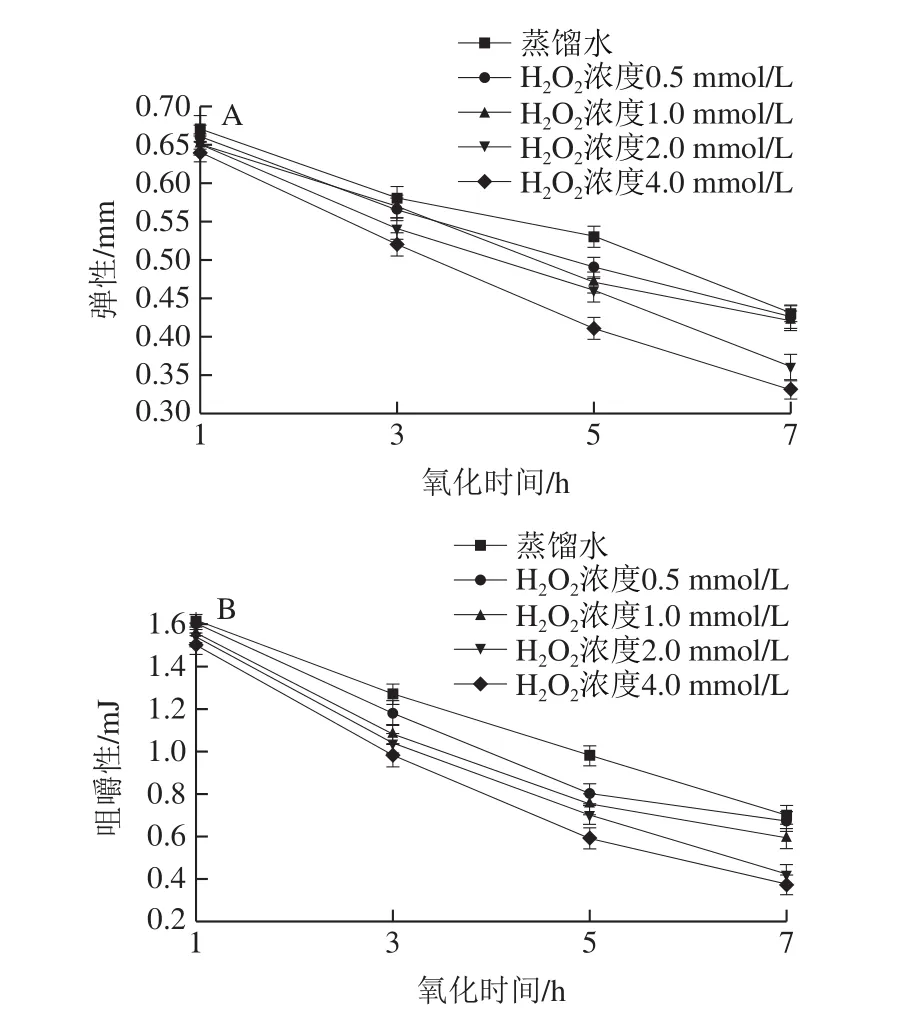
图3 羟自由基氧化对中华管鞭虾肌肉弹性(A)和咀嚼性(B)的影响Fig.3 Effect of hydroxyl radical oxidation on muscle elasticity (A) and chewiness (B) of S.crassicornis
咀嚼性也是一项质地综合评价参数,它是肌肉硬度降低、肌肉细胞间凝聚力降低、肌肉弹性减小等综合作用的结果,其数值越高,则反映的口感越好[14,25]。不同H2O2浓度的氧化溶液体系对虾仁咀嚼性的影响如图3B所示。结果显示,随着H2O2浓度和氧化时间的增加,虾仁的咀嚼性均呈现下降趋势,且氧化组虾仁的咀嚼性均低于蒸馏水组,差异显著(P<0.05)。低浓度(0.5 mmol/L)氧化初期的咀嚼性值为1.60 mJ,氧化7 h后,咀嚼性值显著降低至0.67 mJ(P<0.05)。高浓度(4.0 mmol/L)氧化初期的弹性值为1.50 mJ,氧化7 h后,咀嚼性值为0.37 mJ,与蒸馏水组(0.70 mJ)相比降低了47.14%。这可能是因为氧化作用导致蛋白质变性、发生降解,肌肉细胞间结合力减小,进而使得虾仁组织结构崩解、汁液流失及口感降低[26]。
2.4 羟自由基氧化对中华管鞭虾肌肉色差值的影响
色差值是评价鱼类等水产品品质的重要指标,可以通过利用色差计测定样品颜色的偏差值,对其新鲜度进行评价[27-28]。本实验选择测定中华管鞭虾的L*值,即明暗程度。如图4A所示,在相同的氧化时间下,中华管鞭虾的L*值随着H2O2浓度的升高而呈上升趋势,氧化时间1 h时,蒸馏水组的L*值最低,为37.21,4.0 mmol/L H2O2浓度的L*值最高,为38.05。另外,在相同H2O2浓度下,L*值随着氧化时间的延长也呈上升趋势,在4.0 mmol/LH2O2浓度下,经过1~7 h的氧化L*值分别为38.05、40.04、42.57、43.05。分析原因可能是长时间高浓度的氧化使肌原纤维蛋白质发生了一定程度的变性,进而增加了虾肉的汁液流失,导致一部分游离水在肌肉表面流动,增强了光的反射效果[29]。a*值反映虾仁的红绿度,如图4B所示,在相同的氧化时间下,中华管鞭虾的a*值随着H2O2浓度的升高而呈下降趋势。氧化时间1 h时,蒸馏水组的a*值高,为5.17,4.0 mmol/L H2O2浓度的a*值最低,为4.40。另外,在相同H2O2浓度下,a*值随着氧化时间的延长也呈下降趋势,在4.0 mmol/L H2O2浓度下,经过1~7 h的氧化a*值分别为4.40、2.50、2.38、1.73。各测定点间变化差异显著(P<0.05),表明虾仁颜色变化波动较大。分析原因可能与氧化产物和蛋白质的氨基酸侧链之间发生非酶褐变等的反应相关[30]。

图4 羟自由基氧化体系对中华管鞭虾L*值(A)和a*值(B)的影响Fig.4 Effect of hydroxyl radical oxidation on L* value (A) and a* value (B) of S.crassicornis muscle
2.5 羟自由基氧化对中华管鞭虾肌肉中TVB-N值影响
TVB-N是评定鱼、贝、虾类等动物性食品新鲜度的重要化学指标[31-32]。TVB-N值一般随着鲜度的下降而增加,含量越低,水产品越新鲜[33-34]。由图5可知,在氧化期间,中华管鞭虾的TVB-N值均呈上升趋势,且蒸馏水组与氧化组的TVB-N值差异显著(P<0.05)。氧化1 h后,蒸馏水组和不同氧化组的TVB-N值分别为9.85、10.06、10.25、10.30、10.55 mg/100 g;氧化7 h后,分别增加了21.32%、21.77%、26.54%、24.76%、26.06%。TVB-N值与pH值结果基本一致,分析原因可能是虾仁蛋白质易在氧化作用下发生水解,降解成为多肽片段甚至氨基酸、醛酮类等小分子碱性物质[35]。由此可见,蛋白质过度氧化会使TVB-N值上升,导致虾仁的新鲜度下降。

图5 羟自由基氧化体系对中华管鞭虾TVB-N值的影响Fig.5 Effect of hydroxyl radical oxidation on TVB-N content of S.crassicornis
2.6 HE染色观察氧化虾仁肌肉组织结构的变化
新鲜虾仁肌肉组织结构整体比较完整,肌纤维排列紧致、规整,肌丝均匀密集,组织结构间仅出现少量较小空隙(图6A)。不同浓度H2O2处理组的虾肉经过氧化后呈现出不同程度的劣变,低浓度0.5 mmol/L和1.0 mmol/L H2O2氧化时肌纤维的变化主要表现胞间距增大,肌丝变细,甚至出现变形断裂的现象(图6B、C),这可能是氧化增加了肌原纤维蛋白间的疏水作用和共价作用,导致肌丝间接触增强[36]。随着氧化浓度的增加,2.0 mmol/L和4.0 mmol/L H2O2组肌纤维排列混乱,肌原纤维蛋白细胞间距逐渐增大,结构趋于松散,肌丝变细程度加深、断裂严重,卷曲明显(图6D、E),这可能是由于虾仁在羟自由基氧化条件下,肌内膜分裂,肌肉组织的完整性被损坏,细胞汁液流失严重,导致肌肉微观结构遭到严重破坏。这与前面水分含量结果相符,纤维间隙变大并产生小片化,破坏了肌肉组织的网状结构,从而使大量储存于肌肉组织间隙的自由水难以被束缚而被排出,最终导致虾仁水分含量下降,肌肉失去了新鲜虾肉具有的微观结构[37]。

图6 HE染色观察氧化虾仁肌肉组织结构的变化Fig.6 Histological examination of oxidized shrimps after HE staining
2.7 扫描电镜观察氧化虾仁肌肉组织结构的变化
如图7A所示,新鲜虾仁组织微观结构,横切面稍有凸起,肌纤维直挺、排列整齐,肌内膜和肌束膜结构较完整。氧化7 h后(图7B~E),随着氧化浓度的增加,其组织结构破坏的程度也增加,结缔组织排列顺序被打乱;当浓度最大时,组织与组织之间存在大量较大的空隙,且绝大多数组织发生断裂。可能是由于肌肉蛋白发生了一定程度的氧化变性,使得原来存在于肌原纤维蛋白内部的水分溢出,和部分肌浆蛋白填充于间隙中。在氧化过程中,肌肉的肌节可能会发生聚合或收缩,从而加速间隙增大,同时在体内蛋白酶的作用下,结缔组织的不断降解,导致肌纤维与肌内膜发生了脱离,使间隙增大[38]。可见,中华管鞭虾在羟自由基的氧化条件下,肌肉组织结构会受到不同程度的破坏,导致肌肉质地软化和品质下降。

图7 扫描电镜观察氧化虾仁肌肉组织结构变化Fig.7 SEM micrographs of microstructure of oxidized shrimps
2.8 SDS-PAGE分析
SDS-PAGE能够显示肌原纤维蛋白在不同浓度H2O2氧化后不同分子质量蛋白的交联和降解情况[39-40]。在不同H2O2浓度的溶液体系下氧化7 h,中华管鞭虾肌原纤维蛋白SDS-PAGE如图8所示。可以看出,随着H2O2浓度的增加,180 kDa左右的蛋白条带浓度增大。通过对比条带颜色可以发现过氧化组的蛋白质聚集情况均高于新鲜虾仁,说明中华管鞭虾在氧化过程中,蛋白质发生交联和聚集形成了分子质量较大的蛋白质聚合体。这可能是因为,在氧化条件下,蛋白分子共价发生交联或是一些亚基片断的重新连接,导致蛋白结构发生较大改变,产生了分子质量较大的聚集体。这与李艳青等[41]对鲤鱼肌原纤维蛋白进行氧化所得的研究结果基本一致。同时,随着氧化浓度的继续增大,蛋白质遭到进一步破坏,发生降解。其中H2O2浓度越高,蛋白条带的变化越大。35~25 kDa之间2 条浓度较小的条带随着氧化浓度的增加发生降解,条带几乎消失。可能是经过氧化后,使肌纤维发生收缩或断裂,引发肌原纤维蛋白变性、肌细胞组织结构破裂,诱使肌原纤维蛋白质中主要蛋白发生降解,从而电泳条带变淡[42]。电泳分析结果表明,中华管鞭虾在氧化过程中,蛋白质会发生不同程度的聚集和降解,不同氧化浓度之间存在差异,且氧化浓度越高,蛋白质的降解速度越快,肌蛋白含量越低。

图8 SDS-PAGE图谱Fig.8 SDS-PAGE patterns of fresh and oxidized shrimps
3 结 论
在羟自由基氧化体系中,不同H2O2浓度条件氧化下,随着时间的延长,中华管鞭虾品质特性发生显著变化。即随着氧化程度的增加,中华管鞭虾的表现为肌肉pH值不断升高,水分活度和水分含量呈先上升后下降趋势,咀嚼性、弹性和a*值不断降低;L*值和TVB-N值呈不断上升趋势。观察其微观结构发现,氧化后的虾仁纤维组织之间的空隙扩大,甚至发生断裂,肌纤维排列也变得松散。不同浓度氧化剂处理后,高分子质量蛋白发生交联形成聚集体,同时,一些低分子质量蛋白条带发生降解。由此可以得出,自由基氧化可显著影响中华管鞭虾品质特性以及肌肉蛋白质的降解程度。

