装载α-生育酚的乳木果油固体脂质纳米颗粒的制备与表征
杨 振,李 曼,慕鸿雁,熊 柳,孙庆杰*
(青岛农业大学食品科学与工程学院,山东 青岛 266000)
在过去的20 a不同类型的脂质纳米颗粒逐渐成为研究热点,包括固体脂质纳米颗粒(solid lipid nanoparticle,SLN)、纳米结构脂质载体、脂质药物结合物、脂质纳米胶囊[1]。重要的是,SLN已被引入脂溶性活性物质的载体,并发展作为乳液、脂质体和聚合物纳米颗粒的替代载体[2]。SLN的粒径范围通常为50~1 000 nm。SLN是由乳化剂稳定的固体脂质组成的纳米颗粒[3]。与其他的载体相比,SLN展示了靶向药物递送[4]、药物的控释和缓释[5]、增强药物的稳定性[6]和改善药物溶解度的潜力[7]。与以前的油基乳液相比,SLN的脂质状态在室温条件下呈现固态[8],SLN的脂质成分可以是高纯化的脂肪酸、甘油三酸酯或脂肪酸和甘油三酸酯的混合物[9]。前期研究表明,SLN通常用于包埋生物活性物质[10]。在SLN中生物活性物质的包封有利于保护生物活性物质免受由外部因素(如热、酸和氧)引起的降解损失[11]。此外,SLN的制备是基于通过高剪切均质或超声处理得到的固化纳米乳液技术,因此,通常认为SLN安全[12]。而且,SLN比脂质体具有更高的稳定性,并且能够与亲脂性的药物相结合。另外,SLN的制备能够进行大规模生产[13]。
目前制备SLN的方法较多,如溶剂乳化或蒸发、超声或高速均质以及乳液的超临界萃取,其中最重要的是高速均质化的制备方法。用于制备SLN的脂质包括蜡、类固醇、甘油单酸酯、甘油二酸酯、甘油三酸酯和脂肪酸。Hashem等[14]使用硬脂酸和甘油单硬脂酸酯复合作为脂质基质成功制备用于装载脂溶性药物的SLN。Botto等[15]利用双硬脂酸甘油酯(Precirol ATO 5)作为脂质基质制备了用作基因治疗的非病毒载体的SLN。Baek等[16]使用硬脂酸制备了用于装载汉黄芩素的SLN。而且,研究报道了2 种或多种不同种类的脂质组分已用于制备SLN。Dantas等[17]利用硬脂酸与蜡质作为脂质成分制备了SLN。另外,Xie Shuyu等[18]利用3 种脂肪酸(棕榈酸、十四酸和硬脂酸)作为一种脂质基质成功制备了用于包埋活性物质的SLN。总之,当前大多数研究通过使用一种或多种脂质成分制备SLN。然而,这些脂质通常用于非食品领域中,并且具备不可食用的缺点。植物油脂由于其固有的生物降解性和低毒性通常认为是绿色安全的。但是植物油脂在室温下呈液态,因此很难用于制备SLN。鉴于先前研究中制备的SLN并非食品级,所以利用植物油制备SLN在食品领域非常重要。
从酪酯树的种子中提取的乳木果油被广泛用于西非和中非的食品、化妆品以及制药业中[19]。乳木果油是纯天然的绿色植物脂肪固体资源,由于乳木果油组分中存在酚类化合物,使其具有促进表皮细胞再生、抗氧化和抗炎症的功效[20-21]。由于乳木果油在室温条件下表现出固态相性质,所以在本研究中使用乳木果油作为固体脂质基质原料开发食品级SLN。
本研究以乳木果油为原料,通过采用高速剪切均质的方法制备不同油水比例的SLN。本实验中该制备方法的优点是过程简单、制备时间短(均质时间)以及基于较少的时间和材料具备大规模生产制备的潜力。该方法不同于在其他研究中报道的复杂制备方法[22-23]。在许多研究中SLN的制备是通过热剪切均质技术结合超声处理方法,通常需要较长的时间,包括均质时间、超声时间和缓慢冷却时间。这些新开发的食品级SLN将在食品、制药和生物医学行业中找到潜在的应用。
1 材料与方法
1.1 材料与试剂
乳木果油 上海千峰化工有限公司;α-生育酚上海贤鼎生物科技有限公司;吐温20、吐温80 德国默克试剂公司;十三酸甲酯(纯度>99%)和52混合标准品(C4~C22) 西格玛奥德里奇化学公司;其余所用试剂均为国产分析纯。
1.2 仪器与设备
8890GC气相色谱仪 美国安捷伦科技公司;D8-ADVANCE X射线衍射仪 德国布鲁克AXS有限公司;LXJ-IIB离心机 上海安亭仪器公司;DSC1差示扫描量热仪 美国梅特勒-托利多公司;FJ-200高速均质机绍兴上虞艾科仪器设备有限公司;ZSP动态光散射仪马尔文仪器有限公司;7650透射电子显微镜 日本日立公司;TU-1810紫外分光光度计 北京普析通用仪器有限公司。
1.3 方法
1.3.1 乳木果油的气相色谱分析
甲基化步骤:采用两步甲基化方法,并进行修改[24]。首先,将乳木果油加热至40 ℃融化,之后将3 滴样品加入15 mL试管中,然后在40 ℃恒温条件下保持静置。向试管中添加4 mL的异辛烷,将其充分摇匀,然后静置2 min。之后将0.2 mL含有氢氧化钾的甲醇溶液加入上述混合物中,混匀保持静置2 min。从试管中取出1 mL上清液用于测定。
气相色谱条件:色谱柱:聚二氰丙基硅氧烷强极性固定相(100 m×0.25 mm,0.2 µm);程序升温:初始温度150 ℃,保持1 min,以1.5 ℃/min升温至220 ℃,之后保持1 min;检测器温度250 ℃;以氢作为燃料气体,流速100 mL/min;氮气用作载气,流速15 mL/min;尾气流速15 mL/min。脂肪酸测定分析基于制造商提供的等效链长值以及不同标准品所获得保留时间。通过高纯度标准品分离出不同脂肪酸。
1.3.2 X射线衍射
乳木果油的结晶结构通过X射线衍射仪测定。扫描速率1°/min,扫描范围0°~60°。乳木果油的相对结晶度是通过在衍射图上绘制峰的基线并通过使用JADE 5.0计算面积确定。相对结晶度按式(1)计算[25]:
式中:A1为X衍射曲线特征峰面积;A2为X衍射曲线上峰的总面积。
1.3.3 SLN的制备
乳木果油SLN通过高速热均质的方法制备[26]。乳木果油在高于其熔点温度(36.20 ℃)的60 ℃条件下融化。在相同温度下,吐温80或吐温20加入去离子水中溶解作为水相。然后,将水相加入脂相中,使用高速均质机以10 000 r/min均质3 min形成O/W的乳液。将获得的SLN在4 ℃进行固化贮存。另外,α-生育酚添加到脂质相中,包埋α-生育酚的SLN通过相同制备过程得到。制备不同SLN方案如表1所示。
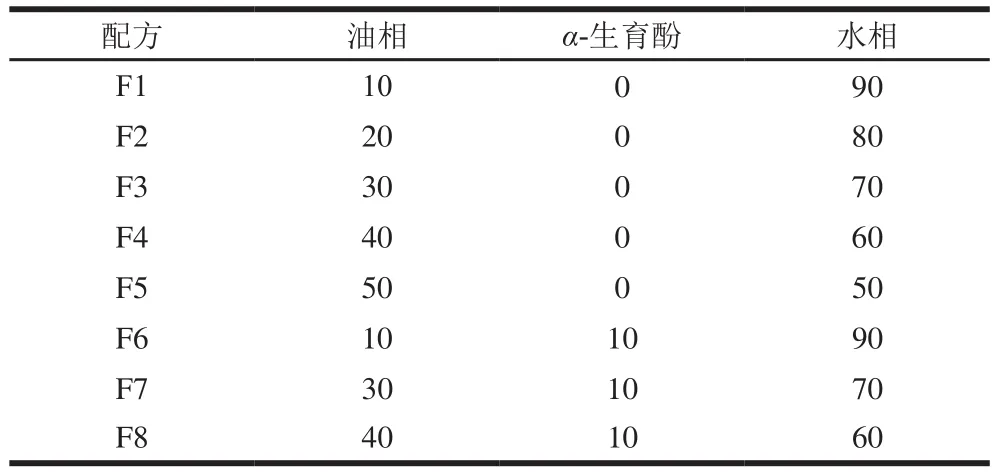
表1 SLN和包埋α-生育酚SLN的制备配方Table 1 Formulations of SLNs and α-tocopherol-loaded SLNs%
1.3.4 颗粒粒径的测定
参照吴红艳等[27]的方法,使用动态光散射仪测定分析乳木果油SLN的平均颗粒粒径、聚合物分散指数(polymer dispersity index,PDI)和粒径分布。使用去离子水将SLN悬浮液稀释20 倍,以避免多重散射效应影响测定结果。在室温25 ℃条件下进行测定分析。
1.3.5 透射电子显微镜
参照Ge Shengju等[28]的方法,使用超纯水将制备得到的SLN悬浮液稀释20 倍,之后取一滴稀释后的SLN悬浮液沉积在300 目的碳涂层铜网上。滤纸除去多余的液体,然后通过真空冻干以获得样品。透射电镜的加速度电压为80 kV。
1.3.6 差示量热扫描仪测定
参照冯艳等[29]的方法,使用差示量热扫描仪测定乳木果油的融化参数(如融化温度和融化焓值)。差示量热扫描仪在30 mL/min的氮气下运行,并使用空的小铝锅作为空白对照。差示量热扫描的校准方法是通过手动校准,包括基线优化、熔炉的校准、样品温度的校正、自动扫描和热流校准[29]。乳木果油和固化后的SLN悬浮液加入到铝锅中,然后密封。扫描的温度范围和速率分别为0~100 ℃和10 ℃/min。通过软件STARe分析记录差示量热扫描图中的起始温度(To)、峰值温度(Tp)和终值温度(Tc)。SLN的融化焓值(ΔH)是通过峰下基线与热谱图之间的面积积分进行计算,单位为J/g。
1.3.7 包封率和载药量的测定
参照Ali等[30]的方法,测定α-生育酚在乳木果油的SLN中的包埋率和载药量。将3 gα-生育酚添加到30 g融化的液态脂质中,接着按照上述制备步骤形成SLN后将SLN悬浮液离心(3 500×g,10 min),离心后收集上清液,并取1 mL稀释10 倍进行分析。分光光度计的波长设置为285 nm。按式(2)、(3)计算α-生育酚的包埋率和载药量[30]:

式中:C1为总α-生育酚质量/g;C2为未包埋的α-生育酚质量/g;M1为α-生育酚包埋量/g;M2为SLN中的α-生育酚质量/g。
1.4 数据处理
2 结果与分析
2.1 乳木果油的脂肪酸组成
如表2所示,乳木果油是由多不饱和脂肪酸、单不饱和脂肪酸和饱和脂肪酸组成。乳木果油中的饱和脂肪酸主要由棕榈酸(C16:0)、硬脂酸(C18:0)和花生酸(C20:0)组成。其中,硬脂酸的含量占全部脂肪酸的40.61%。不饱和脂肪酸主要由高含量的油酸(C18:1,45.47%)和少量的亚油酸(C18:2,7.33%)组成。乳木果油中高浓度的硬脂酸赋予乳木果油在室温呈现固态的物理特性,这有利于SLN的制备。而且,各种脂肪酸的存在有利于SLN中疏水活性成分的装载。实验结果与相关研究报道一致[31],硬脂酸和油酸是主要的组成成分。
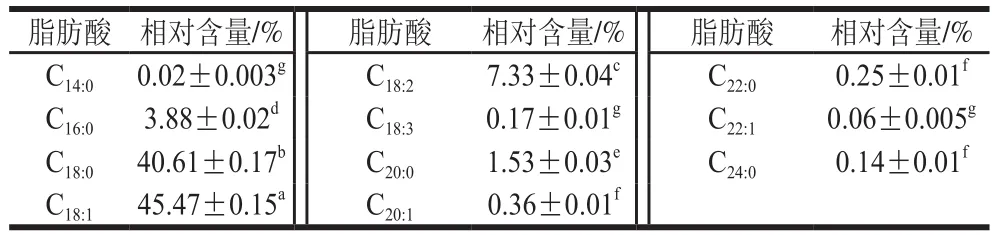
表2 气相色谱测定的乳木果油脂肪酸组成Table 2 Fatty acid composition of shea butter measured by gas chromatography
如图1所示,乳木果油的X射线衍射图谱表现出主要的衍射峰和结晶相,符合不同脂肪酸的特征。其中,在2θ为21°处的衍射峰属于硬脂酸[32]。此外,乳木果油的X射线衍射图谱有较短的晶间距(4.2 Å和3.8 Å),这种β’多态性的特征表明脂质中存在大量的棕榈酸[32]。乳木果油图谱中存在的宽峰范围(12°~22°)是因多种脂肪酸结合导致,这也与脂肪酸的组成测定结果一致(表2)。乳木果油含有多种脂肪酸,具备稳定的结晶多态性形态。而且,SLN的X射线衍射图谱在21°处出现强峰,这可能是由于SLN存在硬脂酸的原因。图谱中在23.7°处弱峰的存在是因为在SLN表面有吐温系列的乳化剂[33]。
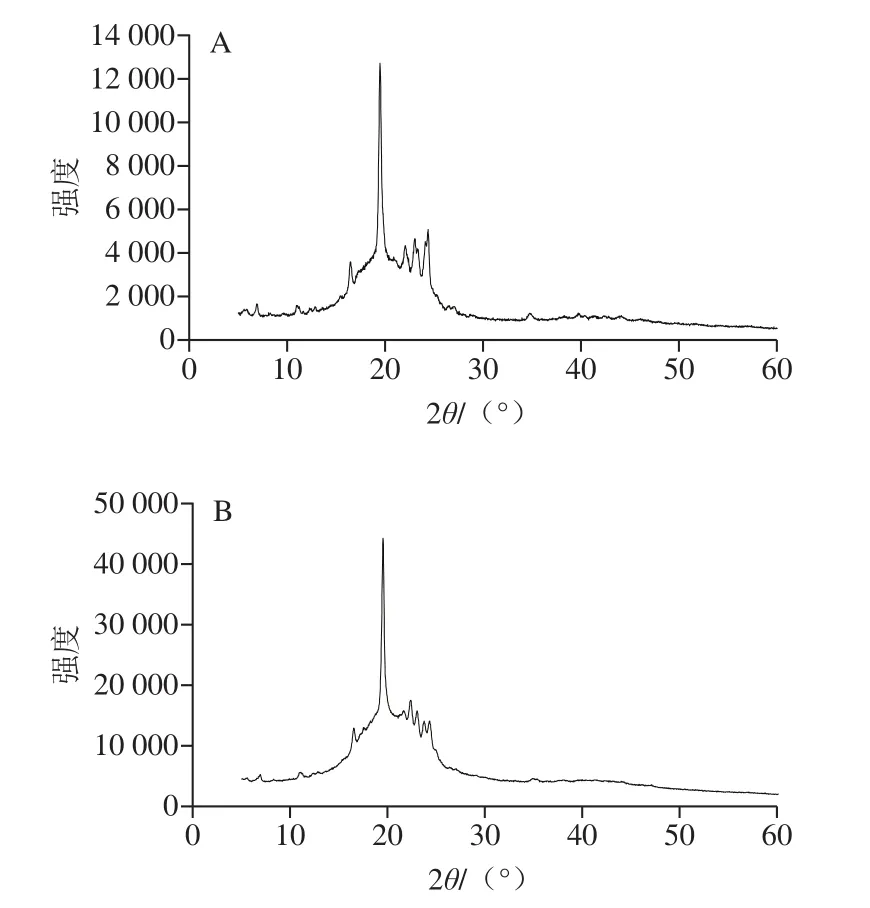
图1 乳木果油(A)和SLN(B)的X衍射图Fig.1 X-ray diffraction patterns of shea butter (A) and SLNs (B)
如图2所示,乳木果油在36.20 ℃出现吸热峰。差示量热扫描仪的吸热峰表示乳木果油结晶的熔化。与硬脂酸(69 ℃)和棕榈酸(63 ℃)等固体脂肪酸相比,乳木果油的熔融温度更低[33]。乳木果油的熔点与结晶度一致(图1),而且乳木果油的低融化温度是由于组分中含有多种脂肪酸的混合物(表2)。

图2 乳木果油的差示扫描量热图Fig.2 Differential scanning calorimetric thermogram of shea butter
2.2 SLN的粒径与形貌
根据不同的油水比(1∶9~1∶1),选择吐温80或吐温20作为乳化剂,制备5 种O/W的乳液。将得到的脂质纳米颗粒乳液在4 ℃固化以获得SLN悬浮液。因为每种乳液都包含不同量的固体脂质,所以从液滴形成SLN所需的固化时间也不同。长期的低温固化过程将使颗粒趋于聚集并且粒径略有增大。乳化剂的负电荷能够抑制颗粒的聚集。F1、F2、F3、F4和F5所需的最佳固化时间分别为240、60、30、30 min和40 min。固化时间的选择取决于在相同的颗粒制备过程中不同固化时间获得的最小SLN粒径。如图3所示,F1中乳液固化后,SLN悬浮液的粒度分布大于乳液的液滴分布。相反,具有更高脂质含量的F2和F3呈现出相反的趋势。随着乳木果油含量的不断增加,乳液的液滴分布与F4和F5中SLN悬浮液的粒径分布趋于一致。

图3 固化前乳液的液滴分布和固化后悬浮液的颗粒分布Fig.3 Droplet size distribution of emulsions before curing and particle size distribution of suspensions after solidification
从表3可以看出,SLN的平均粒径随乳木果油的含量增加而逐渐减小。其中,F5中的SLN具有最小的粒径(30.43 nm),而F1中的SLN具有最大的粒径(278.17 nm)。选择合适的乳化剂会影响所形成的SLN粒径大小。吐温80的亲水亲油平衡值(hydrophile lipophile balance,HLB)为15.0,这低于吐温20的HLB(16.7)。更低的HLB代表乳化剂有更强的油脂亲和力。因此,吐温80被加入到油相含量更高的乳液中[34-35]。所有制备得到的SLN都显示出相似的PDI,这表明SLN的分散性良好。而且,SLN的Zeta电位显示为负值,SLN的负Zeta电位有助于防止纳米颗粒的聚集,从而通过静电排斥增强了分散液的稳定性。相对低的PDI也表明了这一点。F7中的SLN粒径小于F3配方的颗粒粒径,主要是由于脂溶性活性物质α-生育酚装载在SLN中,其可能与SLN中的脂质发生协同效应,这会进一步降低颗粒的粒径和提高颗粒的稳定性[36]。另外,本研究中所制备的乳木果油SLN粒径小于之前研究报道的SLN粒径[22-23]。在Ali等[22]的研究中,SLN的粒径范围为141~152 nm。Hassan等[23]所制备的SLN粒径范围为84~1 624 nm。本研究中SLN的粒径范围为30.43~278.17 nm,可以通过调整制备条件获得不同粒径的SLN。

表3 SLNs和包埋α-生育酚SLNs的粒径、PDI和Zeta电位Table 3 Particle sizes, PDI, and zeta potentials of SLNs and α-tocopherol-loaded SLNs
为了更清晰地了解SLN的形貌,使用透射电子显微镜分析乳木果油SLN的形态。如图4所示,SLN近似球形并且形状均匀。SLN的形状与Penumarthi等[37]的研究中使用胆甾醇油酸酯、甘油三油酸酯和其他脂质制备的SLN一致。SLN的粒径随油相比重的增加而不断减小(表3)。高含量的油相在油水界面与乳化剂相互作用,能够稳定更多的界面面积,从而降低界面张力和乳液液滴的粒径[38]。另外,透射电子显微镜还显示出SLN具有良好的分散性,这与表3中SLN的PDI(0.10~0.24)一致。

图4 以不同油相比例制备的乳木果油SLNs的透射电子显微镜图Fig.4 TEM images of shea butter SLNs prepared with oil phase fractions of 0.1 (A), 0.2 (B), 0.3 (C), 0.4 (D) and 0.5 (E)
2.3 SLN的热特性
如表4所示,不同SLN的热峰值温度分别为24.43(F6)、19.05(F7)、19.23(F8)、28.96(F1)、27.08(F2)、22.5(F3)、22.42 ℃(F4)和22.75 ℃(F5),明显低于乳木果油的热峰值温度(35.84 ℃)。天然乳木果油的差示量热扫描仪结果与之前的实验报道一致[30]。而且,与乳木果油的Tc-To范围(14.0 ℃)相比,所有的SLN样品都明显降低(4.23~7.79 ℃)。此外,所有SLN的ΔH值(-0.68~-9.71 J/g)显著低于乳木果油(-36.58 J/g)。同时随着油相比例的增加,热焓值显著降低,这可能是更多脂质基质延迟了在冷却过程中的重结晶行为。从F1到F3,峰值温度趋于更低的温度,这可能是由于粒度效应引起的。相关研究表明,随着颗粒粒径的减小,熔融转变变宽并移向更低的温度[38-39]。纳米颗粒的熔融变化很大程度依赖于粒度的大小变化。颗粒的粒径减小,熔点发生降低。另外,颗粒的比表面积越大,其熔融温度峰值随之降低[40]。图5中吸热峰能够表明SLN的形成,说明在低温固化的过程中发生了相态转变和结晶结构的变化。熔点的略微下降表明脂质基质在形成SLN后无定形程度增加。

表4 乳木果油SLNs的热特性Table 4 Thermal properties of shea butter SLNs

图5 未包埋α-生育酚(F1~F5)及装载α-生育酚(F8)的乳木果油SLNs的差示量热扫描图Fig.5 Differential scanning calorimetric thermograms of shea butter SLNs without (F1, F2, F3, F4 and F5) and with α-tocopherol (F8)
2.4 包埋率和载药量结果
为了将α-生育酚完全装载到SLN中,将占比10%的α-生育酚加入到脂质相中,并按照之前步骤测量离心后上清液中的游离α-生育酚,根据方程(2)和(3)计算SLN中α-生育酚的包埋率和载药量。如表5所示,在F8中的α-生育酚的包埋率和载药量分别为95.11%和9.6%。F8的结果高于F6和F7,这表明活性物质的包埋与装载随着乳木果油占比的增加而提高。相比较于之前的研究报道[41],本实验中α-生育酚的包埋率和载药量数值更高。从表6也能够看出,相比之前不同组分的SLNs,本实验中对于活性物质的包埋率和载药量数值更高。而且,α-生育酚在SLN中的包埋率为95.11%,高于文献[40]结果。推测SLN中α-生育酚的高包埋率可能是由于SLN中的脂质相与脂溶性活性物质之间存在疏水相互作用。其中,脂质成分、固体性质以及纳米颗粒等因素都会导致SLN中的α-生育酚包埋率较高。另外,乳木果油的脂质基质具有低结晶度,使部分无定形区域包埋脂溶性的物质。在SLN中,脂溶性活性物质α-生育酚包埋在油相中,油相由固态脂质包围,对活性物质的泄露起到一定保护作用,从而提高了包埋率[36]。

表5 包埋率和载药量Table 5 Encapsulation efficiency and loading content of α-tocopherol

表6 具备不同活性成分和脂质组成的SLN包埋率和载药量Table 6 Encapsulation efficiency and loading content of different bioactive components in SLNs with different lipid compositions
3 结 论
在本研究中,第一次通过高速均质方法成功制备乳木果油SLN。油水比为5∶5的SLN粒径和PDI分别为30.43 nm和0.21。从透射电子显微镜来看,SLN的形态呈现近似球形。差示量热扫描的热特性测定显示出乳木果油SLN的形成,并且SLN的峰值温度随着粒径减小而趋向更低的温度。另外,脂溶性活性物质α-生育酚成功装载到SLN中,并且包埋率达到95.11%。这项研究将为乳木果油在食品、化妆品以及生物医学行业中的更广泛应用提供理论依据。乳木果油SLN不仅可以装载脂溶性活性物质或药物,还能够用作营养输送的有益载体。

