级联信号转导系统结合免疫层析法检测大肠埃希氏菌O157:H7
山 珊,黄艳梅,赵雪龙,陈文瑶,刘成伟,龙中儿,刘道峰,*
(1.江西师范大学生命科学学院,南昌市鄱阳湖湿地微生物资源开发与利用重点实验室,江西 南昌 330022;2.江西业力医疗器械有限公司,江西 南昌 330008;3.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;4.江西省疾病预防控制中心,江西省食源性疾病诊断溯源重点实验室,江西 南昌 330029)
统计结果显示全球每年约有6亿 人因食用受污染的食品而患病,近42万 人死亡,而食源性致病菌是造成食源性疾病的主要因素之一[1-2]。传统的微生物检测方法以培养法为基础,此类方法依赖于微生物的生长[3-5],操作过程费时耗力,难以满足现场快速检测的需要。为提高致病菌检测方法的灵敏度并节省检测时间,不依赖于微生物生长的检测方法成为近年来食源性致病菌检测研究领域的关注热点[6-8],主要包括基于分子生物学和基于免疫学的检测方法。基于分子生物学的检测方法[9-11]虽具有准确性高和检测速度快的特点,但因其需要昂贵的仪器及专业的场所,故难以应用于基层。免疫学检测技术[12-15]是基于抗原和抗体特异性结合实现对目标物直接识别的一种快速检测方法,具有检测效率高、不需要专业场所和大型仪器等特点。其中免疫层析法因人员技术要求低和检测速度快而得到广泛的应用[16-19]。
然而传统的免疫层析方法灵敏度较低,通常难以满足食源性致病菌超灵敏检测的需求,同时免疫层析方法在检测致病菌常依赖“夹心免疫层析模式”,该检测模式因存在Hook效应而易引起假阴性检测结果[20]。近年来提高免疫层析法检测灵敏度的手段包括:1)使用新型标记物,如荧光标记物[21-22]、磁性标记材料[23]和强拉曼响应标记物[24-25]等;2)使用信号放大策略,如应用生物素-链霉亲和素系统[26]、酶-底物反应系统[27]和金属增强方法[28-29]等,Cho等[27]采用生物素-链霉亲和素体系将酶标记在胶体金上,增加了酶的载量,通过酶-底物的颜色反应,增强了检测线的信号强度,与传统的免疫层析方法相比检测灵敏度提高了100 倍。上述方法在一定程度上提高了致病菌的检测灵敏度,但“夹心免疫层析模式”存在Hook效应这一共性问题并未得到解决,食源性致病菌的检测灵敏度仍有待提高。
本研究首先采用免疫磁技术浓缩大肠埃希氏菌O157:H7,而后制备同时标记了抗体和大量β-内酰胺酶的胶体金纳米探针,利用胶体金纳米探针上大量β-内酰胺酶高效水解青霉素的特点实现检测信号转导与进一步放大,再结合竞争型免疫层析法灵敏监测青霉素的含量变化,最终实现大肠埃希氏菌O157:H7的超灵敏检测。研究巧妙地将检测大分子目标菌转移成检测小分子目标物,实现超灵敏检测食源性致病菌的同时规避了双抗夹心免疫层析法中Hook效应的影响,旨在为免疫层析技术高灵敏准确检测大分子目标物提供新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
大肠埃希氏菌O157:H7(Escherichia coliO157:H7,ATCC 43888)、普通大肠埃希氏菌ATCC 25922、猪霍乱沙门氏菌(Salmonella choleraesuis,ATCC 10708)、金黄色葡萄球菌(Staphylococcus aureus,CMCC 26003)、普通变形杆菌(Proteus vulgaris,CMCC 49027)、宋内氏志贺菌(Shigella sonnei,ATCC 25931)、蜡样芽孢杆菌(Bacillus cereus,ATCC 14579)、单核细胞增生李斯特菌(Listeria monocytogenes,ATCC 13932)、铜绿假单胞菌(Pseudomonas aeruginosa,CMCC 10104)、食品基质中大肠埃希氏菌O157:H7为江西省疾病预防控制中心保存菌株。
1.1.2 试剂
奥润磁珠(PM3-020) 上海奥润微纳新材料科技有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(N-(3-dimethylaminopropyl)-N’-ethylcarbodiimide hydrochloride,EDC)、N-羟基硫代琥珀酰亚胺(N-hydroxysulfosuccinimide sodium salt,NHSS)、吗啉乙磺酸(morpholinoethanesulfonic acid,MES)、硼酸钠溶液(sodium borate solution,BS)、聚乙二醇(polyethylene glycol,PEG)-20000 阿拉丁化学试剂公司;吐温20、氯化钾(分析纯)、氯化钠(分析纯)、磷酸氢二钠(分析纯)、磷酸二氢钾(分析纯)、氢氧化钠、盐酸 天津永大化学试剂有限公司;D-氨基葡萄糖、牛血清白蛋白(bovine serum albumin,BSA) 美国Sigma公司;抗大肠埃希氏菌O157:H7多克隆抗体(E-pAb)、抗大肠埃希氏菌O157:H7单克隆抗体(E-mAb) 美国Meridian Life Science公司;LB液体培养基、脑心浸液培养基 英国Oxoid公司;山梨醇麦康凯琼脂(sorbitol maconkey agar base,SMAC)平板北京陆桥技术有限责任公司;改良EC肉汤(mEC+n)培养基 青岛高科技工业园海博生物技术有限公司;科玛嘉O157显色培养基 郑州博赛生物技术股份有限公司;青霉素标准品 上海源叶生物技术有限公司;β-内酰胺酶 上海晶纯生化科技股份有限公司;青霉素检测卡 北京辉奥生物技术有限公司。
1.2 仪器与设备
Synergy超纯水系统 德国Merker Millipore公司;BE-1200涡旋振荡器 上海医科大学仪器厂;微量移液器德国Eppendorf公司;ME204电子分析天平 美国梅特勒-托利多公司;LZDM高压蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;78HW1加热磁力搅拌器 江苏金城国盛实验仪器厂;HZ100R冷冻离心机 湖南湘仪离心机仪器有限公司;DH-II旋转混合仪 浙江宁波新芝公司;磁分离架 江西中德生物工程有限公司;JP-C300超声波清洗仪 广州市吉普超声波电子设备公司;HT-1300-U生物安全柜 苏州苏净安泰;ZWY-2102C恒温振荡培养箱 上海智城分析仪器制造有限公司;DK-320恒温水浴箱 上海精宏实验设备有限公司。
1.3 方法
1.3.1 菌株的培养
从大肠埃希氏菌生长的SMAC平板上取单菌落,在LB液体培养基中37 ℃培养12 h;副溶血性弧菌在加入了3%氯化钠的LB液体培养基中培养18 h,培养温度为37 ℃;其他细菌在LB液体培养基中37 ℃培养18 h。单核细胞增生李斯特菌在脑心浸液肉汤培养基中37 ℃培养18 h。培养完成的细菌均采用平板计数法,同一浓度设置3 个平行实验。
1.3.2 免疫磁珠的制备
使用1 mL含1%吐温20的吗啉乙磺酸缓冲液(morpholinoethanesulfonic acid with 1% tween 20,MEST,pH 5.5)对5 mg澳润磁珠进行洗涤后,磁分离弃上清液。取10 mg/mL EDC和10 mg/mL NHSS溶液(MES缓冲液配制,pH 5.5)各0.5 mL加入到清洗后的磁珠中,置于旋转混合仪15 r/min、室温条件下活化1 h,磁分离后弃上清液。将1 mL的MES缓冲液重悬活化后的磁珠,磁分离后弃上清液。加入1 mL 1 mg/mL的E-mAb,置于旋转混合仪15 r/min、室温条件下反应4 h,进行磁分离弃上清液。最后加入1 mL用BS缓冲液配制的1 mg/mL氨基葡萄糖溶液,置于旋转混合仪15 r/min、室温条件下反应1 h,磁分离弃上清液,用BST溶液(含0.5% BSA和0.02%叠氮钠)清洗3 次。最后用1 mL的BST溶液重悬磁珠,将其放置于4 ℃备用。
1.3.3 胶体金纳米探针的制备
采用柠檬酸三钠还原法制备胶体金溶液。取99 mL超纯水于干净的250 mL锥形瓶内,置于加热磁力搅拌器快速搅拌溶液,加入1 mL 0.1% HAuCl4溶液,待溶液沸腾后迅速地加入1.5 mL 1%的柠檬酸三钠溶液,继续加热搅拌,当溶液变为红色透明时,继续加热10 min后停止加热,搅拌5 min后待溶液平衡至室温,放入4 ℃保存备用。
将1 mL胶体金溶液加入一个干净的5 mL烧杯中,用0.2 mol/L的K2CO3溶液调节溶液pH 8,置于磁力搅拌器,滴加E-pAb(5、10、15、20 μg和25 μg),常温下搅拌1 h。加入50 μgβ-内酰胺酶,继续搅拌反应1 h。最后向溶液中加入100 µL 1%的PEG-20000溶液,搅拌30 min后加入100 µL 1% BSA溶液继续搅拌反应30 min,4 ℃、8 000 r/min离心30 min。用100 µL超纯水复溶胶体金复合物,存于4 ℃备用。
1.3.4 免疫磁珠和胶体金纳米探针捕获目标菌
将大肠埃希氏菌O157:H7菌液用磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L,pH 7.4)梯度稀释,平板计数。取100 μg免疫磁珠(1.3.2节),PBS清洗2 次,磁分离弃上清液,加入900 µL PBS复溶和100 µL 105CFU/mL大肠埃希氏菌O157:H7菌液,同时用PBS作空白对照组,将其置于旋转混合仪15 r/min、常温反应30 min,磁分离3 min弃上清液;用1 mL含1%吐温20磷酸盐缓冲液(phosphate buffered saline with 1% tween 20,PBST)清洗2 次,加入1 mL PBS复溶,加入一定量(0、1、3、5 µL和10 µL)的胶体金纳米探针(1.3.3节),置于旋转混合仪(15 r/min)于常温反应10 min;磁分离3 min,取出上清液进行平板计数,PBS清洗复合物(免疫磁珠-目标菌-胶体金纳米探针),最后1 mL PBS复溶。
将上清液、洗涤液和对照组进行平板计数,同时进行3 个平行实验。在37 ℃条件下,培养12~16 h,进行计数,磁珠的捕获效率按照下式计算:

1.3.5 基于级联信号转导结合免疫层析方法快速检测大肠埃希氏菌O157:H7
检测原理见图1。当大肠埃希氏菌O157:H7存在时,偶联了E-mAb的免疫磁珠与大肠埃希氏菌O157:H7结合,随后加入标记了E-pAb和β-内酰胺酶的胶体金纳米探针,此时免疫磁珠、大肠埃希氏菌O157:H7和胶体金纳米探针形成夹心复合物。将一定量的青霉素溶液与复合物混合,复合物上的β-内酰胺酶可高效水解青霉素,磁富集后得到的上清液采用商业化的免疫层析试纸条确认青霉素含量。免疫层析方法检测青霉素原理是:青霉素全抗原喷于检测线(T),抗鼠二抗喷于控制线(C),标记了抗青霉素单克隆抗体的胶体金(指示物)喷在结合垫上,当溶液中存在一定量的青霉素时,青霉素与结合垫上指示物结合,指示物无法再与检测线上青霉素全抗原结合,试纸条检测线不显色;当溶液中不存在青霉素时,结合垫上的指示物与检测线上青霉素全抗原结合,试纸条检测线显色。若待测样品中存在目标菌,青霉素被水解,检测线显色。若待测样品中不存在目标菌,则无法形成复合物,体系中不存在β-内酰胺酶,青霉素无法被水解,试纸条上检测线不显色。

图1 级联信号转导系统结合免疫层析法检测大肠埃希氏菌O157:H7的原理图Fig.1 Schematic diagram of the detection of E.coli O157:H7 by cascade signal transduction combined with immunochromatography
检测具体步骤如下:将大肠埃希氏菌O157:H7与清洗后的100 μg免疫磁珠(1.3.2节)混合,PBS作空白对照组。将其置于旋转混合仪15 r/min、常温反应30 min,磁分离3 min弃上清液;PBST清洗2 次,加入1 mL PBS复溶,加入胶体金纳米探针(1.3.3节),置于旋转混合仪15 r/min、常温反应10 min;磁分离3 min,PBS清洗复合物5 次,磁分离弃上清液;加入100 µL 50 µg/mL青霉素溶液,37 ℃放置30 min;磁分离取上清液,用青霉素检测卡检测上清液中青霉素的质量浓度。同时用ImageJ软件,扫描实验结果图。
1.3.6 方法特异性的评价
选取普通大肠埃希氏菌、猪霍乱沙门氏菌、金黄色葡萄球菌、普通变形杆菌、宋内氏志贺菌、蜡样芽孢杆菌、单核细胞增生李斯特菌和铜绿假单胞菌作为待检目标物,进行特异性实验,评价该检测方法的特异性。
1.3.7 级联信号转导系统结合免疫层析检测牛奶中的大肠埃希氏菌O157:H7
将对数期生长的大肠埃希氏菌O157:H7用无菌PBS稀释到101CFU/mL(用平板记数法计算菌浓度),取250 μL菌液接种于25 g牛奶中,将人工污染的牛奶置于225 mL无菌改良EC肉汤培养基中,放置于180 r/min摇床中,37 ℃条件下培养,分别取培养时间为0、4、5、6、7 h的增菌肉汤,用本研究所建方法进行检测。同时使用科玛嘉O157显色培养基鉴定检测。
2 结果与分析
2.1 免疫磁珠捕获效率的评价
免疫磁珠捕获效率越高,所形成复合物中β-内酰胺酶越多,更有利于青霉素水解,进而提高检测灵敏度。制备具有高效捕获效率的免疫磁珠是提高检测灵敏度的关键。使用本研究制备的免疫磁珠捕获不同浓度的大肠埃希氏菌O157:H7,表1结果显示,当菌浓度为2×102~2×107CFU/mL时,捕获效率可以达到约94.17%以上,免疫磁珠对不同浓度的大肠埃希氏菌O157:H7均具有较高的捕获效率。

表1 免疫磁珠对不同浓度大肠埃希氏菌O157:H7的捕获效率Table 1 Capture efficiency of immunomagnetic beads for E.coli O157:H7 at different concentrations
2.2 胶体金纳米探针上E-mAb标记量对检测灵敏度的影响
胶体金纳米探针需满足2 个条件:1)需标记足够多的E-mAb,保证胶体金纳米探针具有高效捕获目标菌的效率;2)胶体金纳米探针需偶联大量的β-内酰胺酶,可高效地水解青霉素,使检测信号被成功地转导并被有效地放大。在弱碱环境下,带负电荷的胶体金可与E-mAb以及β-内酰胺酶的正电荷基团通过静电吸附作用形成牢固的结合。然而胶体金的蛋白承载量有限,若标记抗体量过多,则会导致胶体金的表面被大量抗体占据,而没有足够空间结合大量β-内酰胺酶;若抗体标记量过低,直接导致胶体金探针捕获目标菌效率降低,最终影响检测灵敏度。本研究通过调节胶体金纳米探针上E-mAb标记量,探究E-mAb和β-内酰胺酶标记量对检测灵敏度的影响机制。如图2所示,当E-mAb标记量为5~10 µg时,检测线颜色强度随E-mAb标记量的增加而增强,原因可能是随着E-mAb标记量增加,胶体金纳米探针的捕获效率得到提升,使检测信号增强。进一步增加E-mAb标记量,检测线显色强度开始减弱,原因可能是过量的E-mAb占据了胶体金表面其余的结合位点,导致胶体金上β-内酰胺酶的结合率下降,青霉素水解效率降低,检测灵敏度明显下降。当E-mAb标记量为10 µg时,试纸条上检测线显色最深,ImageJ软件扫描检测结果图显示此时检测线的灰度面积值最高(图2C),此时与胶体金结合的E-mAb和β-内酰胺酶的比例最优。

图2 胶体金纳米探针上E-mAb标记量对检测灵敏度的影响Fig.2 Effect of amount of E-mAb conjugated to AuNPs on detection sensitivity
2.3 胶体金纳米探针添加量对检测信号强度和准确度的影响
胶体金纳米探针添加量越大,目标菌捕获效率和β-内酰胺酶含量则越高,有利于提高检测方法灵敏度。研究在阳性样本和阴性样本中评价了不同胶体金纳米探针添加量对检测信号强度和准确度的影响。由图3A可见,随着胶体金纳米探针添加量的增加,检测线显色强度逐渐加深,当胶体金纳米探针的加入量为5 µL时,检测线信号值明显增加,进一步增加胶体金纳米探针添加量,检测线的信号强度并没有明显增加。阴性对照结果显示(图3B),当胶体金纳米探针添加量为10 µL时,阴性样本检测线出现浅红色条带(图3B1),原因可能是过量的胶体金纳米探针与免疫磁珠形成非特异性吸附。因此,胶体金纳米探针的最优添加量为5 µL。


图3 胶体金探针添加量对检测灵敏度的影响Fig.3 Effect of amount of colloidal gold probe on detection sensitivity
2.4 级联信号转导系统结合免疫层析法检测大肠埃希氏菌O157:H7的灵敏度
利用本研究建立的方法对浓度为2×102~2×107CFU/mL的大肠埃希氏菌O157:H7进行检测。图4结果显示,阴性对照组(PBS)检测线并无检测信号产生,当大肠埃希氏菌O157:H7浓度为2×102CFU/mL时,检测线的灰度面积值显著增加。与相同抗体建立的传统胶体金试纸条检测方法相比,本研究建立的检测方法灵敏度是传统胶体金试纸条检测方法检测灵敏度的570 倍[30](传统方法检测大肠埃希氏菌O157:H7的检测灵敏度为1.14×105CFU/mL)。

图4 级联信号转导体系结合免疫层析法检测大肠埃希氏菌O157:H7灵敏度Fig.4 Sensitivity of cascade signal transduction combined with immunochromatography for the detection of E.coli O157:H7
2.5 级联信号转导系统结合免疫层析检测大肠埃希氏菌O157:H7的特异性
利用本研究建立的方法对8 株常见的食源性致病菌进行检测,同时大肠埃希氏菌O157:H7作为阳性对照,评价方法的特异性。如图5所示,除大肠埃希氏菌O157:H7的检测结果是阳性之外,其他8 种常见食源性致病菌的检测线均无检测信号出现,没有交叉反应产生。结果显示所建立的检测方法具有良好的特异性。
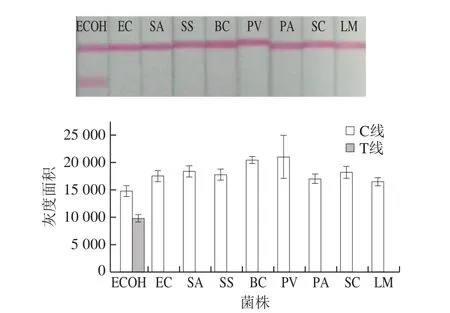
图5 级联信号转导系统结合免疫层析法检测大肠埃希氏菌O157:H7的特异性Fig.5 Specificity of cascade signal transduction combined with immunochromatography for the detection of E.coli O157:H7
2.6 级联信号转导系统结合免疫层析检测牛奶中的大肠埃希氏菌O157:H7
将大肠埃希氏菌O157:H7接种到牛奶中,使其终浓度为2 CFU/g。比较新鲜牛奶接种了大肠埃希氏菌O157:H7后,经过不同时间的增菌培养,用级联信号转导系统结合免疫层析法对牛奶样品进行检测,由图6可知,增菌培养到4 h即可检测到阳性信号。

图6 级联信号转导系统结合免疫层析法检测牛奶中大肠埃希氏菌O157:H7Fig.6 Detection of E.coli O157:H7 in milk by cascade signal transduction system combined with immunochromatography
3 结 论
本研究通过构建级联信号转导体系,将检测信号有效转导并层层放大,实现了大肠埃希氏菌O157:H7的快速超灵敏检测。方法对大肠埃希氏菌O157:H7的检测灵敏度为2×102CFU/mL,相比传统的免疫层析法检测灵敏度提高了570 倍。本研究巧妙地将检测大分子目标菌转移成检测小分子目标物,实现超灵敏检测食源性致病菌的同时规避了双抗夹心免疫层析法中Hook效应存在的影响,为免疫层析法高灵敏准确检测大分子目标物提供了新的思路。

