激活素受体样激酶4,5和7抑制剂体外高通量筛选模型的构建
龙隆*,李菲菲,3*,刘洪英,王莉莉
(1.军事医学科学院毒物药物研究所,北京100850;2.抗毒药物与毒理学国家重点实验室,北京100850;3.北京师范大学生命科学学院,北京100875)
激活素受体样激酶4,5和7抑制剂体外高通量筛选模型的构建
龙隆1,2*,李菲菲1,2,3*,刘洪英1,2,王莉莉1,2
(1.军事医学科学院毒物药物研究所,北京100850;2.抗毒药物与毒理学国家重点实验室,北京100850;3.北京师范大学生命科学学院,北京100875)
目的 构建适于高通量筛选的激活素受体样激酶4(ALK4),ALK5和ALK7抑制剂的筛选模型。方法利用Bac to Bac昆虫杆状病毒表达系统,构建ALK4激酶结构域(ALK4kd),ALK5kd和ALK7kd及Smad2和Smad3蛋白的病毒表达系统,转染Sf9昆虫细胞,表达目的蛋白;通过谷胱甘肽S-转移酶(GST)亲和柱纯化,获得纯化的目的蛋白;分别以纯化的ALK4,ALK5,ALK7激酶片段与纯化的Smad3和ATP构建ALK4,ALK5,ALK7激酶活性测定体系,优化各反应底物浓度及反应条件,建立适于通量化分析的筛选模型;以已知ALK激酶抑制剂SB431542为工具分子,检测其对激酶的抑制活性,确证筛选模型的可靠性。结果 经酶切和PCR鉴定,所得重组Bacmid均正确。转染Sf9昆虫细胞后纯化获得相应目的蛋白。经条件优化,反应体系中激酶和底物蛋白Smad3最佳浓度均为10 mg·L-1,ATP最佳初始浓度为10 nmol·L-1。所得ALK4,ALK5和ALK7激酶抑制剂筛选体系的Z′因子分别为0.71,0.51和0.74,符合高通量筛选要求。已知SB431542在所建模型上对ALK4kd,ALK5kd和ALK7kd的抑制活性IC50值分别为22,188和91 nmol·L-1。结论成功构建了ALK4,ALK5和ALK7激酶抑制剂的体外筛选模型。
激活素受体样激酶;Bac to Bac昆虫杆状病毒表达系统;高通量筛选分析;Smad3蛋白
转化生长因子β(transforming growth factor-β,TGF-β)是一类广泛分布在多种生物的多种组织中的细胞生长因子,在从蠕虫到哺乳动物的多种组织细胞中均有发现。该信号通路是一个复杂的超家族,配体包括TGF-β、激活素(activin)、抑制素(inhibin)、骨形态发生蛋白(bone morphogenetic protein,BMP)和苗勒抑制物质(mullerian-inhibiting substance,MIP)等;受体有Ⅰ型、Ⅱ型和Ⅲ型3种,其中Ⅰ型受体共7个,分别为激活素受体样激酶1~7(activin receptor-like kinase 1~7,ALK 1~ALK 7)[1];胞内信号至少由8种Smad蛋白介导[2]。配体结合受体后诱导Ⅱ型受体自身磷酸化并磷酸化Ⅰ型受体,活化的Ⅰ型受体再磷酸化下游的转录调节因子Smad信号蛋白,调节下游相应基因的表达。该复杂的信号通路在细胞的生长分化、组织器官的发育,以及损伤修复等众多生物学过程中发挥作用[3],其中Ⅰ型受体是决定细胞内信号特异性的关键分子。
TGF-β信号通路的异常与多种器官如肾、肝和心等的慢性进展性纤维化病变相关。研发该信号通路的抑制剂,特别是Ⅰ型受体ALK选择性丝/苏氨酸磷酸酶抑制剂,对于治疗和缓解相应病症具有重要意义[4-7]。然而,该通路抑制剂的现有筛选和评价方法有限。常用方法包括荧光素酶报告基因法检测该通路下游转录因子Smad蛋白的功能开放程度[8],以此反映该通路的激活程度。或采用Western蛋白印迹法定量磷酸化底物的量,或通过检测细胞中[32P]标记ATP的方法,反映酶活性[8-9]。这些方法因为步骤繁琐,通量低,不适用于化合物的大量筛选,且无法区分化合物对不同亚型受体的选择性。
基于以上现状,本研究分别构建了Ⅰ型受体ALK4,ALK5和ALK7激酶活性抑制剂的体外筛选平台。首先分别构建ALK4激酶结构域(ALK4 kinase domain,ALK4kd),ALK5kd和ALK7kd,以及底物蛋白Smad2和Smad3的昆虫表达系统,表达并纯化获得相应的目的蛋白,并以此构建适用高通量快速筛选的ALK4和ALK5和ALK7激酶抑制剂筛选模型。ALK4kd,ALK5kd和ALK7kd分别截取表达ALK4蛋白的207~498 aa,ALK5蛋白的209~496 aa以及ALK7蛋白的195~486 aa。ALK4kd,ALK5kd和ALK7kd能够利用ATP,将底物蛋白Smad2/3磷酸化激活,在一定范围内,含有等量酶、底物蛋白和ATP的反应体系在反应相同时间后,体系中剩余的ATP量与酶的活性成反比关系。可以通过Promega的ATP定量试剂盒,采用化学发光仪,检测相对光单位(relative light unit,RLU),确定体系中剩余ATP的量,以此反映酶的活性。
1 材料与方法
1.1 试剂
所有限制性内切酶、连接酶、普通Taq酶、高保真Taq酶及相关试剂均购于大连宝生物公司;普通质粒提取试剂盒和胶回收试剂盒购于Omega公司(美国);Grace培养基购自Gibco公司(美国);蛋白纯化GST柱购于Pierce公司(美国);ATP检测试剂盒和荧光素酶检测试剂盒购自Promega公司(美国);化学发光专用96孔板购自PE公司(美国)。
三抗蓝白斑筛选平板:1%胰蛋白胨,0.5%酵母提取物,0.5%NaCl,1.5%琼脂,DDW配置,高压灭菌后,冷却至60℃左右,补加庆大霉素7 mg·L-1,四环素10 mg·L-1,卡那霉素50 mg·L-1,IPTG 50 mg·L-1及X-gal 100 mg·L-1,混匀后快速倒入10 cm无菌培养板中,每板15 mL,冷却后,密封,4℃备用。
SOC培养基(μmol·L-1):NaCl 10,KCl 2.5,MgCl210,MgSO410,葡萄糖20;2%tryptone胰蛋白胨,0.5%酵母提取物,pH 7.0,0.22 μm滤膜过滤除菌。
Bacmid提取溶液Ⅰ(μmol·L-1):Tris-Cl 15,EDTA 10,RNA酶A 100 mg·L-1,pH 8.0,0.22 μm滤膜过滤除菌。Bacmid提取溶液Ⅱ:NaOH 0.2 mol·L-1,1% SDS,0.22 μm滤膜过滤除菌。Bacmid提取溶液Ⅲ:乙酸钾3 mol·L-1,pH 5.5,0.22 μm滤膜过滤除菌。PBS裂解液(μmol·L-1):含DTT 10,PMSF 1,亮抑酶肽1 mg·L-1,抑肽酶1 mg·L-1,DNA聚合酶Ⅰ5 mU·L-1,RNA酶A 10 mg·L-1的PBS。蛋白纯化洗脱液(μmol·L-1):Tris-Cl 50,NaCl 1×105,DTT 25,pH 8.5。酶促反应缓冲液(μmol·L-1):Tris-醋酸50,MgCl210,二甲苯青5 mg·L-1,pH 7.75,高压灭菌备用。酶稀释液(μmol·L-1):Tris-Cl 50,NaCl 1×105,DTT 25,GSH 20,pH 8.5。EGFP-Smad2实验缓冲液:F12培养基,补充0.1%BSA,HEPES 10 μmol·L-1。
1.2 菌株和细胞
感受态DH5α购自大连宝生物公司。Bac to Bac昆虫表达系统购自Invitrogen(美国),其中DH10Bac感受态大肠杆菌培养于含四环素10 mg·L-1,卡那霉素50 mg·L-1的LB液体培养基中。昆虫Sf9细胞购自中国医学科学院基础医学研究所细胞资源中心,培养于含10%FBS的Grace培养液中,培养条件27~28℃,空气介质,无需补充CO2。
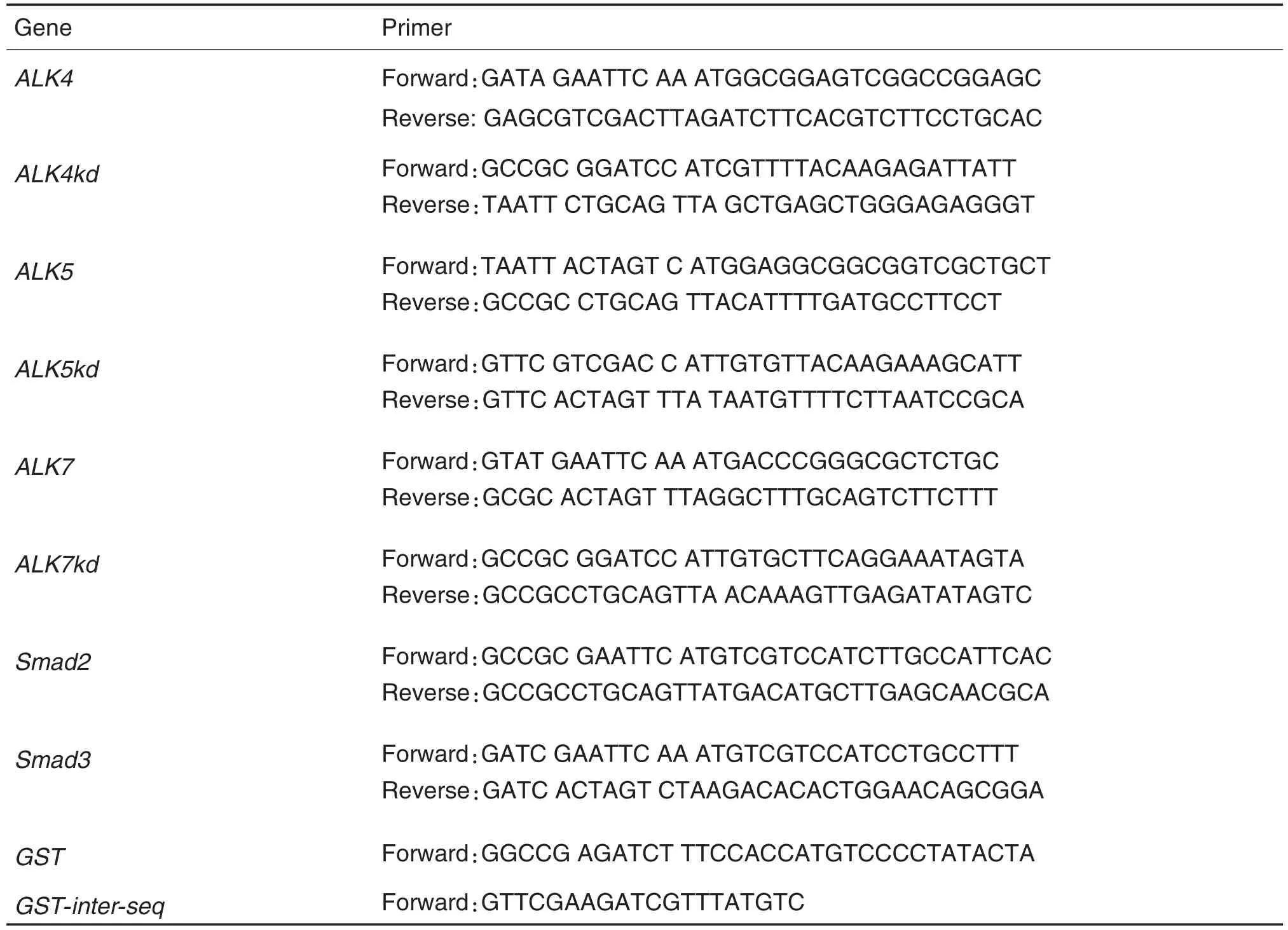
1.3 引物设计与合成
该课题所用引物均由北京三博远志生物技术公司合成。所用引物序列如表1。
1.4 重组Bacmid的构建及验证
质粒构建过程以ALK4为例进行介绍,其余蛋白步骤相同。利用ALK4全长上下游引物,从人cDNA文库中调取ALK4全长序列。PCR扩增产物经1%琼脂糖凝胶电泳分离和回收后,经T4连接酶连接到T载体pGEM-5ZF(+)上,获得PGEM-5ZF(+)-ALK4重组质粒。再用ALK4kd上下游引物从上述重组质粒中调取ALK4kd片段,PCR扩增产物经T4连接酶连接到T载体pMD18-T上,获得pMD18-T-ALK4kd重组质粒。将所得质粒扩增,用Pst I+Bam H I双酶切后切胶回收880 bp片段,获得带粘性末端的ALK4kd目的片段。将切胶回收的ALK4kd目的片段和线性化带粘性末端的pFast-Bac1-谷胱甘肽S-转移酶(glutathione-S-transferase,GST)通过T4连接酶连接成重组质粒pFastBac1-GST-ALK4kd。以上所得各质粒均经过酶切鉴定、PCR鉴定和测序鉴定。
将pFastBac1-GST-ALK4kd质粒转化DH10Bac感受态菌株,具体步骤如下:DH10Bac感受态菌液100 μL置于1.5 mL离心管中,加入100 μg·L-1的重组pFastBac1-GST-ALK4kd质粒0.5 μL,轻弹混匀,冰浴30 min后,42℃水浴45 s,立即冰浴2 min。其中加入900 μL SOC培养基,37℃250 r·min-1摇菌4 h,用SOC培养基按1∶10000将菌液稀释后,取100 μL稀释菌液涂布三抗蓝白斑筛选平板,37℃倒置培养48 h,选10个白斑克隆分别在三抗蓝白斑筛选平板上划线扩增,37℃倒置培养24 h,选全为白斑平板上的菌作为阳性克隆。选3个阳性克隆,以ALK4kd上下游引物或GST序列上正向引物与ALK4kd下游反向引物的组合进行菌落PCR验证。
阳性克隆按照以下步骤提取重组Bacmid:阳性菌接种于2 mL含三抗的LB液体培养基中,37℃250 r·min-1摇晃培养24 h。取1.5 mL菌液室温12 000×g离心1 min,弃上清收集菌体。加入0.3 mL溶液I,重悬菌体。加入0.3 mL溶液Ⅱ,颠倒混匀8~10次,室温静置10 min。慢慢加入0.3 mL溶液Ⅲ,轻轻混匀,冰浴10 min后,4℃12 000×g离心10 min。取上清于新离心管中,加入等体积(约0.8 mL)异丙醇,颠倒混匀8~10次,冰浴10 min后,4℃12 000×g离心10 min,弃上清。管中加入0.8 mL 70%乙醇洗1次,4℃12 000×g离心5 min,弃上清。重复上步操作,弃上清后,离心管及底部DNA沉淀室温干燥10 min。用40 μL灭菌双蒸水溶解DNA,4℃备用。
1.5 包装病毒的生产
配制转染混合物:每孔30 μL重组Bacmid(1 μg),加入95 μL Grace培养液,混匀成混合液Ⅰ,每孔6 μL CellFECTIN试剂加入到每孔94 μL Grace培养液混匀后成混合液Ⅱ,将混合液Ⅰ和Ⅱ混匀后,室温静置45 min,每孔加入0.8 mL Grace培养液,配制成转染混合物。培养于6孔板中的昆虫Sf9细胞在丰度80%~90%时换Grace培养液脱血清,1 h后弃培养液,每孔加入1 mL上述转染混合物,27~28℃孵育5 h。弃去转染混合物,加入含10%FBS的新鲜Grace培养液,27~28℃,空气条件培养。3~4 d后吸取细胞培养液上清,500×g离心取上清为P1病毒,4℃保存6个月内使用或补加2%FBS,-70℃长期冻存。
培养于T25细胞培养瓶中的昆虫Sf9细胞在丰度70%~90%时,每瓶接种50 μL P1病毒,病毒吸附1 h后换含10%FBS的新鲜Grace培养液,感染3~4 d后收集P2病毒上清,4℃保存6个月内使用或补加2%FBS,-70℃长期冻存。
1.6 目的蛋白表达及纯化
昆虫Sf9种于6孔板中,至细胞丰度80%~90%时每孔接种50 μL P2病毒,吸附1 h后换含10% FBS的新鲜Grace培养液,培养1,2,3,4和5 d等不同的时间长度,裂解细胞后,用聚丙烯酰胺凝胶电泳分离蛋白条带,考马斯亮蓝染色后,判断目的蛋白的表达情况。
Tab.1 Sequence of primers
昆虫Sf9细胞按上述步骤感染P2病毒后,培养至目的蛋白表达最丰(据条件优化,GST、ALK4kd和Smad3约72 h,ALK5kd约84 h,ALK7kd约60 h,Smad2约96 h)时,用预冷PBS吹下细胞,PBS洗2次后离心收集细胞沉淀,细胞量控制在每个样品约1×107个。用1 mL预冷PBS裂解液重悬细胞,冰水浴下超声破碎10 s停30 s,重复5次破碎细胞。4℃12 000×g离心2 min,取上清加入到100 μL充分混悬的50%固定化还原型谷胱甘肽胶混合液(Thermo PIERCE)中,室温混匀10 min。1200×g离心2 min,弃上清。用0.5 mL PBS重悬胶,将胶加入到柱托架中,10 000×g离心2 min,形成柱芯。向柱芯中加入0.5 mL PBS孵育5 min,室温10 000×g离心2 min洗柱芯,重复洗柱芯3次,注意在每次离心后收集滤过液并更换新的收集管。向柱芯中加入100 μL洗脱液,室温孵育5 min,室温10 000×g离心2 min,重复洗脱4次,分别收集洗脱液获得纯化目的蛋白。SDS-PAGE电泳鉴定滤过液和洗脱液,并定量洗脱液中目的蛋白浓度。柱芯可用NaCl 5 mol·L-1充分冲洗再生并用PBS冲洗平衡,置于100 μL PBS中4℃保存,可再次用于相同目的蛋白的纯化。用于蛋白表达的验证和表达条件优化。
1.7 ATP标准曲线的生成
ATP检测采用化学发光仪Microlumat Plus LB96V Luminometer(Berthold Technologies,德国)进行。以酶反应缓冲液为体系,配制梯度浓度的ATP(终浓度分别为0.01,0.1,1,10和100 nmol·L-1),各取50 μL,加入到化学发光专用96孔板中。采用化学发光仪加样臂,向每个反应体系中加入50 μL的rL/L显色液(Cat No.FF2000,Promega),2 s后开始读数,累积读10 s。逐孔加样、读数。以不加ATP的酶反应缓冲液加入rL/L显色液后的读数作为背景RLU读数,从反应体系的RLU读数中扣除。
1.8 反应条件优化
ALK4kd,ALK5kd和ALK7kd的活性表现为利用ATP将Smad蛋白磷酸化成pSmad。建立包含ALK、Smad3底物蛋白和ATP的反应体系,体系中Smad3蛋白中浓度固定为10 mg·L-1,确保足够的底物量。分别对体系中激酶量、ATP量进行优化,激酶设0.1,0.3,1,3和10 mg·L-1浓度梯度,设ATP 2和10 nmol·L-1。以酶稀释缓冲液替代酶,配制反应体系,作为阴性对照;以无ATP水替代ATP,配制反应体系,作为阳性对照。反应总体积200 μL, 30℃孵育3 h后,取50 μL反应体系于化学发光专用96孔板中,采用化学发光仪加样臂,向每个反应体系中加入50 μL的rL/L显色液,2 s后开始读数,累积读数10 s。逐孔加样,逐孔读数。以阴性对照的RLU值为0%ATP利用率,以阳性对照RLU值为100%ATP利用率,计算各样品组的ATP利用率。
1.9 筛选模型建立
酶促反应缓冲液中加入终浓度为10 mg·L-1的激酶,0.01,0.03,0.1,0.3,1和23 μmol·L-1的阳性化合物SB431542,37℃反应30 min后,补加终浓度10 mg·L-1Smad3蛋白和终浓度10 nmol·L-1的ATP。以酶稀释缓冲液代替酶,DMSO代替化合物,形成包含DMSO(药物溶媒)、Smad3蛋白和ATP的反应体系为阳性对照,即ATP不被利用,酶活性100%被抑制;以DMSO代替化合物,形成包含酶、DMSO(药物溶媒)、Smad3蛋白和ATP的反应体系作为阴性对照,即酶活性完全不被抑制。反应体系总体积200 μL,30℃孵育3 h,反应结束后,取50 μL反应体系于化学发光专用96孔板中,采用化学发光仪加样臂,向每个反应体系中加入50 μL rL·L-1显色液,2 s后开始读数,累积读数10 s,对反应体系中剩余ATP进行定量分析,逐孔加样,逐孔读数。
1.10 统计学分析
实验结果 数据表示为x±s,采用Excel软件进行数据处理。采用Graphpad 5.0软件绘制柱状图和浓度依赖曲线。使用One-way ANOVA进行数据分析,P<0.05为差异有统计学意义。
2 结果
2.1 重组Bacmid的构建和验证结果
将人ALK4基因通过T4连接酶插入到T载体pGEM-5ZF(+)中后,得到pGEM-5ZF(+)-ALK4重组质粒(图1A1)。转化感受态DH5α大肠杆菌,并扩增重组质粒。将所得质粒分别进行BgⅢ+SpeⅠ双酶切,SacⅠ单酶切和pvuⅡ单酶切鉴定,结果 均正确(图1A2)。同时,对重组质粒进行测序鉴定,结果 正确。重组质粒PGEM-5ZF(+)-ALK4构建成功。
用ALK4kd上下游引物扩增得到目的片段,并通过T4连接酶连接到T载体pMD18-T上,得到重组质粒pMD18-T-ALK4kd(图1B1)。所得质粒采用ALK4kd上下游引物进行PCR扩增鉴定,结果 得到880 bp的ALK4kd片段,如图2B2所示,表明pMD18-T-ALK4kd重组质粒构建成功。
用PstⅠ和Bam HⅠ酶从pMD18-T-ALK4kd质粒上切得带黏性末端的ALK4kd片段,与带相同黏性末端的pFastBac1-GST质粒连接,生成目的质粒pFastBac1-GST-ALK4kd(图2A),并转化DH5α大肠杆菌。采用GST上游引物、ALK4kd下游引物对阳性菌落进行PCR验证,结果 得到1400 bp的目的片段,与预期结果 一致(图2B)。对阳性质粒进行PstⅠ和BamHⅠ双酶切鉴定,得到5377和889 bp的条带,与预期结果 一致(图2C)。此外,还将所得质粒进行测序鉴定,结果 表明,pFastBac1-GSTALK4kd质粒构建成功。

Fig.1 Construction of pGEM-5ZF(+)-ALK4 and pMD18-T-ALK4kd.A1:plasmid pGEM-5ZF(+)-ALK4.A2:identification of pGEM-5ZF(+)-ALK4 by restriction enzyme digestion.Lane 1:BgⅢ+SpeⅠ;lane 2:SacⅠ;lane 3:PvuⅡ;lane 4:marker.B1:plasmid pMD18-T-ALK4kd.B2:PCR identification of pMD18-T-ALK4kd,ALK4kdforward and reverse primers were used in PCR amplification.Lane 1:plasmid;lane 2:marker.

Fig.2Construction of pFastBac1-GST-ALK4kd.A:plasmid pFastBac1-GST-ALK4kd.B:bacterial colony PCR identification of the plasmid using GST forward primer and ALK4kd reverse primer.Lane 1:marker;lane 2:PCR procluct.C:plasmid identification byPstⅠandBamHⅠdouble digestion.Lane 1:marker;lane 2:plasmid.
将所得pFastBac1-GST-ALK4kd质粒扩增后,转化Bac to Bac系统的DH10Bac感受态菌株。pFastBac1-GST-ALK4kd质粒中包含庆大霉素抗性序列、多角体蛋白启动序列PH、和目的蛋白序列GST-ALK4kd的Tn7转座子。转座子在转座酶的协助下,转座到DH10Bac中Bacmid上的相应位点上,形成新的Bacmid-GST-ALK4kd重组Bacmid。发生正确重组的DH10Bac菌株具有庆大霉素、卡那霉素和四环素三重抗性,且半乳糖苷酶LacZ的表达序列被破坏。因此,可通过含以上3种抗性的蓝白斑筛选平板对发生重组的克隆进行筛选。所得阳性克隆采用ALK4kd正反向引物进行PCR验证,结果 如图3A所示,可得到880 bp的目的片段。同时,采用GST序列上正向引物和ALK4kd反向引物进行PCR验证,也成功的获得了1100 bp的目的片段(图3B),表明重组Bacmid构建成功。
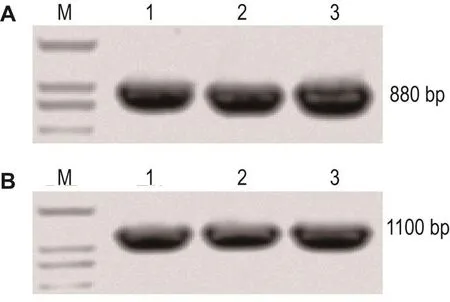
Fig.3Identification of three positive clones usingALK4kdforward and reverse primer(A)and GST intra forward primer andALK4kdreverse primer(B)by PCR.Lane 1,2 and 3 represent three different positive clones.
2.2 重组Bacmid的包装和鉴定
除ALK4kd的真核表达Bacmid外,还构建了ALK5kd和ALK7kd以及TGF-β下游分子Smad2和Smad3的真核表达Bacmid,构建和验证方法同ALK4kd。将此5个Bacmid分别感染Sf9细胞。如图4A所示,感染病毒3 d后,Sf9细胞的密度与正常细胞相比无显著改变,表明细胞的生长速度不受病毒感染的影响。然而,细胞在感染病毒后发生了细胞膨大、起泡、颗粒物质形成和贴壁不紧密等形态改变,与已有报道一致[10]。
病毒感染Sf9细胞后,用各目的片段的上下游引物对细胞裂解液进行PCR验证,结果 如图4B所示,感染ALK4kd,ALK5kd和ALK7kd重组Bacmid包装病毒的Sf9细胞裂解液中特异性地存在PCR产物。同样,感染Smad2重组Bacmid包装病毒的Sf9细胞裂解液,分别用Smad2全长正反向引物或GST序列上的正向引物和Smad2全长反向引物进行PCR,可得到预期的1400 bp和1600 bp片段(图4C);感染Smad3重组Bacmid包装病毒的Sf9细胞裂解液,以Smad3全长正反向引物进行PCR,可得到1100 bp的目的片段(图4D)。结果 表明,各表达Bacmid对Sf9细胞的感染均能成功将目的片段引入细胞中。
2.3 目的蛋白的表达和纯化
分别收集感染病毒1,2,3,4和5 d的细胞裂解液,进行SDS-PAGE凝胶电泳,判断目的蛋白的表达情况。结果 表明,GST,GST-ALK4kd和GSTSmad3蛋白在感染72 h后蛋白表达丰度达到最大,而GST-ALK5kd,GST-ALK7kd和GST-Smad2分别在感染后84,60和96 h达到最大表达丰度。如图5E所示(图中细胞均为最优蛋白表达丰度条件下收集),箭头所示条带即为目的蛋白条带,是细胞中丰度最高的蛋白。用GST一抗进行免疫印迹检测,识别各跑道中的目的条带,结果 如图4F所示,目的蛋白条带的相对位置与图4E中一致。如图4G所示,每个跑道上均含单一蛋白条带,表明纯化过程中蛋白纯度合格。以浓度为0.1 g·L-1牛血清白蛋白(bull serum albumin,BSA)为内参,对目的蛋白进行定量,结果 获得目的蛋白浓度分别为GST 0.203 g·L-1,ALK4kd 0.022 g·L-1,ALK5kd 0.019 g·L-1,ALK7kd 0.022 g·L-1,Smad2 0.026 g·L-1和Smad3 0.024 g·L-1。
2.4 成功获得活性蛋白并建立体外筛选模型
TGF-β结合细胞膜表面的Ⅱ型受体后,Ⅱ型受体结合并激活Ⅰ型受体,Ⅰ型受体的胞内激酶结构域通过消耗ATP,将底物蛋白Smad2/3磷酸化。被磷酸化的Smad2/3蛋白入核,介导下游基因的表达。利用ALK激酶消耗ATP将Smad2/3蛋白磷酸化这一特点,通过测定含ALK激酶结构域、Smad2/ 3蛋白、ATP的反应体系中ATP的剩余量,可反映体系中ALK的激酶活性。ATP的定量检测采用Promega的ATP定量检测试剂盒和化学发光检测系统,检测原理如图5A所示,在有氧情况下,ATP促进D-荧光素的氧化反应,生成氧化荧光素、AMP、焦磷酸以及CO2的同时,生成560 nm光子,可通过检测固定时间内散发的光子的量,反映体系中ATP的含量。首先,测定适用于该化学发光检测系统的ATP线性范围。如图5B所示,当待测ATP浓度在10 nmol·L-1~0.1 mol·L-1之间时,ATP浓度与化学发光仪检测到的RLU值成良好线性关系。
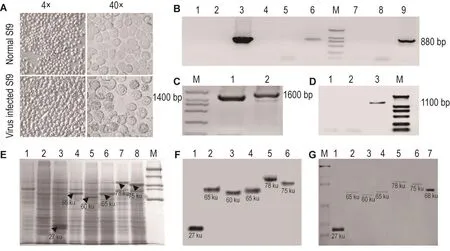
Fig.4 Expression and purification of target proteins.A:Sf9 cell morphology before and after virus infection.B:PCR identification of cell lysate after ALK4kd,ALK5kd and ALK7kd virus,forward and reverse primers for each fragment were used separately. Lanes 1,4,7:normal Sf9 cell;lanes 2,5,8:blank bacmid infected cells;lane 3:Bacmid-GST-ALK4kd infected cells;lane 6:Bacmid-GST-ALK5kd infected cells;lane 9:Bacmid-GST-ALK7kd infected cells.C:PCR identification of cell lysate after Bacmid-GST-Smad2 infection.Lane 1:Smad2 forward and reverse primer were used;lane 2:GST intra forward primer and Smad2 reverse primer were used.D:PCR identification of cell lysate after Bacmid-GST-Smad3 infection,Smad3 forward and reverse primers were used.Lane 1:normal cell;lane 2:blank bacmid infected cells;lane 3:Bacmid-GST-Smad3 infected cells.E:SDS-PAGE of different cell lysate,the arrow indicate the target protein band.Lane 1:normal Sf9 cell;lane 2:blank bacmid infected cells;lane 3:bacmid-GST infected cells;lane 4:bacmid-GST-ALK4kd infected cells;lane 5:bacmid-GST-ALK5kd infected cells;lane 6:bacmid-GST-ALK7kd infected cells;lane 7:bacmid-GST-Smad2 infected cells;lane 8:bacmid-GST-Smad3 infected cells.F:Western blotting of different cell lysate using anti-GST antibody.Loading sequence was identical to lane 3-8 in E.G:SDS-PAGE of purified proteins.Loading for lane 1-6 was identical to lanes 3-8 in E;lane 7:BSA.
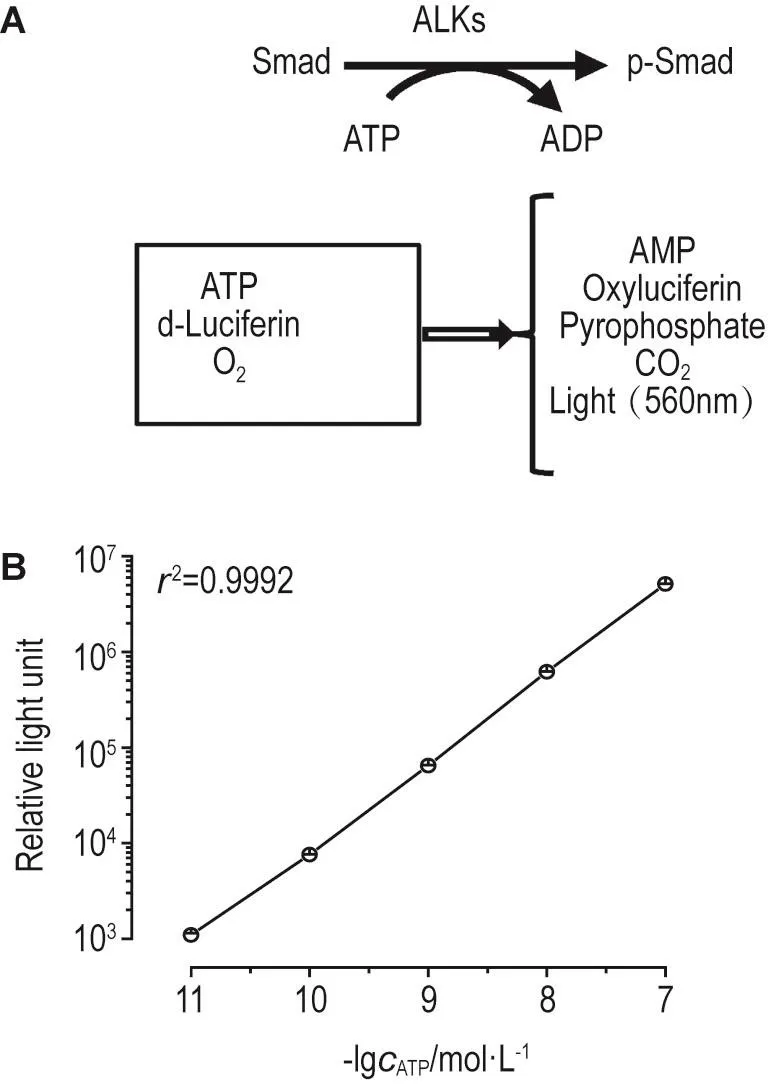
Fig.5 Validation of constructed screening system.A:mechanism of the screening system;B:standard curve for ATP detection.
对反应体系中酶的终浓度和ATP的终浓度进行优化,当体系中ATP初始浓度为10 nmol·L-1时,ALK4,ALK5和ALK7激酶消耗ATP的能力均与蛋白量呈现良好的浓度依赖关系,而降低体系中初始ATP的浓度至2 nmol·L-1时,该浓度依赖关系消失。因此,选用体系初始ATP浓度为10 nmol·L-1。对反应体系中酶的最适浓度进行优化,当体系中ATP浓度固定为10 nmol·L-1,Smad3蛋白浓度为10 mg·L-1时,激酶消耗ATP的能力随激酶浓度增加而梯度增加。当激酶浓度达最大,即10 mg·L-1时,3种激酶消耗ATP的比例分别为39%,34%和22%。为保证激酶抑制剂筛选时ATP消耗的窗口值,选择最大激酶浓度10 mg·L-1为体系中的最终激酶浓度。
采用已知ALK4,5和7的共同抑制剂SB431542,验证该体系的灵敏性。如图6所示,SB431542浓度依赖性地抑制了ALK4kd,ALK5kd和ALK7kd的激酶活性,IC50值分别为22 nmol·L-1,188 nmol·L-1和91 nmol·L-1,与文献报道一致[11]。该体外筛选模型建立成功。

Fig.6 SB431542 inhibits kinase activities of ALK4,ALK5 and ALK7 in a concentration-dependent manner.
如表2所示,得出ALK4,ALK5和ALK7筛选体系的平均Z’因子分别为0.71,0.51和0.74,均符合高通量筛选对体系稳健性的要求。

Tab.2 Z′factors of established screening assays
3 讨论
利用真核表达所得的TGF-β信号通路受体激酶结构域ALK4kd,ALK5kd和ALK7kd及底物蛋白Smad2/3,本文成功构建了TGF-β信号通路受体ALK4,ALK5和ALK7激酶抑制剂的体外筛选模型。通过验证表明,在该筛选模型中,阳性化合物SB431542对ALK4,ALK5和ALK7激酶活性的抑制IC50值分别为22,188和91 nmol·L-1。
该细胞外筛选系统能够满足高通量和快速筛选需求。昆虫Sf9细胞为悬浮生长状态,可实现液体摇晃培养。通过本课题发现,从1 L培养体积的Sf9细胞悬液中,可最终分离纯化到至少1 mg目的蛋白。而按照每个反应体积200 μL,蛋白浓度10 mg·L-1计算,1 mg目的蛋白可完成约500个反应。在通量上与已有的荧光素酶报告基因法相当[8],但显著高于Western蛋白印迹法定量磷酸化底物的量,或通过检测细胞中[32P]标记ATP的方法[8-9]。此外,该体外筛选模型体系组成相对简单,仅由靶蛋白ALK,底物蛋白Smad、ATP以及药物组成,相比基于细胞体系的Smad2-EGFP核转位模型,筛选结果 更加专一和特异,目的性更强,并且能够区分化合物对不同受体亚型的选择性。该模型与细胞筛选模型结合使用,能够准确而有效地筛选得到TGF-β信号通路抑制剂。
该筛选系统仍具有一定缺陷,即以ATP为检出方式。该检出方式容易因为环境中痕量ATP的污染,而造成检测结果 失真。因此,在实验全程中需严格使用一次性用品。并在每次实验前,用50%的次氯酸钠冲洗和浸泡化学发光仪的加样管道和器皿1 h,浸泡后用无ATP的蒸馏水或去离子水充分漂洗10次,以除去体系中的细菌及痕量的ATP污染。
综上,该筛选模型的筛选结果 真实、可靠,可用于高通量快速筛选TGF-β信号通路抑制剂,对促进该通路抑制剂的研发具有重要意义。
[1]Watanabe R.Activin receptor-like kinase and the insulin gene[M]//Litwack G.Activins and Inhibinsed.Vol 85.Massachusetts:Academic Press,2011:1-27.
[2]Liu H,Wei W.TGFβ signal pathway and antiTGFβ strategies for treatment of liver fibrosis[J].Chin Pharmacol Bull(中国药理学通报),2007,23(5):561-565.
[3]Yang RQ,Cheng XS.Advances in the signal transduction of transforming growth factor-β family[J]. Acta Acad Med Jiangxi(江西医学院学报),2004,44(01):120-123.
[4]Li XZ,Liu FN,Dai XP,Li S.Advances in the transforming growth factor-β signaling pathways and its pathway inhibitors[J].Foreign Sci Pharm(国外医学药学分册),2006,33(5):331-335.
[5]Tsuchida K,Nakatani M,Uezumi A,Murakami T,Cui X.Signal transduction pathway through activin receptors as a therapeutic target of musculoskeletal diseases and cancer[J].Endocr J,2008,55(1):11-21.
[6]Liu XJ,Ruan CM,Gong XF,Li XZ,Wang HL,Wang MW,et al.Antagonism of transforming growth factor-Beta signaling inhibits fibrosis-related genes[J].Biotechnol Lett,2005,27(20):1609-1615.
[7]Chen R,Xie ML.The research progress of TGF-β/ Smads signal pathway in the treatment of myocardial fibrosis and its application[J].Chin Pharmacol Bull(中国药理学通报),2012,28(9):1189-1192.
[8]Inman GJ,Nicolás FJ,Callahan JF,Harling JD,Gaster LM,Reith AD,et al.SB-431542 is a potent and specific inhibitor of transforming growth factorbeta superfamily type I activin receptor-like kinase(ALK)receptors ALK4,ALK5,and ALK7[J].Mol Pharmacol,2002,62(1):65-74.
[9]Callahan JF,Burgess JL,Fornwald JA,Gaster LM,Harling JD,Harrington FP,et al.Identification of novel inhibitors of the transforming growth factorbeta1(TGF-beta1)type 1 receptor(ALK5)[J].J Med Chem,2002,45(5):999-1001.
[10]Tissue Culture Group of Laboratory of Insect Virus, the Biology Department of Huazhong Normal University.Replication of cotton boll worm nuclear polyhedrosis virus in in vitro cultured cells[J].J Cent China Norm Univ(Natl Sci)(华中师院学报:自然科学版),1979,(2):18-20.
[11]Laping NJ,Grygielko E,Mathur A,Butter S,Bomberger J,Tweed C,et al.Inhibition of transforming growth factor(TGF)-beta1-induced extracellular matrix with a novel inhibitor of the TGF-beta typeⅠreceptor kinase activity:SB-431542[J].Mol Pharmacol,2002,62(1):58-64.
Construction of in vitro high-throughput screening system for activin receptor-like kinases 4,5 and 7 inhibitors
LONG Long1,2*,LI Fei-fei1,2,3*,LIU Hong-ying1,2,WANG Li-li1,2
(1.Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850, China;2.State Key laboratory of Antitoxic Drugs and Toxicology,Beijing 100850,China; 3.College of Life Sciences,Beijing Normal University,Beijing 100875,China)
OBJECTIVETo establish an in vitro screening system for activin receptor-like kinase 4, 5 and 7(ALK4,ALK5 and ALK7)inhibitors.METHODSThe insect expression systems for kinase domain of ALK4,5,7 and Smad2/3 proteins were established using the Bac to Bac baculovirus expression system.The desired proteins were expressed in Sf9 insect cells and purified by GST affinity.The screening system was composed of the kinase,Smad3 protein,ATP as well as the compound.The impact of the compound on the activities of ALK kinase domains was examined by measuring the amount of remnant ATP in the system as ALKs catalyzed the phosphorylation of Smad3 protein and consumed ATP during the process. The screening conditions were optimized,and validation of the screening system was conducted using known ALKs inhibitors.RESULTSAll the reconstructed Bacmids were identified to be correct by PCR and restriction enzyme digestion.All the proteins were expressed in Sf9 insect cells after transfection, and purified proteins were achieved by GST affinity purification.For the screening system,the optimized kinase concentration and Smad3 concentration were 10 mg·L-1and the optimized ATP concentration was 10 nmol·L-1.The Z′factor for ALK4,ALK5,and ALK7 kinase inhibitors screening system was 0.71,0.51 and 0.74,respectively.The well-known ALK inhibitor SB431542 inhibited the catalytic activities of ALK4,ALK5,and ALK7 with IC50values of 22,188 and 91 nmol·L-1,respectively.CONCLUSIONThe in vitro screening system for ALK4,ALK5 and ALK7 inhibitors is successfully established.
activin receptor-like kinase;Bac to Bac insect baculovirus expression system;highthroughput screening assays;Smad3 protein
The project supported by National Natural Science Foundation of China(81430090);National Science and Technology Major Project of China(2009ZX09501031);and National Science and Technology Major Project of China (2012ZX09301003-003)
WANG Li-li,Email:wangll63@126.com,Tel:(010)88932674
R965.1
A
1000-3002-(2017)06-0581-09
10.3867/j.issn.1000-3002.2017.06.013
2017-01-03接受日期:2017-05-09)
(本文编辑:乔虹)
国家自然科学基金(81430090);国家科技重大专项(2009ZX09501031);国家科技重大专项(2012ZX09301-003003)
龙隆,女,实验师,主要从事药物筛选工作;李菲菲,女,博士,主要从事药物作用机制评价工作。
王莉莉,E-mail:wangll63@126.com,Tel:(010)88932674
*共同第一作者。
*Co-first author.
——一道江苏高考题的奥秘解读和拓展

