花菜类杂交种纯度鉴定SSR 核心引物筛选
丁 燕 木万福 杨 龙 张 鹏 管俊娇
(1 云南省农业科学院质量标准与检测技术研究所,昆明 650205;2 云南省农业科学院热区生态农业研究所,元谋 651300)
甘蓝种(Brassica oleraceaL.)是十字花科芸薹属的二倍体种,起源于欧洲地中海沿岸,由甘蓝野生种经过自然和人工的双重选择形成了不同的栽培类型,如普通甘蓝、羽衣甘蓝、皱叶甘蓝、紫甘蓝、抱子甘蓝、苤蓝、青花菜、花椰菜以及芥蓝等变种[1]。花椰菜(B.oleraceavar.botrytis)和青花菜(B.oleraceavar.Italica)以其独特的生殖器官花球为商品和食用器官,含有多种维生素、矿物质、粗纤维等,特别是富含莱菔硫烷,具有防癌、抗癌功效。我国是花菜生产大国,也是花菜消费大国。然而,在我国花菜栽培历史中,其生产用种主要依赖于国外进口。目前生产中青花菜用种90%以上仍然为进口,种子价格奇高。
种子纯度是评价种子质量的关键,在大面积种植之前快速准确地鉴定种子质量,是非常关键和必要的步骤[2]。传统的种子纯度鉴定方法是以播种后植株的田间形态观察为依据,其周期长、工作量大,且易受环境、季节因素影响。因此,开发快速、准确的种子纯度鉴定方法已成为种子科研单位和企业急需解决的问题。随着分子标记技术的发展,该技术已经在花菜类品种纯度鉴定中得到应用,具有快速、准确、稳定、安全、不受环境因素影响等优点。其中,SSR 标记具有操作简便和稳定可靠等优点,加之具有大量的等位差异,多态性十分丰富,在杂交种子纯度检测中有广阔的应用前景。然而,在以往的研究中,为解决少数杂交种的纯度鉴定,往往需要进行大量的引物筛选工作,才能找到适合的鉴定引物[3]。确定一套适于纯度鉴定的核心引物,并构建品种纯度鉴定体系,对花菜类种子的纯度鉴定至关重要。有了核心引物就不再需要进行繁琐的引物筛选,即使对未知品种,也只需进行少量的筛选,就能迅速找到合适的鉴定引物[4]。本研究通过对70 个花椰菜和青花菜材料的DNA 指纹分析,确定适于花菜类杂交种纯度鉴定的核心引物,构建了花菜类杂交种纯度鉴定 体系。
1 材料与方法
1.1 试验材料试验材料选取F1材料70 份,其中青花菜栽培品种22份,花椰菜47份,西兰苔1份(表1),2020 年8 月在云南省农业科学院热区生态农业研究所基地种植,采样后于-80℃保存备用。
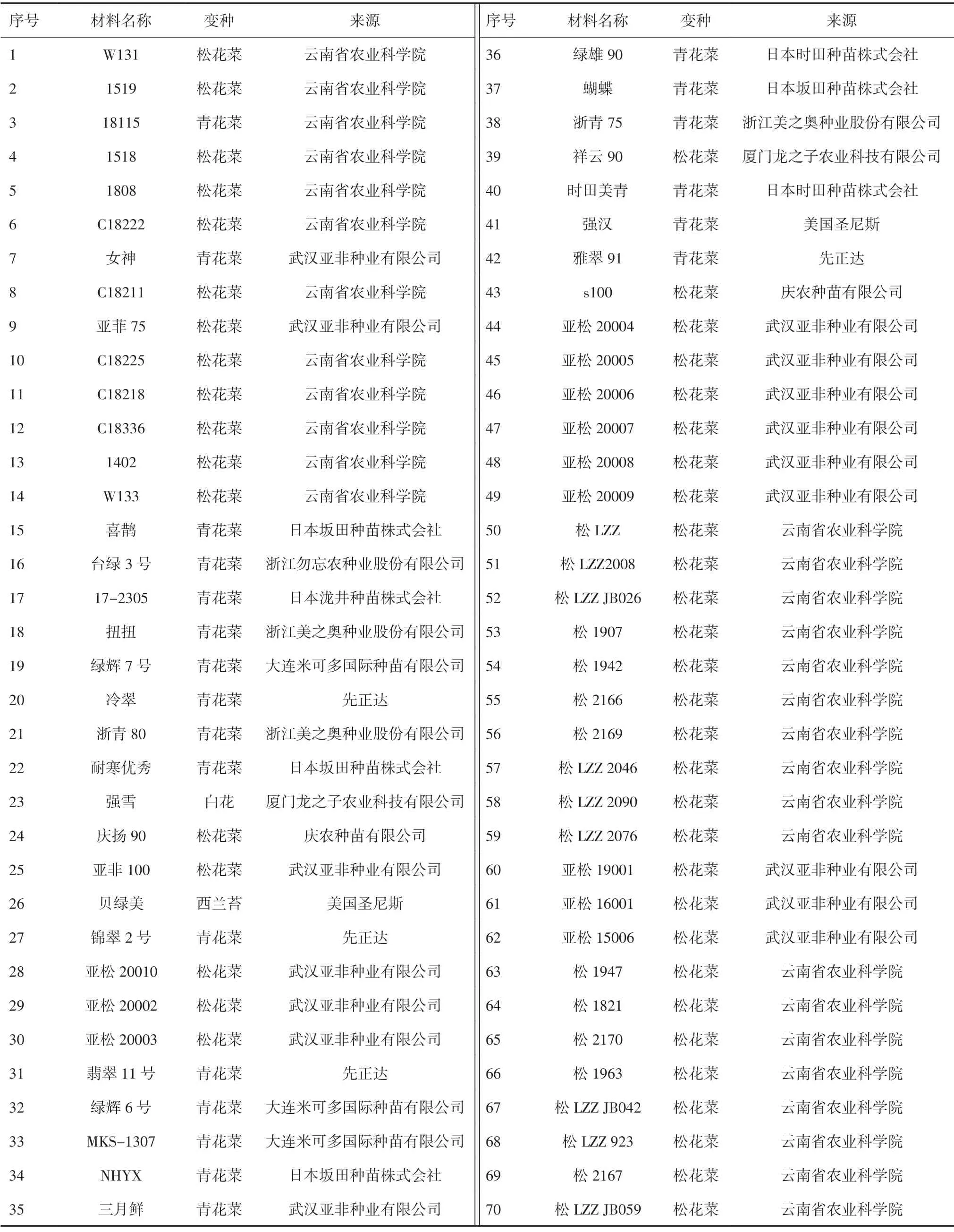
表1 70 份供试材料的基本信息
1.2 试验方法
1.2.1 全基因组DNA 提取以改良CTAB 法[5]提取全基因组DNA,获得的全基因组DNA 用1%琼脂糖凝胶电泳检测浓度并保存备用。
1.2.2 SSR 引物依据前人研究公布的甘蓝类SSR标记[6-8],合成引物100 对,经过初筛,在每条染色体上选择1~3 对引物,共选择22 对引物进行荧光标记,用于遗传多样性检测,引物详细信息见表2。
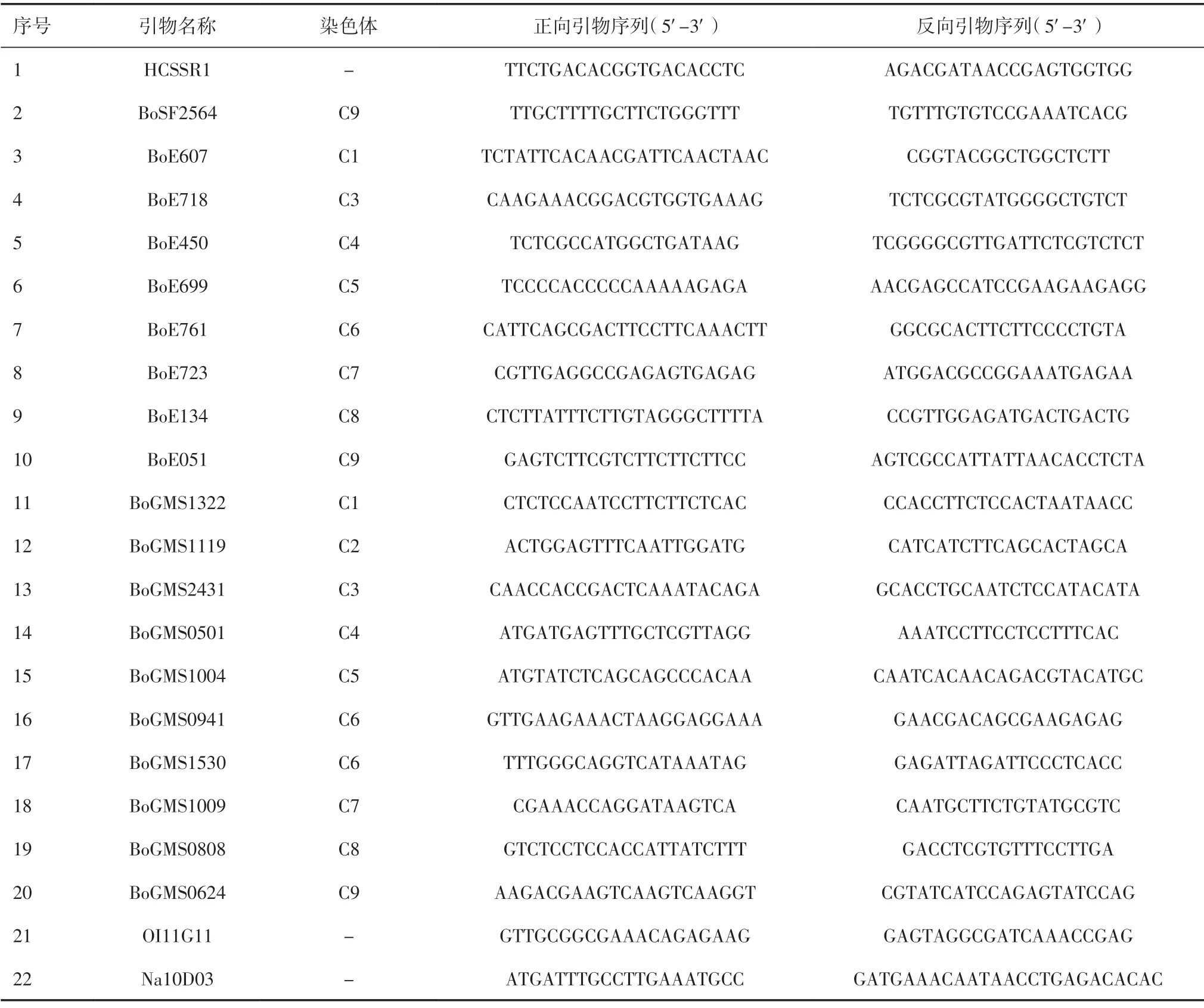
表2 22对SSR 引物
1.2.3 标记筛选采用22 对荧光引物对70 个杂交种全基因组DNA 进行扩增,PCR 总反应体系为10μL:5μL 2×mix 混合液、0.3μL 10μmol/L 正向引物、0.3μL 10μmol/L 反向引物,1μL 样品DNA,3.4μL 超纯水。扩增程序为94 ℃预变性5min;94℃变性45s,55℃退火45s,72℃延伸1min,循环30 次;72℃延伸10min,4℃保存。引物及试剂均由北京擎科生物有限公司提供。扩增产物在毛细管荧光电泳系统AB 3730XL DNA 分析仪(Applied Biosystems,USA)上检测。
用GeneMapper Ver.3.7(Applied Biosystems,USA)对原始数据进行统计和校正,读出每个样品各位点的等位变异片段大小数据。由于花菜是二倍体,以及SSR 标记的共显性特征,供试品种在每个引物位点上的基因型用X/X(纯合)、X/Y(杂合)记录,其中X、Y 为该位点上两个不同的等位变异片段大小,小片段在前,大片段在后。无效等位变异的大小记录为0/0。
评估引物多态性高低的指标用多态性信息含量(PIC,polymorphism information content),评 估 引物位点杂合程度的指标用杂合率[3]。
1.2.4 分子标记有效性验证随机选取2 个花菜杂交组合,分别提取父母亲本、F1的DNA,并用筛选出的纯度检测核心SSR 分子标记进行检测,以评价所筛选出的核心SSR 分子标记的有效性。
2 结果与分析
2.1 纯度鉴定核心引物的筛选利用22 对SSR 引物建立了70 个花菜类杂交种的DNA 指纹图谱,根据图谱数据统计分析引物的基因频率、基因分布信息及多态性和杂合率表现。由表3 可知,在这70 份材料中,73%的引物位点的实际基因型数小于理论基因型数。多态性信息含量(PIC)的变化范围为0.05~0.69,平均为0.43。根据衡量基因变异程度高低的多态性信息量指标[9],当PIC ≥0.50 时,该引物为高度多态性信息引物;当0.25 ≤PIC <0.50 时为中度多态性信息引物;当PIC <0.25 时为低度多态性信息引物。22 对引物中有9 对高度多态性信息引物,9 对中度多态性信息引物,4 对低度多态性信息引物。杂合率的变化范围为0~0.72,平均杂合率为0.36,表明这些杂交种遗传背景狭窄,集中在几个骨干亲本的血缘关系上。
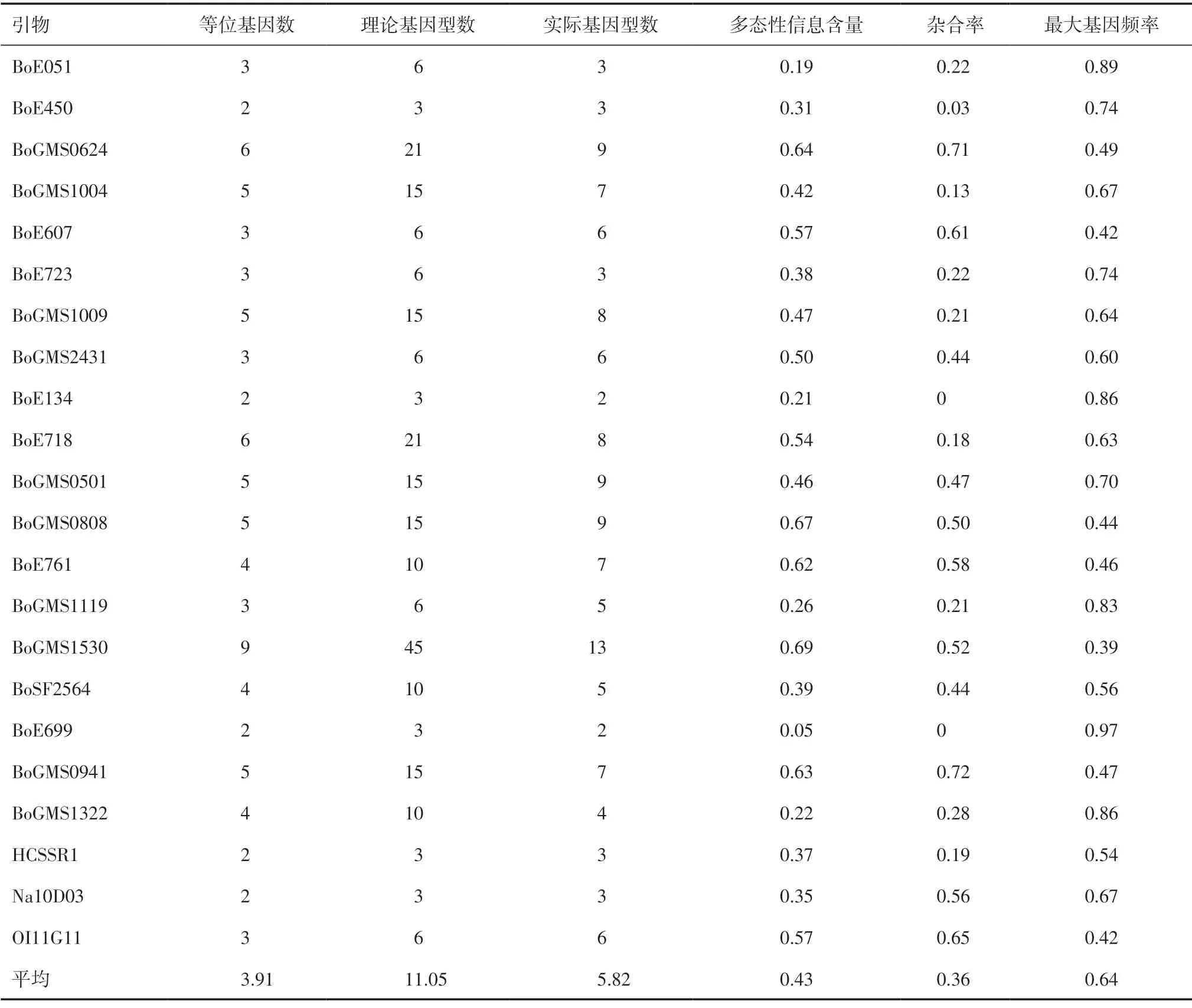
表3 22 对SSR 引物检测到的遗传多样性信息
根据王凤格等[3]提出的核心引物的筛选原则,把引物分为3 类:第1 类为多态性高,且杂合率高的引物,包括BoGMS0624、BoGMS0941 和OI11G11;第2 类为多态性高或中,且杂合率高或中的引物,如BoE607、BoE761、BoGMS2431、BoGMS0808 和BoGMS1530;其余引物归为第3 类,多态性低或中,且杂合率低。
70 个杂交种中有68 个可以用BoGMS0624、BoGMS0941 和OI11G11 3 个引物找到杂合带型,只有2 个品种(W131 和亚松20003)不具有杂合带型,所以这3 个引物可作为花菜纯度鉴定的核心引物。
2.2 花菜纯度鉴定特异引物的确定表4 汇总了引物的最低频率基因型,有22 个基因型仅出现一次,其中亚松20002 有2 个位点的基因型仅出现一次,最低频率为0.014(1/70)。根据王凤格等[3]对特异引物的定义,在指定品种范围内,利用某一引物检测,指定品种的杂合基因型表现唯一,或者依据引物的基因频率表,当预测基因型频率低于一定数值时,可将该引物视为该品种的特异引物。在本研究中有21 个品种具有特异性引物,但并不是所有的特异性引物都可为纯度鉴定所用。如松1963 在BoGMS0624 位点的基因型327bp/335bp,在70 个品种中仅出现一次,且为杂合基因型,实际基因型频率为0.014,但是其理论基因型频率为0.039,即还有可能出现相同带型的品种,该引物可用于鉴定松1963自交苗,但是不能用于异型株的鉴定,也就不能作为松1963的特异引物使用。在21 个品种中有8 个品种的实际基因型频率小于理论基因型频率,这些基因型的引物不能作为纯度鉴定特异引物使用。此外,雅翠91(252bp/252bp)、贝绿美(254bp/254bp)和亚松20003(368bp/368bp)3 个基因型为纯合基因型,这些位点也不适合作为纯度鉴定特异引物。因此,本研究共筛选出浙青75、浙青80、蝴蝶等11 个品种(图4 最后一列加粗品种)的纯度鉴定特异引物,可以用于这些品种纯度快速检测。
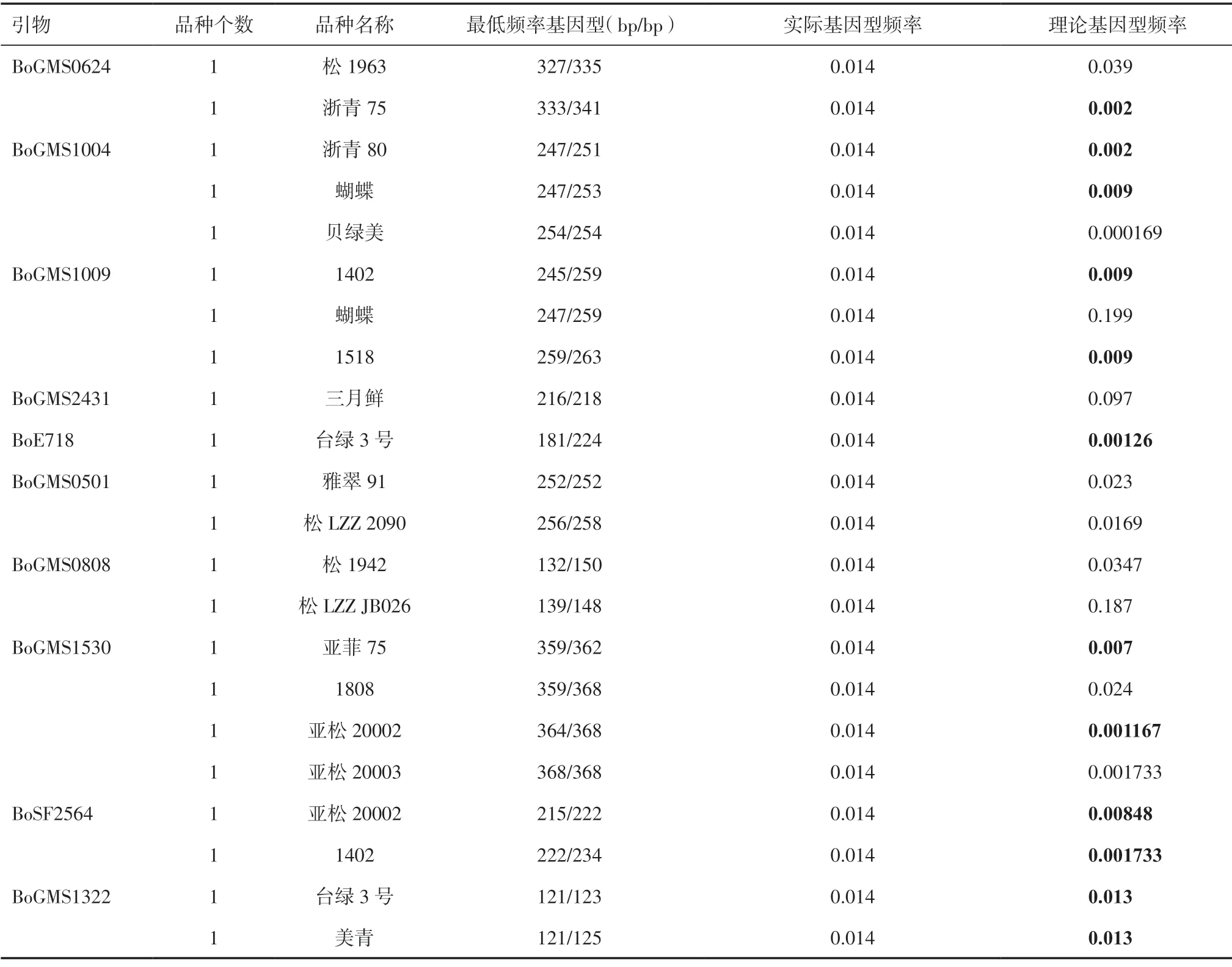
表4 具有最低基因型频率的基因型
2.3 花菜纯度鉴定核心引物的有效性验证采用筛选出的3 个纯度检测核心SSR 分子标记对随机选取的2 个花菜杂交组合(MS048-1-2×C18232、MS048-1-2×C18199)的父母亲本、F1的DNA 进行检测。结果显示,2 个杂交组合都从核心引物中筛选到了互补型条带。如图1 所示,A 中为杂交 组 合MS048-1-2×C18232 及F1(松1821)在BoGMS0941 引物的扩增条带,a1 为母本MS048-1-2(234bp),a2 为父本C18232(224bp),a3 为F1出现了父母本的2 个互补条带(224bp/234bp)。B 中为杂交组合MS048-1-2×C18199 及F1(松1963)在OI11G11 引物的扩增条带,b1 为母本MS048-1-2(129bp),b2 为父本C18199(154bp),b3 为F1出现了父母本的2 个互补条带(129bp/154bp)。
3 结论与讨论
SSR 标记技术可以通过检测待鉴定样品是否具有某一品种的基因特异片段来辨别其真伪,从而对种子纯度进行检测,具有快速、准确、稳定、安全、不受环境因素影响等优点。目前,SSR 标记已被广泛应用于水稻、棉花、玉米等作物的杂交种纯度鉴定。本研究中引物的实际基因型数普遍低于理论基因型数,多态性较低,平均PIC 值为0.43,杂合率也不高,平均杂合率为0.36,揭示了目前花菜的遗传背景狭窄,主要集中在几个骨干亲本。这增加了杂交种的区分难度,也不利于杂交种纯度 检测。
杂交种纯度鉴定一是检测母本自交、父本误收因素造成的杂交种混杂,二是鉴定由异源花粉污染或机械混杂等造成的异型株。检验自交苗时需1 对双亲互补型引物,再利用特异引物或引物组合检验异型株。引物杂合率高,更容易筛选到双亲互补型引物用于检验自交苗;引物多态性高,可降低相同带型出现频率,有利于区分异型株。本试验筛选出了3 个共显性SSR 标记BoGMS0624、BoGMS0941 和OI11G11,作为花菜品种纯度检测的核心引物。这3个引物杂合率高,97%的品种均可以找到具有杂合带型的引物,满足检验自交苗的需要,且这3 个引物多态性高,具有较高的验杂能力。因此,这3 个引物可以推荐作为纯度鉴定的首选核心引物。其他5 个中等表现的引物BoE607、BoE761、BoGMS2431、BoGMS0808 和BoGMS1530 可作为纯度鉴定的备选引物,补充解决上述3 个引物不能鉴定的品种。目前已有的研究多是针对特定品种的纯度鉴定引物筛选[10],从核心引物中选择合适的引物用于特定品种的纯度鉴定,极大地缩减了工作量,提高了检测效率,降低了检测成本。此外,本研究共筛选出浙青75、浙青80、蝴蝶等11 个品种的纯度鉴定特异引物,不仅可鉴别自交株,还可鉴别异形株,大大加快了纯度检测速度。

