黄芩素对2,4,6-三硝基苯磺酸诱导的小鼠实验性肠炎的作用和机制
罗晓平,于之伦,邓超,张晶晶,王峥涛,窦薇(上海中医药大学中药研究所,中药标准化教育部重点实验室暨上海市复方中药重点实验室,上海201203)
黄芩素对2,4,6-三硝基苯磺酸诱导的小鼠实验性肠炎的作用和机制
罗晓平,于之伦,邓超,张晶晶,王峥涛,窦薇(上海中医药大学中药研究所,中药标准化教育部重点实验室暨上海市复方中药重点实验室,上海201203)
目的 探讨黄芩素对2,4,6-三硝基苯磺酸(TNBS)诱导的小鼠肠炎实验模型的作用及机制。方法将BALB/c小鼠随机分成3组(n=10):正常对照组、模型组(TNBS)和黄芩素组(TNBS+黄芩素20 mg·kg-1)。黄芩素组于造模前2 d ig给予黄芩素,每天1次,共9 d。测量结肠长度,并取结肠组织进行HE染色,进行组织损伤和炎症细胞浸润评分;ELISA测定结肠组织中肿瘤坏死因子α(TNF-α)含量。体外制备细菌脂多糖(LPS)诱导的RAW264.7炎症细胞模型,黄芩素(10,25和50 mmol·L-1)给药干预,Griess试剂法测定上清中一氧化氮(NO)含量;荧光定量PCR检测炎症介质TNF-α、白细胞介素6(IL-6)、IL-1β、诱导型NO合酶(iNOS)、环氧合酶2(COX-2)和单核细胞趋化蛋白1(MCP-1)mRNA表达;Western蛋白印迹法检测磷脂酰肌醇3-激酶/蛋白激酶B/NF-κB(PI3K/AKT/NF-κB)通路磷酸化蛋白(p-PI3K,p-AKT,p-p65和p-IκBa)表达。结果 与正常对照组相比,模型组小鼠结肠缩短,组织病理损伤,炎症细胞浸润,组织TNF-α含量增高;黄芩素给药组上述症状得到显著改善(P<0.05)。与细胞对照组相比,LPS模型组细胞NO分泌、炎症介质(TNF-α,IL-6,IL-1β,iNOS,COX-2和MCP-1)mRNA表达及PI3K/AKT/NF-κB通路磷酸化蛋白表达均增高(P<0.05,P<0.01);与模型组比较,黄芩素给药组上述指标均降低(P<0.05,P<0.01)。结论黄芩素可减轻TNBS诱导的小鼠实验性肠炎的症状,作用机制可能与抑制PI3K/AKT/NF-κB通路的激活从而抑制炎症介质的表达和减少炎症因子释放有关。
肠炎;磷脂酰肌醇3-激酶;蛋白激酶B;NF-κB;黄芩素
DOl:10.3867/j.issn.1000-3002.2017.06.007
克罗恩病(Crohn′s disease,CD)和溃疡性结肠炎是炎症性肠病(inflammation bowel disease,IBD)的2种主要类型。CD是贯穿肠壁各层的炎性病变,可侵犯肠系膜和局部淋巴结,病程缓慢,易复发,其发病机制迄今尚不明确[1]。临床主要表现为腹痛、腹泻、瘘管形成及肠梗阻。目前CD治疗药物以西药为主,有氨基水杨酸类、免疫抑制剂、糖皮质激素、抗生素和生物制剂〔如抗肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)单克隆抗体〕等[2-3]。西药在控制病情方面疗效明显,但副作用大,停药易复发,不宜长期使用。因此,从天然产物中寻找安全有效的治疗药物是目前CD研究的热点[4]。
2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)灌肠是一种国际通用的CD造模方法,该实验模型的重复性好,各项病理指标均接近人类CD,因此在CD药物研究中被广泛应用[5]。大量研究表明,NF-κB在TNBS诱导的CD小鼠肠炎实验模型及CD患者体内呈现过度激活现象,导致TNF-α和白细胞介素(interleukin,IL)-1β等细胞因子的持续过度表达[6-8]。磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)是一个保守的信号转导酶家族。据报道,PI3K通过磷酸化下游丝氨酸/苏氨酸蛋白激酶B(protein kinase B,AKT),使NF-κB抑制子α(inhibitor of NF-κB-α,IκBα)发生磷酸化和降解,继而激活NF-κB,引起炎症细胞因子的转录[9]。
黄芩素属于黄酮类化合物,是黄芩根中的主要活性成分,具有抑菌、抗病毒、抗炎、抗氧化、降脂和抗癌等多种药理活性,常用于治疗炎症、心血管疾病、微生物感染等[10]。目前,有关黄芩素对CD小鼠实验性肠炎的作用及其机制尚未见报道。本研究观察黄芩素对TNBS诱导的CD小鼠肠炎实验模型的作用,并借助RAW264.7炎症细胞模型,探讨PI3K/AKT/ NF-κB信号通路是否参与了这一过程。
1 材料与方法
1.1 药物和试剂
黄芩素(纯度≥98%,编号xw080047)和羧甲纤维素钠(CMCNa,批号:F20110915)购于国药集团有限公司;TNBS(P2297);细菌脂多糖(lipopolysaccharide,LPS,L4130)购于西格玛奥德里奇(上海)贸易有限公司;胰酶、高糖DMEM和胎牛血清购自美国Gibco公司;Trizol和DMSO购于美国Invitrogen公司;反转录试剂盒及荧光定量PCR试剂盒购于日本TaKaRa公司;TNF-α和一氧化氮(nitric oxide,NO)检测试剂盒购于南京建成试剂公司;以下抗体均购自于美国CST公司:兔抗小鼠NF-κB p65单克隆抗体(#8242),兔抗小鼠磷酸化(p)-p65单克隆抗体(#3033),兔抗小鼠IκBα单克隆抗体(#4812),兔抗小鼠p-IκBα单克隆抗体(#2859),兔抗小鼠p-AKT单克隆抗体(#4060),兔抗小鼠PI3K多克隆抗体(#4292)及兔抗小鼠p-PI3K p85多克隆抗体(#4228)和小鼠抗人AKT单克隆抗体(#2920)。
1.2 CD小鼠肠炎实验模型的建立和给药
BALB/c小鼠(6~8周龄,18~22 g)30只,雌雄各半,由上海中医药大学实验动物中心提供,动物合格证号:SYXK(沪)2014-0008,SPF级环境饲养。小鼠随机分成3组,正常对照组、模型组(TNBS)和黄芩素给药组,每组10只。参照本课题组前期研究结果[11]确定黄芩素给药剂量为20 mg·kg-1,超声溶解于质量体积比0.5%的CMCNa。小鼠适应性饲养1周,参照国际公认的造模方法[5-6],TNBS与无水乙醇(1∶1)混匀制成灌肠剂,ip给予1%戊巴比妥钠(10 mL·kg-1)麻醉小鼠后,用圆头灌肠针给小鼠灌肠,倒置小鼠30 s,使灌肠剂完全留在结肠内直至实验结束。黄芩素给药组在造模前2 d开始每天ig给予黄芩素直至实验结束,共计9 d,其他2组ig等体积CMCNa。
1.3 样本收集和组织病理损伤评分
实验结束后麻醉并处死小鼠,剖取新鲜全结肠,测量长度,沿肠系膜纵轴剪开肠腔,用生理盐水洗净。取结肠末端靠近肛门处1 cm组织于4%甲醛中固定48 h,进行脱水、石蜡包埋、病理切片、HE染色,光镜下观察组织病理学变化并进行病理损伤评分,组织病理评分标准参照课题组的前期报道[3,6]:①炎症细胞的渗出评分标准(0分,黏膜固有层内有极少量炎症细胞;1分,黏膜固有层内的炎症细胞增多;2分,炎症细胞扩散至黏膜下层;3分,全层均有炎症细胞渗出);②组织损伤评分标准(0分,无黏膜损伤;1分,非连续的黏膜上皮损坏;2分,表层黏膜糜烂;3分,广泛的黏膜破损并向肠壁深层扩展)。将炎症细胞的渗出和组织损伤评分相加,计算出组织病理评分(1~6分)。
1.4 结肠组织TNF-α含量测定
采用双抗体夹心ELISA试剂盒方法,检测结肠组织中TNF-α含量。取结肠组织50 mg,于预冷生理盐水中匀浆,4℃低温2800×g离心15 min,参照试剂盒方法检测上清TNF-α含量。
1.5 细胞和细胞培养
RAW264.7小鼠腹腔巨噬细胞由中国科学院上海细胞所提供,用高糖DMEM培养基(含FBS 10%、链霉素100 mg·L-1和青霉素100 U·L-1)培养于37℃,5%CO2培养箱,2 d换液1次。取对数期细胞接种于6孔板,每组3复孔,铺板24 h后待细胞完全贴壁,分组如下:细胞对照组、LPS模型组(LPS,1 mg·L-1)和黄芩素组(LPS+黄芩素10,25和50 mmol·L-1)。黄芩素处理2 h,加LPS继续处理22 h。
1.6 反转录荧光定量PCR检测NF-κB mRNA水平
细胞培养及处理条件同1.5,处理结束后,用Trizol试剂提取总RNA并定量。按TaKaRa逆转录试剂盒说明书,取1 μg RNA做反转录。采用SYBR Green PCR扩增试剂,在ABI 7300荧光定量PCR仪上进行PCR扩增和检测。引物设计根据标准荧光定量PCR引物设计原则,用Primer 5.0软件设计引物,并用Blast程序进行验证,引物由上海捷瑞生物工程有限公司合成(表1)。PCR反应条件为95℃1 min预变性,95℃5 s变性,60℃34 s退火,共40个循环。每次扩增设置β肌动蛋白基因为内参照,用PCR仪自带软件进行荧光定量分析,得出Ct值,统计2-△△Ct值比较各组mRNA表达水平。
1.7 Western蛋白印迹法检测Pl3K/AKT/NF-κB通路蛋白磷酸化水平
去除培养上清,用预冷的PBS洗涤3次,每孔加入300 μL预冷的蛋白裂解液,冰上反应30 min刮取细胞至1.5 mL EP管,12 000×g离心15 min,用BCA蛋白定量试剂盒测蛋白浓度,10%SDSPAGE凝胶电泳分离蛋白,然后转移至浸泡过甲醇的PVDF膜上,脱脂牛奶室温封闭1 h后,用一抗(均为1∶1000稀释,β肌动蛋白1∶2000稀释)于4℃孵育过夜。PBST缓冲液洗膜3次后,与标记有HRP的二抗(1∶5000)共孵1 h,ECL显影。用Quantity One Software(Bio-Rad Laboratories,USA)对蛋白质条带进行积分吸光度(integrated absorbance,IA)分析。待测蛋白相对表达水平用IA目标蛋白/IAβ肌动蛋白的比值表示。
1.8 细胞培养上清一氧化氮含量的测定
细胞培养及药物处理同1.5,吸取80 μL 96孔板培养上清液,与80 μL Griess试剂混合,酶标仪检测540 nm处吸光度(A540nm),表示NO的生成量。
1.9 统计学分析
实验结果 数据以x±s表示,采用SPSS 18.0统计软件对实验数据进行统计分析,采用GraghPad Prism单因素方差分析(one-way ANOVA)及LSD检测。P<0.05认为差异具有统计学意义。
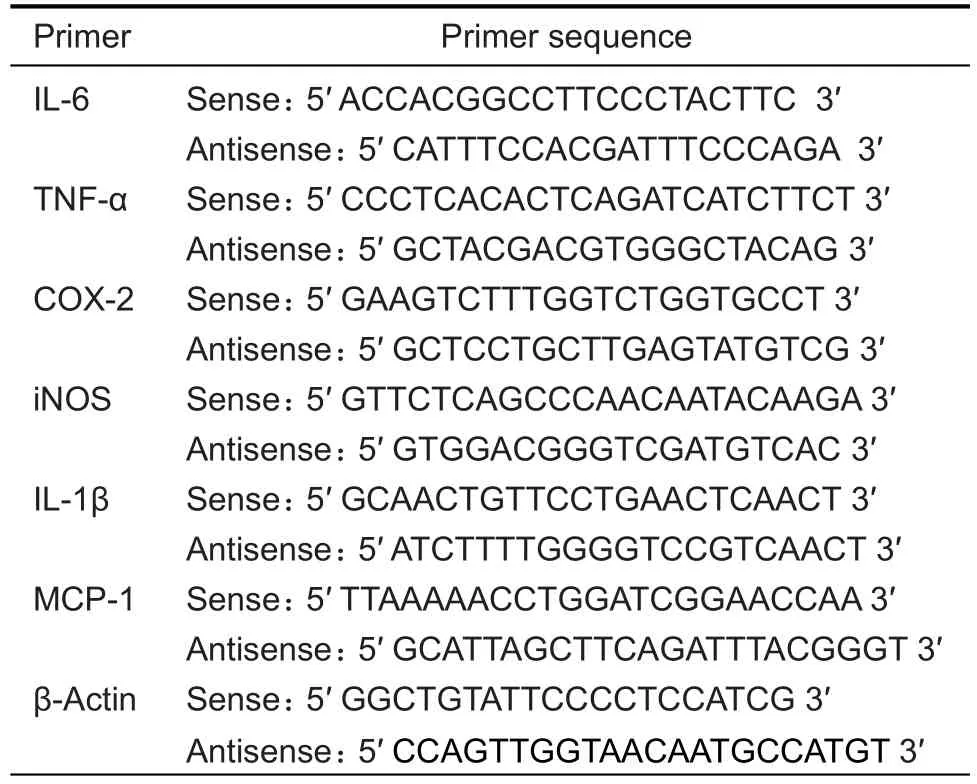
Tab.1 Primer sequence for RT-PCR
2 结果
2.1 黄芩素对TNBS模型小鼠结肠组织病理变化的影响
正常对照组小鼠结肠黏膜组织结构完整,未见炎症细胞浸润;TNBS模型组小鼠结肠黏膜组织结构紊乱,大量炎症细胞浸润;黄芩素给药组可见紊乱的黏膜组织结构得到修复,炎症细胞浸润减轻(图1A)。病理损伤评分结果 显示,黄芩素组显著低于模型组(P<0.05)(图1B)。与正常对照组相比,模型组小鼠结肠呈现水肿、毛细血管扩张、结肠长度缩短,黄芩素组上述症状显著减轻(图1C和D)。
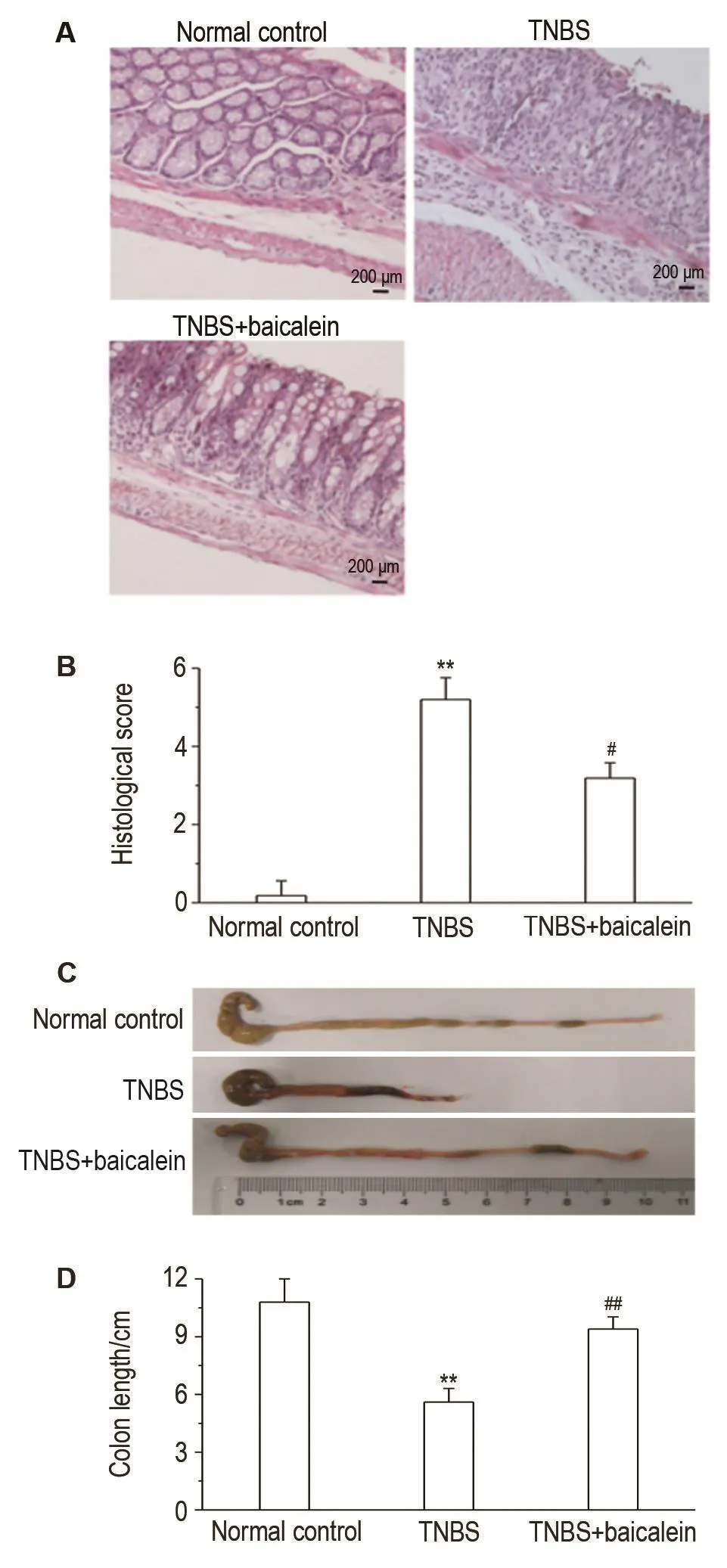
Fig.1Effect of baicalein on morphology of colon tissue(A,B)and colon length(C,D)of mice with colitis induced by trinitro-benzene-sulfonic acid(TNBS)(HE stainning).Colitis model mice were induced by TNBS(2 mg in 100 μL of 50%ethanol,intrarectally administered).Baicalein 20 mg·kg-1was ig given once a day for 2 d prior to TNBS administration for 9 d.x±s,n=10.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with TNBS group.
2.2 黄芩素对TNBS模型小鼠结肠组织TNF-α含量的影响
与正常对照组相比,TNBS模型组小鼠结肠黏膜组织TNF-α含量显著升高(P<0.01);与TNBS模型组比,黄芩素组结肠组织TNF-α含量显著下降(P<0.01)(图2)。
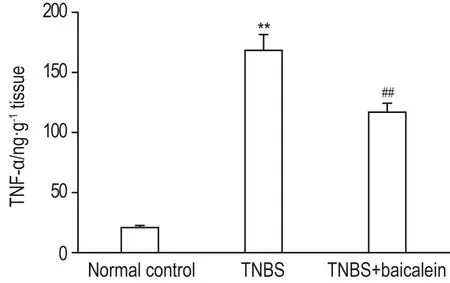
Fig.2 Effect of baicalein on level of TNF-α in colon tissue of TNBS-induced colitis mice by ELlSA.See Fig.1 for the treatment.x±s,n=4.**P<0.01,compared with normal control group;##P<0.01,compared with TNBS group.
2.3 黄芩素对LPS诱导RAW264.7细胞NO释放的影响
与细胞对照组相比,LPS刺激的RAW264.7细胞上清中NO的含量显著升高(P<0.01),加入黄芩素10,25和50 mmol·L-1后,可抑制LPS刺激的RAW264.7细胞NO的分泌(图3)。
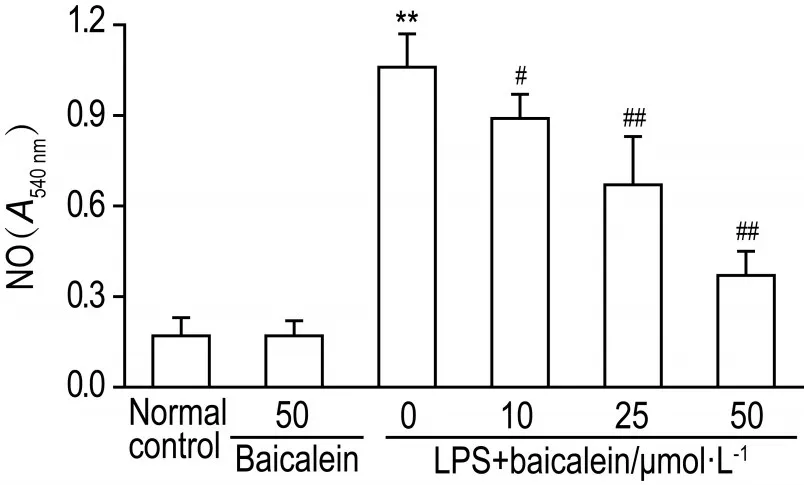
Fig.3 Effect of baicalein on nitric oxide(NO)production in lipopolysaccharide(LPS)-stimulated RAW264.7 cells by ELlSA.Cells were incubated with baicalein(10,25 and 50 μmol·L-1)for 2 h and then treated with LPS 1 mg·L-1for 22 h.x±s,n=4.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with LPS group.
2.4 黄芩素对LPS诱导RAW264.7细胞NF-κB靶基因mRNA水平的影响
与细胞对照组相比,LPS刺激后NF-κB通路下游COX-2,iNOS,MCP-1,TNF-α,IL-1β和IL-6 mRNA表达水平均明显升高(P<0.01),黄芩素10,25和50 mmol·L-1可抑制LPS诱导的上述mRNA的表达(P<0.05,P<0.01)(图4)。
2.5 黄芩素对LPS诱导RAW264.7细胞Pl3K/ AKT/NF-κB通路蛋白磷酸化的影响
与细胞对照组相比,LPS诱导后PI3K/AKT/ NF-κB通路蛋白PI3K p85,AKT,p65和IκBa的磷酸化水平显著升高(P<0.01);加入黄芩素10,25和50 mmol·L-1后,可抑制LPS诱导的PI3K/AKT/ NF-κB通路蛋白的磷酸化(图5)。
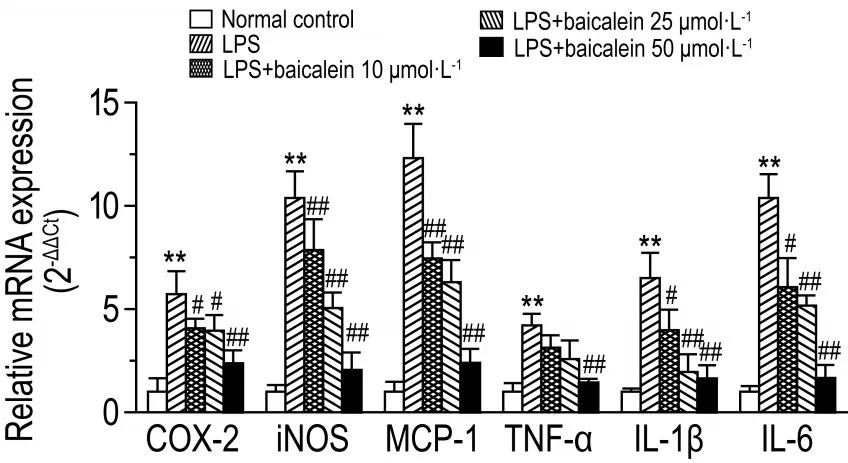
Fig.4 Effect of baicalein on mRNA expression of NF-κB target genesin LPS induced RAW264.7 cells by qRT-PCR.See Fig.3 for cell treatment.x±s,n=6.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with LPS group.
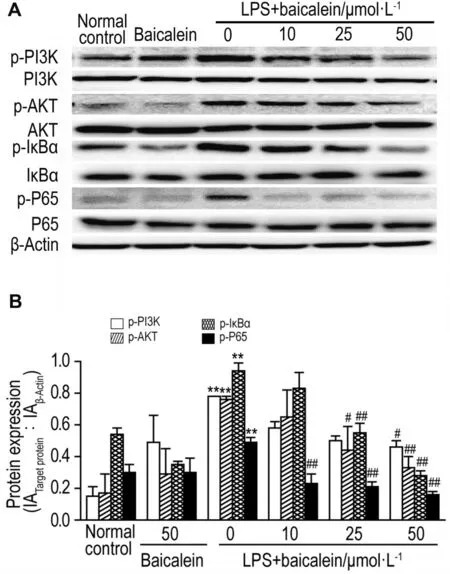
Fig.5 Effect of baicalein on signaling molecules of Pl3K/AKT/NF-κB pathway in LPS induced RAW264.7 cells by Western blotting.See Fig.3 for cell treatment.B was semi-quantitative results of A.x±s,n=6.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with LPS group.
3 讨论
本研究显示,TNBS造模后小鼠结肠组织为典型的黏膜炎症表现;黄芩素给药后,组织病理损伤、炎症细胞浸润和结肠缩短症状得到改善。此外,TNBS造模引起小鼠结肠组织TNF-α含量升高,黄芩素给药可显著抑制TNBS引起的小鼠结肠组织TNF-α含量升高。本研究发现,黄芩素对TNBS诱导的CD小鼠肠炎实验模型具有改善作用,其作用机制可能与抑制PI3K/AKT/NF-κB通路的激活,从而抑制炎症介质基因的表达和减少炎症因子释放有关。
PI3K/AKT信号通路的活化在细胞增殖、分化和凋亡等过程中发挥重要作用[12]。PI3K是由一个P110催化亚基和一个P85调节亚基组成的异源二聚体,活化后能将磷脂酰肌醇二磷酸转变为磷脂酰肌醇三磷酸[13]。磷脂酰肌醇三磷酸通过与AKT的pH结构域结合,磷酸化激活AKT,并将AKT从细胞质招募到细胞膜上。活化的AKT能够通过活化IκB激酶使NF-κB抑制子IκB发生磷酸化和降解,从而使NF-κB从细胞质中释放出来进入细胞核,激活靶基因的转录[13]。受NF-κB调控的靶基因主要是一些细胞因子(如TNF-α和IL-1β)及炎症相关的化学因子、趋化因子等(如MCP-1和COX-2)[3]。
巨噬细胞是血液和淋巴液中的吞噬细胞,在炎症反应和细胞免疫中发挥重要作用。以LPS刺激RAW264.7小鼠巨噬细胞作为体外炎症细胞模型,可以诱导细胞产生多种炎症介质,引起炎症反应。因此,此模型被广泛用于抗炎药物的筛选和评价[14]。已有研究表明,LPS可引起RAW264.7细胞PI3K/AKT/NF-κB通路的激活,导致前列腺素2水平和COX-2表达的上调[9]。另据报道,TNBS造模可引起结肠组织PI3K/AKT/NF-κB通路的激活,导致TNF-α和IL-1β表达的上调[13]。本研究结果 显示,黄芩素可显著抑制LPS诱导的RAW264.7细胞PI3K/AKT/NF-κB通路的激活,抑制NO的合成,下调iNOS、MCP-1,COX-2,TNF-α,IL-1β和IL-6 mRNA的表达。提示通过阻断PI3K/AKT/NF-κB通路的激活,抑制炎症介质的表达也许是有效改善结肠黏膜炎症损伤的一个重要途径。
本课题组曾报道,黄芩素对溃疡性结肠炎小鼠模型有保护作用,其作用机制与尾型同源异形盒蛋白2/孕烷X受体(caudal type homeobox 2/pregnane X receptor,CDX2/PXR)信号通路有关[11]。结合本研究结果 提示,应进一步探讨黄芩素对CD小鼠肠炎实验模型CDX2/PXR信号通路的影响。本研究为黄芩素的进一步药理学研究和开发提供实验依据。
[1]van der Marel S,Majowicz A,van Deventer S,Petry H,Hommes DW,Ferreira V.Gene and cell therapy based treatment strategies for inflammatory bowel diseases[J].World J Gastrointest Pathophysiol,2011,2(6):114-122.
[2]Kelley KA,Kaur T,Tsikitis VL.Perianal Crohn′s disease:challenges and solutions[J].Clin Exp Gastroenterol,2017,10:39-46.
[3]Ren G,Sun A,Deng C,Zhang J,Wu X,Wei X,et al.The anti-inflammatory effect and potential mechanism of cardamonin in DSS-induced colitis[J].Am J Physiol Gastrointest Liver Physiol,2015,309(7):G517-G527.
[4]Jobin C.Probiotics and ileitis:could augmentation of TNF/NFκB activity be the answer?[J].Gut Microbes,2010,1(3):196-199.
[5]Goyal N,Rana A,Ahlawat A,Bijjem KR,Kumar P. Animal models of inflammatory bowel disease:a review[J].Inflammopharmacology,2014,22(4):219-233.
[6]Zhang J,Ding L,Wang B,Ren G,Sun A,Deng C,et al.Notoginsenoside R1 attenuates experimental inflammatory bowel disease via pregnane X receptor activation[J].J Pharmacol Exp Ther,2015,352(2):315-324.
[7]Arsenescu R,Bruno ME,Rogier EW,Stefka AT,McMahan AE,Wright TB,et al.Signature biomarkers in Crohn's disease:toward a molecular classification[J].Mucosal Immunol,2008,1(5):399-411.
[8]Li C,Xi Y,Li S,Zhao Q,Cheng W,Wang Z,et al.Berberine ameliorates TNBS induced colitis by inhibiting inflammatory responses and Th1/ Th17 differentiation[J].Mol Immunol,2015,67(2 Pt B):444-454.
[9]Zha L,Chen J,Sun S,Mao L,Chu X,Deng H,et al.Soyasaponins can blunt inflammation by inhibiting the reactive oxygen species-mediated activation of PI3K/Akt/NF-κB pathway[J].PLoS One,2014,9(9):e107655.
[10]Zhang HB,Lu P,Guo QY,Zhang ZH,Meng XY. Baicalein induces apoptosis in esophageal squamous cell carcinoma cells through modulation of the PI3K/Akt pathway[J].Oncol Lett,2013,5(2):722-728.
[11]Dou W,Mukherjee S,Li H,Venkatesh M,Wang H,Kortagere S,et al.Alleviation of gut inflammation by Cdx2/Pxr pathway in a mouse model of chemical colitis[J].PLoS One,2012,7(7):e36075.
[12]Jin Y,Fan Y,Yan EZ,Yang J,Zong ZH,Qi ZM. Amyloid β-protein fragment 25-35 down-regulates PI3K/Akt/p70S6K pathway in rat hippocampus in vivo[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2007,21(2):90-98.
[13]Zhang CX,Guo LK,Guo XF.The expressions of Toll-like receptor4/NF-κB and PI3K/AKT/NF-κB signaling pathways in rat ulcerative colitis inducedby the combined enema of trinitrobenzene sulphonic acid and ethanol and the interventional effect of electroacupuncture on them[J].J Xi′an Jiaotong Univ(Med Sci)〔西安交通大学学报(医学版)〕,2015,36(2):263-270.
[14]Dou W,Zhang J,Ren G,Ding L,Sun A,Deng C,et al.Mangiferin attenuates the symptoms of dextran sulfate sodium-induced colitis in mice via NF-κB and MAPK signaling inactivation[J].Int Immunopharmacol,2014,23(1):170-178.
Effect and mechanism of baicalein on 2,4,6-trinitrobenzene sulfonic acid-induced experimental colitis of mice
LUO Xiao-ping,YU Zhi-lun,DENG Chao,ZHANG Jing-jing,WANG Zheng-tao,DOU Wei
(Ministry of Education Key Laboratory for Standardization of Chinese Medicine and Shanghai Key Laboratory of Complex Prescriptions,Institute of Chinese Materia Medica, Shanghai University of TCM,Shanghai 201203,China)
OBJECTlVETo explore the effect and mechanisms of baicalein on 2,4,6-trinitrobenzene sulfonic acid(TNBS)-induced experimental colitis in mice.METHODSBALB/c mice were randomly placed into three groups(n=10):normal control group,TNBS group,and TNBS+baicalein(20 mg·kg-1,once per day)group.Mouse colitis was induced by intrarectal injection of TNBS.Baicalein was administered by oral gavage two days prior to TNBS treatment and until the end of the study(a total of 9 d).The colon length was measured before HE staining was performed for histological damage assessment.The remaining colon pieces were collected to measure the content of tumor necrosis factor-α(TNF-α).Lipopolysaccharide(LPS)-stimulated RAW264.7 mouse macrophage was used as a cell model to determine the content of nitric oxide(NO)in cell culture medium,the mRNA levels of TNF-α,interleukin-6(IL-6),IL-1β, inducible nitric oxide synthase(iNOS),cyclooxygenase 2(COX-2)and monocyte chemoattractant protein-1 (MCP-1),and the protein expression of phosphatidylinositol 3-kinase/protein kinase B/nuclear factor-κB (PI3K/AKT/NF-κB)pathway.RESULTSBaicalein significantly attenuated TNBS-induced colon shortening and histological injury(P<0.05),which was correlated with the decline in the content of TNF-α in the colon. According to the in vivo results,baicalein exposure down-regulated the secretion of NO and the mRNA expression of pro-inflammatory mediators(iNOS,COX-2,MCP-1,TNF-α,IL-1β and IL-6)in LPS-stimulated RAW264.7 cells(P<0.05,P<0.01).Additionally,the phosphorylation/activation of LPS-stimulated PI3K/ AKT/NF-κB pathway was inhibited by baicalein treatment.CONCLUSlONThe beneficial effect of baicalein in TNBS-induced experimental colitis may be due to PI3K/AKT/NF-κB signaling inhibition.
colitis;phosphatidylinositol 3-kinase;protein kinase B;NF-κB;baicalein
The project supported by National Natural Science Foundation of China(81273572);and National Natural Science Foundation of China(81530069)
DOU Wei,E-mail:douwei123456@126.com,Tel:(021)51322498
R285
A
1000-3002(2017)06-0541-06
2017-02-21接受日期:2017-06-15)
(本文编辑:贺云霞)
国家自然科学基金(81273572);国家自然科学基金(81530069)
罗晓平,女,硕士研究生,主要从事分子药理学研究,E-mail:luoxpcq@163.com;窦薇,女,研究员,主要从事分子药理学研究。
窦薇,E-mail:douwei123456@126.com,Tel:(021)51322498

