没食子提取物对IgA肾病模型大鼠的治疗作用
李静,刘衍杰,桑晓红,王婷,刘健
(1.新疆医科大学第一附属医院肾病科,新疆乌鲁木齐830054;2.山东省淄博市中心医院泌尿内科,山东淄博255036;3.新疆医科大学附属中医医院肾病科,新疆乌鲁木齐830000)
没食子提取物对IgA肾病模型大鼠的治疗作用
李静1,刘衍杰2,桑晓红1,王婷3,刘健1
(1.新疆医科大学第一附属医院肾病科,新疆乌鲁木齐830054;2.山东省淄博市中心医院泌尿内科,山东淄博255036;3.新疆医科大学附属中医医院肾病科,新疆乌鲁木齐830000)
目的 研究没食子提取物(TGE)对IgA肾病(IgAN)模型大鼠血清、尿液及肾组织IgA表达的影响。方法50只健康雄性Sprague-Dawley大鼠随机分为正常对照组、IgAN模型组、TGE 75,150和300 mg·kg-1治疗组,每组10只。除正常对照组外,其余各组采用牛血清白蛋白(BSA)+脂多糖(LPS)+四氯化碳(CCl4)联合造模,持续12周。从第13周开始,ig给予TGE,正常对照组及IgAN模型组给予等量生理盐水,持续4周。第12周末及第16周末用BCA法测定24 h尿蛋白;第16周末,酶联免疫吸附法(ELISA)测定血清及尿液IgA水平,全自动生化分析仪检测血清肌酐(SCr)和尿素氮(BUN)水平,按牛津分型对肾组织病理进行评分,免疫荧光法测定肾组织IgA免疫复合物沉积。结果 与正常对照组相比,IgAN造模大鼠在12周末24 h尿蛋白升高(P<0.05);在16周末,IgAN模型组大鼠24 h尿蛋白、血清和尿液IgA水平、血清SCr和BUN水平、肾组织牛津病理评分和IgA沉积均较正常对照组升高(P<0.05);与IgAN模型组相比,TGE各给药组大鼠24 h尿蛋白、血清和尿液IgA水平以及血清SCr水平降低(P<0.05),TGE 150和300 mg·kg-1组血清BUN水平和肾组织IgA含量下降(P<0.05),仅TGE 300 mg·kg-1组牛津病理评分中有明显减少。结论TGE可减少IgAN模型大鼠血清、尿液及肾组织IgA水平,对IgAN具有一定程度的治疗作用。
没食子提取物;IgA肾病;IgA
IgA肾病(IgA nephropathy,IgAN)的发病机制尚未明确,与感染、免疫反应、炎症介质和遗传等多种因素有关[1]。目前,国内外对IgAN发病机制的研究主要围绕在各种原因引起异常糖基化IgA1的产生及其在肾小球系膜区的沉积,刺激系膜细胞和中性粒细胞等增殖,并产生释放多种细胞因子及炎症介质,进而引发炎症和肾小球损伤[2-3]。长期随访研究结果 表明,IgAN的发展过程成慢性进展性[4],免疫球蛋白IgA在其发病机制和发展中起到关键作用,有50%~70%的成人IgAN患者血清IgA水平升高[5-6]。因此,减少IgA表达沉积可能对延缓IgAN进展有一定意义。
没食子是新疆维吾尔常用药,具有收敛、消炎、止血和固涩作用[7-8],抑制主要致龋菌[9]和清除自由基等作用[10]。但是没食子提取物(Turkish galls extract,TGE)对IgAN的疗效观察及机制研究尚未见报道。本研究旨在探讨TGE是否可减轻IgA免疫复合物在肾小球系膜区的沉积。
1 材料与方法
1.1 药材、试剂和主要仪器
没食子(新疆维吾尔自治区维吾尔医院),常规粉碎[11],过200目筛,CMC-Na稀释,配制成25 g·L-1浓度的混悬液,质量分数为1%,备用。牛血清白蛋白(bovine serum albumin,BSA)(美国MPBIO公司);四氯化碳(carbon tetrachloride,CCl4)(苏州百与化工有限公司);脂多糖(lipopolysaccharide,LPS)(美国Sigma公司);BCA蛋白定量试剂盒〔天根生化科技(北京)有限公司〕;IgA ELISA试剂盒(武汉优尔生科技股份有限公司);FITC标记的兔抗大鼠IgA多抗(美国Dako公司)。
Lx.20型全自动生化分析仪(美国Beckman公司);Motic Med 6.0A型全自动显微镜(德国Motic公司);DS-425型电子称(上海寺冈电子公司);MDF-382 E型超低温冰箱(-80℃)(日本SANYO公司);KDC-40型低速离心机(科大创新股份中佳分公司);AF100 AS-E型制冰机(意大利Scotsman公司);TGL213型高速台式离心机(上海安亭);DENVER型电子天平(北京赛多利斯仪器公司);GSP-9080MBE型隔水式恒温培养箱、GZX-9070型鼓风干燥箱(上海博迅医疗设备公司);Galanz型微波炉(顺德格兰仕电器);Model 550型Bio-Rad酶标仪(美国Bio-Rad公司);MM-2型微量振荡器(江苏赛普)。
1.2 动物、模型制备、分组和给药
健康雄性Sprague-Dawley大鼠50只,12周龄,体质量180~220 g,(新疆维吾尔自治区实验动物研究中心),合格证编号:SOXK(新)2011-0001。按SPF级饲养及管理,相对湿度40%~70%,室温20~24℃,适应性饲养1周,自由饮水摄食。
参考张静等[12]IgAN造模方法,运用BSA+ LPS+CCl4联合造模法制备IgAN大鼠模型。将BSA以蒸馏水配成浓度100 g·L-1,剂量600 mg·kg-1,隔天ig给予,持续12周;蓖麻油0.3 mL+CCl40.10 mL,每周sc给予1次,持续12周;其间于第8周,0.2 mL LPS 0.25 g·L-1(生理盐水配制)经尾iv给药1次。
参考TGE对小鼠的LD50[13],等效剂量比值换算为大鼠的LD50,取大鼠LD50的1/40,1/20和1/10剂量,即75,150和300 mg·kg-1分别作为TGE的干预剂量。将40只IgAN模型大鼠,随机分为IgAN模型组及TGE 75,150和300 mg·kg-1给药组;同时设正常对照组。TGE组每天ig给药1次,持续给药4周,IgAN模型组和正常对照组ig给予等量生理盐水。
1.3 BCA法测定24 h尿蛋白
分别于第12周及第16周末,禁食12 h,不限饮水,放代谢笼收集24 h尿液,806×g离心10 min,取上清液,BCA法测定24 h尿蛋白含量。
1.4 ELISA法测定血清和尿液IgA含量
第16周末,将各组大鼠ip麻醉,腹主动脉取血。采集全血1.0 mL,806×g离心10 min,分离血清。按1.3收集第16周末尿液。ELISA法测定血清和尿液IgA含量。
1.5 血肌酐(serum creatinine,SCr)和尿素氮(blood urea nitrogen,BUN)的检测
第16周末,利用全自动生化分析仪检测1.4中血液和尿液标本中SCr(μmol·L-1)和BUN(mmol·L-1)的含量。
1.6 HE染色检测肾组织病理变化
第16周末,腹主动脉取血后,摘双肾,冠状面切5 mm厚的肾组织于4%甲醛中固定,用于HE染色,其余肾组织用于冰冻切片制备。按照牛津病理分型标准,由2名研究人员盲法进行评分[14]。
系膜细胞增生(M)评分方法:<4个系膜细胞(1个系膜区)为0分,4~5个为1分,6~7个为2分,>8个为3分,系膜细胞增殖积分取所有肾小球的平均值,M0≤0.5,M1>0.5。
毛细血管内皮细胞增生(E)评分方法:肾小球毛细血管内皮细胞增殖致袢腔狭窄。E0:无;E1:有。
肾小球节段硬化(S)评分方法:任何不同程度的袢受累,但不包括全球受累或粘连。S0:无;S1:有。
小管萎缩/间充质纤维化(T)评分方法:0%~25%为T0,26%~50%为T1,>50%为T2。
1.7 免疫荧光检测肾组织IgA沉积
取1.6肾组织制备冰冻切片,丙酮固定,滴加FITC标记的兔抗大鼠IgA多抗(1∶100),4℃暗盒过夜,封片。采用国际通用5级半定量法[12]评价IgA沉积强度:即低倍镜下不显示荧光、高倍镜下似乎可见为“-”,低倍镜下似乎可见、高倍镜下可见为“+”,低倍镜下可见、高倍镜下清晰可见为“++”,低倍镜下可见、高倍镜下耀眼为"+++",高倍镜下刺眼为"++++"。由2位研究人员盲法阅片,每张切片至少观察20个肾小球。
1.8 统计学分析
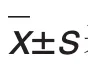
2 结果
2.1 TGE对IgAN模型大鼠一般情况的影响
与正常对照组相比,IgAN模型大鼠多数出现毛发蓬乱、食欲不振和精神萎靡,但无死亡。与IgAN模型组相比,TGE干预1周后,各剂量组部分大鼠出现精神不振、活动减少等不适,约2周后逐渐恢复正常。干预第4周末,TGE 300 mg·kg-1组大鼠死亡1只。
2.2 TGE对IgAN模型大鼠24 h尿蛋白量的影响
24 h尿蛋白检测结果 (图1)显示,第12周末,与正常对照组相比,IgAN模型组大鼠出现明显蛋白尿(P<0.05),提示IgAN建模成功。第16周末,与IgAN模型组比较,3个TGE剂量组大鼠24 h尿蛋白均有不同程度下降(P<0.05),提示不同剂量TGE均可减少IgAN模型大鼠蛋白尿(P<0.05)。

Fig.1 Effect of Turkish galls extract(TGE)on 24 h urinary protein of IgAN model rats.The IgAN model of rats was estabilished with BSA 600 mg·kg-1(ig,once 2 d),castor oil 0.30 mL+CCl40.10 mL(sc,once a week)for 12 weeks,injection of LPS on the 8thweek(iv,only once).From the 13thweek,rats were ig administered with TGE,once a day for 4 weeks,normal control group and IgAN model group were ig administered with normal saline.x±s,n=10(9,TGE 300 mg·kg-1group).*P<0.05,compared with normal control group;#P<0.05,compared with model group.
2.3 TGE对IgAN大鼠血清和尿液IgA含量的影响
血清和尿液IgA含量检测结果 (表1)显示,第16周末,与正常对照组相比,IgAN模型组大鼠血清和尿液IgA含量升高(P<0.05),符合IgAN的疾病特征。与IgAN模型组相比,TGE各组血清和尿液IgA含量降低(P<0.05),提示TGE可减轻IgA在血清及尿液中的表达。

Tab.1 Effect of TGE on IgA levels in urine and serum of IgAN model rats
2.4 TGE对IgAN模型大鼠血肌酐和尿素氮含量的影响
血清SCr和BUN含量检测结果 (表2)显示,与正常对照组相比,IgAN模型组大鼠血清SCr和BUN水平升高(P<0.05)。与IgAN模型组相比,TGE各剂量组血清SCr水平下降(P<0.05),TGE 150和300 mg·kg-1组BUN水平下降(P<0.05)。
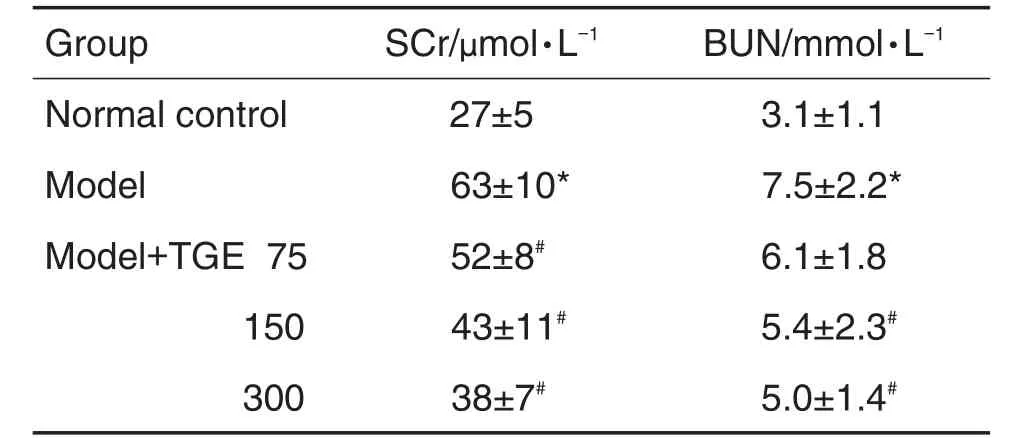
Tab.2 Effect of TGE on content of SCr and BUN in serum of IgAN model rats
2.5 TGE对IgAN模型大鼠肾组织病理变化的影响
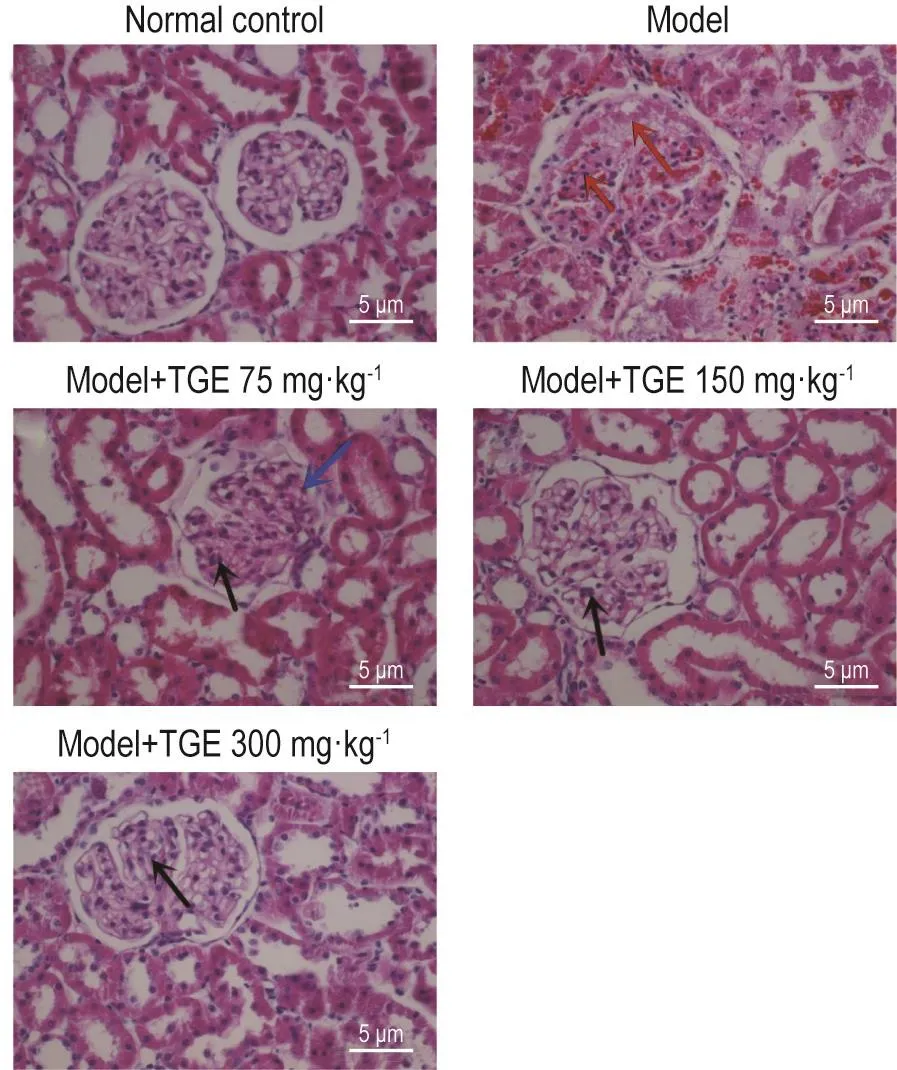
Fig.2 Effect of TGE on pathological changes in renal tissue in IgAN model rats(HE staining).See Fig.1 for the rat treatment.Red arrows represent glomerular sclerosis,blue ones are for glomerular and renal capsule adhesion,and black ones are for mesangial cell and endothelial cell proliferation.
肾组织病理结果 (图2及表3)显示,与正常对照组相比,IgAN模型组大鼠肾小球结构形态出现不同程度的系膜细胞和毛细血管内皮细胞增生,肾小球节段硬化和小管萎缩或间充质纤维化。对各组大鼠肾组织病变进行牛津分型评分后可见,各组大鼠在E分型上差异无统计学意义,提示各组大鼠内皮细胞增生改变较为普遍。在S1T1/2病变分型中,与正常对照组相比,IgAN模型组S1T1/2所占比例明显增多(P<0.05);与IgAN模型组相比,不同剂量TGE组大鼠发生S1T1/2病变的比例并无显著减少。而在M分型中,与正常对照组相比,IgAN模型组发生比例增加(P<0.05);与IgAN模型组相比,TGE 300 mg·kg-1组M1所占比例明显减少(P<0.05),提示TGE 300 mg·kg-1可明显减轻IgAN模型大鼠系膜细胞增生。
2.6 TGE对IgAN模型大鼠肾组织IgA沉积的影响
免疫荧光结果 (图3,表4)显示,正常对照组大鼠肾小球无荧光,IgAN模型组大鼠肾小球可见绿色荧光沉积。与IgAN模型组相比,TGE 150和300 mg·kg-1组荧光较弱,荧光半定量评分降低(Z=-3.207,P<0.01;Z=-3.345,P<0.01),TGE 75 mg·kg-1组荧光强度无显著变化。上述结果 提示,TGE 150和300 mg·kg-1可减轻IgA在大鼠肾组织中的沉积。
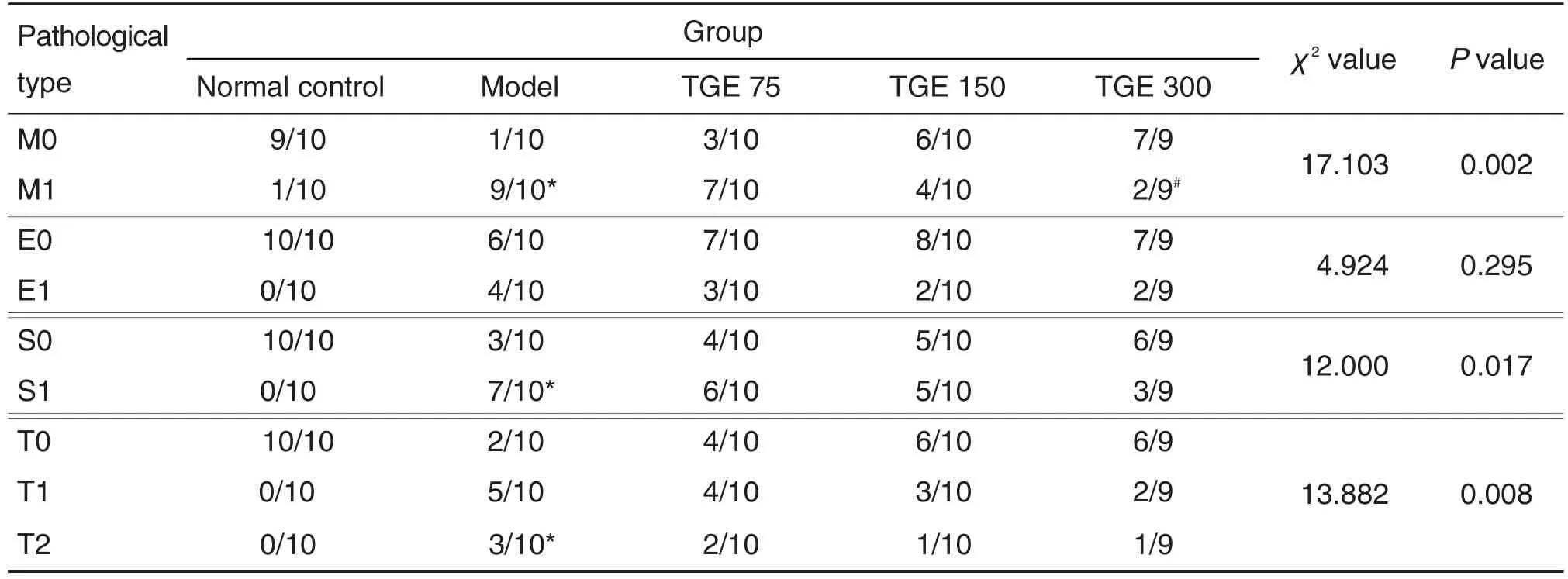
Tab.3 Pathological types and scores in Oxford classification of renal tissue in IgAN model rats
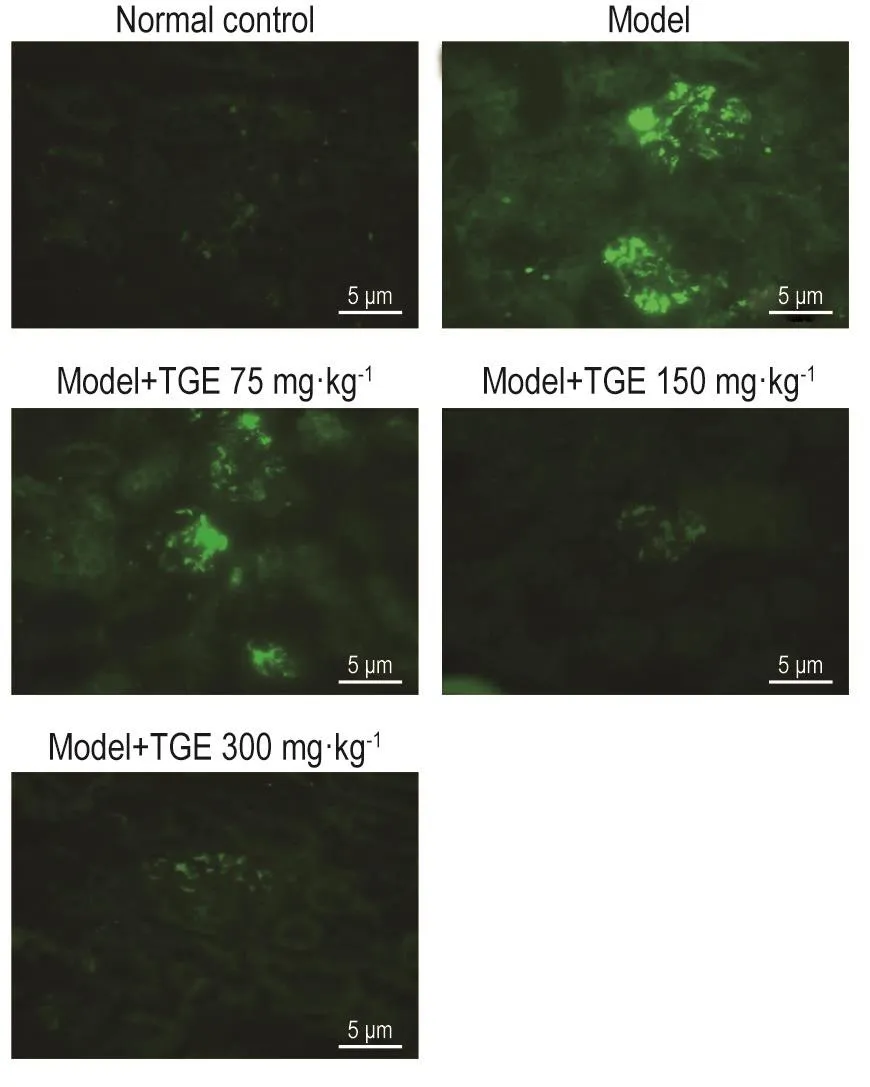
Fig.3 Effect of TGE on IgA deposition of renal tissue in IgAN model rats by immunofluorescence.See Fig.1 for the rat treatment.
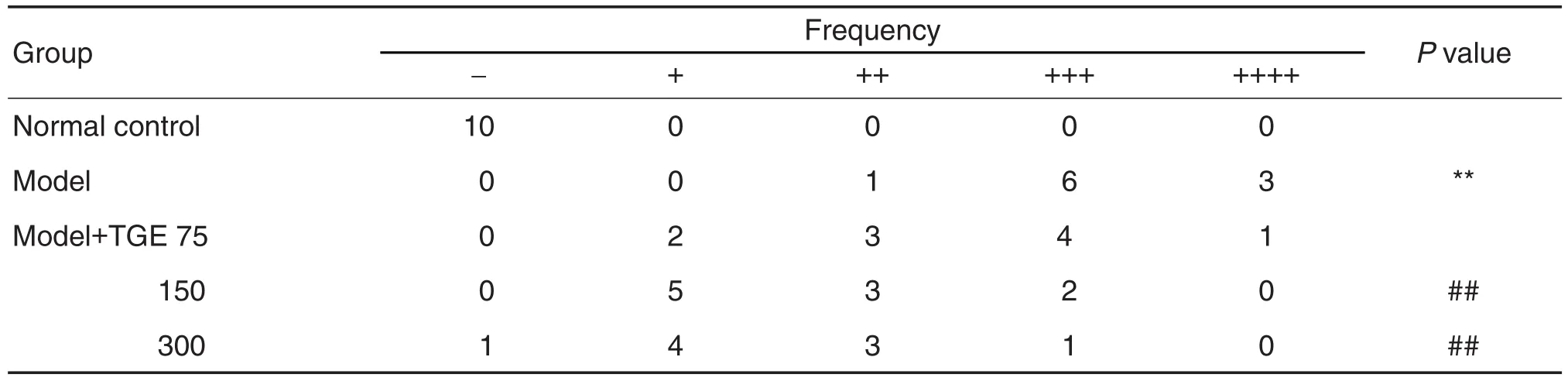
Tab.4 Effect of TGE on renal immunofluorescence scores in IgAN model rats
3 讨论
本研究结果 提示,不同剂量TGE可减少尿蛋白,减轻血清、尿液及肾组织IgA的表达。而蛋白尿及IgA的沉积程度可很大程度上影响疾病的预后。TGE可能通过减少IgA的形成和(或)抑制IgA在系膜区的积聚,延缓IgAN的发展并改善其预后。王婷等[15]同样发现了TGE减少尿蛋白的作用。因为病理性蛋白尿的产生与肾小球滤过屏障及肾小管重吸收有关,故推测TGE有改善肾小球滤过屏障及肾小管功能并延缓损伤的作用。
本研究发现,IgAN模型大鼠牛津病理分型特点以M1E0S1T0多见。各组大鼠在E分型中差异无统计学意义,提示TGE对内皮细胞增生状况无明显改善。因内皮细胞增生在牛津分型四大病变中是影响IgAN预后最弱的指标[16],故其病变的严重程度及改善程度对IgAN的预后影响较弱。而在M分型中,IgAN模型大鼠发生系膜细胞增生病变的概率明显升高;TGE干预后,TGE 300 mg·kg-1组大鼠发生系膜细胞增生的比例明显减少。在ST分型中,TGE 150和300 mg·kg-1组大鼠较正常对照组所发生的比例增加不明显,提示TGE对肾小球节段硬化及小管间充质纤维化可起到一定程度改善作用。因ST是影响IgAN预后的重要因素,因此TGE150和300 mg·kg-1对改善IgAN预后起重要作用。
TGE干预大鼠过程中,TGE 300 mg·kg-1组死亡大鼠经解剖后发现胃肠道扩张、肝结节病变,考虑与TGE具有一定胃肠道毒性有关[7]。
综上所述,TGE可间接延缓IgAN进展,改善预后。其具体作用机制及长期大量使用TGE引起的毒副作用尚需进一步研究。
[1]Novak J,Renfrow MB,Gharavi AG,Julian BA. Pathogenesis of immunoglobulin A nephropathy[J].Curr Opin Nephrol Hypertens,2013,22(3):287-294.
[2]Yu HH,Chu KH,Yang YH,Lee JH,Wang LC,Lin YT,et al.Genetics and immunopathogenesis of IgA nephropathy[J].Clin Rev Allergy Immunol,2011,41(2):198-213.
[3]Novak J,Julian BA,Mestecky J,Renfrow MB. Glycosylation of IgA1 and pathogenesis of IgA nephropathy[J].Semin Immunopathol,2012,34(3):365-382.
[4]Yoshikawa N,Iijima K,Ito H.IgA nephropathy in children[J].Nephron,1999,83(1):1-12.
[5]Yoshikawa N,Tanaka R,Iijima K.Pathophysiology and treatment of IgA nephropathy in children[J]. Pediatr Nephrol,2001,16(5):446-457.
[6]Mizerska-Wasiak M,Małdyk J,Rybi-Szumińska A,Wasilewska A,Miklaszewska M,Pietrzyk J,et al. Relationship between serum IgA/C3 ratio and severity of histological lesions using the Oxford classification in children with IgA nephropathy[J].Pediatr Nephrol,2015,30(7):1113-1120.
[7]Wang JY,Zhang QH,Deng XM,Wang DC,Han WY. The recent advances in pharmacological research of Turkish galls[J].Lishizhen Med Mater Medica Res(时珍国医药),2007,18(10):2570-2572.
[8]Li HC,Lu JS,Hou YF,Shao ZM,Shen ZY.Inhibition effects of epigallocatechin-3-gallate(EGCG)on cell cycle of human breast cancer cells MDA-MB-435 and its mechanism[J].Chin Oncol(中国癌症杂志),2004,14(1):9-11.
[9]Zhao J,Niu QL,Li Y,Sun YL,HAMulati U.The study of Turkish gall on the growth of cariogenic bacteria in vitro[J].J Xinjiang Med Univ(新疆医科大学学报),2009,32(1):1-3.
[10]Chandak PG,Gaikwad AB,Tikoo K.Gallotannin ameliorates the development of streptozotocin-induced diabetic nephropathy by preventing the activation of PARP[J].Phytother Res,2009,23(1):72-77.
[11]Huo SX,Peng XM,Gao L,Zhou L,Silafu AB. Pharmacochemistry of traditional Uiygur medicine Galla Turcica[J].Chin Tradit Pat Med(中成药),2011,33(10):1754-1757.
[12]Zhang J,Li J,Sang XH,Liu J,Wang LN,Miao N. Using two kinds of BSA dose to establish Ig A nephropathy rats model[J].Chin J Integrated Tradit West Nephrol(中国中西医结合肾病杂志),2013,14(1):13-16.
[13]Li ZJ,Abudoujilili A,Meng FL,Silafu AB.Acute toxicity of Turkish galls extract on mice[J].Lishizhen Med Mater Med Res(时珍国医国药),2011,22(11):2630-2631.
[14]Working Group of the International IgA Nephropathy Network and the Renal Pathology Society,Cattran DC,Coppo R,Cook HT,Feehally J,Roberts IS,et al.The Oxford classification of IgA nephropathy:rationale,clinicopathological correlations,and classification[J].Kidney Int,2009,76(5):534-545.
[15]Wang T,Li SH,Li TJ,Sang XH.Effects of Quercus infectoria on NF-κB in serum and renal tissue of IgA nephropathy model rats[J].Chin Pharm(中国药房),2014,25(43):4036-4039.
[16]Shi SF,Zhang H.The analysis of IgA nephropathy Oxford classification verification status[J].Chin J Nephrol(中华肾脏病杂志).2012,28(3):167-169.
Therapeutic effect of Turkish galls extract on IgA nephropathy model rats
LI Jing1,LIU Yan-jie2,SANG Xiao-hong1,WANG Ting3,LIU Jian1
(1.Department of Nephropathy,the First Afiliated Hospital,Xinjiang Medical University,Urumqi 830054, China;2.Department of Nephropathy,Zibo Central Hospital of Shandong Province,Zibo 255036, China;3.Department of Nephropathy,the TCM Affiliated Hospital,Xinjiang Medical University, Urumqi 830000,China)
OBJECTIVETo investigate the effect of Turkish galls extract(TGE)on the expression of IgA in serum,urine and renal tissue of IgA nephropathy(IgAN)model rats.METHODSFifty healthy male Sprague Dawley rats were randomly divided into normal control group,IgAN model group,and TGE 75,150 and 300 mg·kg-1groups,10 rats per group.The model of IgAN rats was established with bovine serum albumin(BSA)+lipopolysaccharide(LPS)+carbon tetrachlorid(CCl4)for 12 weeks.From the 13thweek,TGE was ig administrated once a day for 4 weeks.At the end of the 12thand 16thweeks, 24 h urine protein was measured by BCA method.At the end of the 16thweek,serum and urinary IgA levels were measured by enzyme linked immunosorbent assay(ELISA),serum creatinine(SCR)and blood urea nitrogen(BUN)were detected by an automatic biochemical analyzer,and the renal pathological changes were evaluated with an Oxford classification scoring system.The deposition of IgA immune complex in the kidney was observed by immunofluorescence assay.RESULTSAt the end of 12thweek,24 h urine protein increased in all IgAN groups(P<0.05),compared with normal control group.At the end of 16thweek,24 h urine protein,IgA content in serum and urine,SCr and BUN content in serum,score in Oxford classification of renal tissue and deposition of IgA immune complex in the kidney in IgAN model group were all higher than in normal control group(P<0.05).Compared with IgAN model group,24 h urine protein,IgA content in serum and urine and SCr content in serum were decreased in all TGE groups(P<0.05),and BUN content in serum and deposition of IgA immune complex in the kidney decreased in TGE 150 and 300 mg·kg-1groups(P<0.05).The score in Oxford classification of renal tissue was decreased in TGE 300 mg·kg-1group only.CONCLUSIONTGE has curative effect on IgAN model rats by reducing serum and urinary IgA and decreasing IgA immune complex deposition.
Turkish galls extract;IgA nephropathy;IgA
The project supported by National Natural Science Foundation of China(81660127)
LIU Jian,Tel:13609937228,E-mail:jianliu@medmail.com.cn
R285
A
1000-3002-(2017)06-0547-06
10.3867/j.issn.1000-3002.2017.06.008
2016-01-05接受日期:2017-05-10)
(本文编辑:贺云霞)
国家自然科学基金(81660127)
李静,女,副主任医师,主要从事慢性肾小球肾炎的研究,E-mail:jingdoctor0803@163.com;刘健,男,主任医师,主要从事慢性肾脏病与肾移植的研究。
刘健,E-mail:jianliu@medmail.com.cn,Tel: 13609937228

