基于化学学科观念的教学——参加江苏省2012年高中化学优质课比赛的感受
丁浩(江苏省梁丰高级中学 江苏张家港 215600)
基于化学学科观念的教学——参加江苏省2012年高中化学优质课比赛的感受
丁浩
(江苏省梁丰高级中学江苏张家港215600)
摘要:优质课评比是老师在教学生涯中的必修课。文章以参加省化学优质课比赛为例,以赛前准备、教学设计、教学过程和课后反思几个方面谈如何准备好优质课的评比。
关键词:探究;角色转换;问题解决;教学流程
中图分类号:
文章编号:1008-0546(2015)03-0061-03G633.8
文献标识码:B
2012年12月江苏省中小学教学研究室在连云港举办了高中化学优质课评比活动,作为选手,我有幸参加了本次比赛,参加的比赛课题是“镁的提取及应用”,本文就比赛的课前准备、教学设计和教学过程和课后思考谈一下自己的感受,与同仁交流。
一、研读课程标准、知晓教材意图
从课程标准内容看,在化学中1中的要求是“根据生产、生活中的应用实例或通过实验探究,了解钠、铝、铁、铜等金属及其重要化合物的主要性质,能列举合金材料的重要应用。”课标中并没有直接体现“镁”的相关教学要求。
苏教版中编排了“镁的提取及应用”,共有两部分内容:镁的提取、镁的性质;人教版《化学与技术》第二单元“化学与资源的开发利用”课题2“海水的综合利用”中有“海水提镁”,没有镁的性质部分。那么在苏教版教材中编排这一内容的意图又是什么呢?从苏教版教材体系看,专题2涉及了从海水中提取非金属氯、溴、碘和金属钠、镁,为专题3从矿物到基础材料的学习打下基础。那么教材中设置“镁的性质”的意图是什么?笔者以为镁的性质主要是为了完善镁的提取的过程,让学生更容易理解氢氧化镁制取镁的方法。
二、了解学生学情、合理加工教材
1.知晓学情是为了更好地尊重学生
尊重学生,不仅体现在尊重学生的现有知识、更体现在尊重学生的能力现状;了解学生的学情还有利于教学中充分调动积极性,并把已有的知识运用到新情景问题的解决中。学生已经学习的相关知识:镁的性质(颜色、状态、以及和O2的反应),镁是一种比较活泼的金属、具有金属通性,溶解性和溶解度的相关知识,物质的量浓度计算(离子浓度的换算),离子反应和离子方程式的运用,铁、铜、钠等金属的制备,氯碱工业等。
(1)教学设计中要体现对学生知识的尊重
在教学设计中要充分运用已有知识,但也要适可而止,不宜过度追求全面和拔高。
对于海水中Mg2+浓度,各种资料上大多提供的是质量浓度(每升中有多少克),在学习了物质的量浓度后,物质的量浓度更能反映出量的关系,但是如果在课堂上进行换算,可能会冲淡主题;所以在设计中直接给出经过换算后的离子的物质的量浓度,既直观,又避免难度过大而冲淡主题。再如在MgCl2溶液制取MgCl2中,不盲目地拔高,对于在MgCl2溶液制取无水MgCl2中回避MgCl2水解的问题、留有悬念留待学生品味。
(2)教学设计中要体现对学生的能力的尊重
学习是知识建构的过程,通过搜索,找到连云港恒海镁业有限公司是国内较早从海水中提取镁及其化合物的企业。引导学生从原料、加工、运输等方面进行企业的选址,同时了解到海水资源开发的重要性。
在学习镁的提取及应用前学生已经学过多种工业生产原理和工艺,学生有能力在海水制镁的基础上完善化工产业链,同时也帮助学生对相关工业生产进行有机的结合,感受到学以致用的乐趣。更加强了化学知识与社会生活和工农业生产的密切联系。这样才能让学生真正经历升华认识的过程。
2.对教材进行有效加工,有效分解难点
教材使用的是精辟、适度概括的语言,在教学中需要对教材的内容作适当的加工,以期更好地适应学生、收到更好的教学效果。
在自然界中镁的含量时,教材中提到海水中镁的含量为1.8×1015吨,查阅资料了解到全世界的菱镁
矿资源量约为120亿吨,这两个数据的比较不够直接,所以在教学设计中把海水中镁的含量转为了1800万亿吨,并且用饼图的形式呈现,这对学生无论是直接的体验还是视觉的冲击都是比较大的,学生也更容易感受到从海水中提取镁的重要性和可行性。
在镁的提取过程中,如果直接把“从海水中的镁离子到镁单质”这个命题抛给学生,可能学生比较难以接受,可以把这个命题中分成两个子命题:一是从海水中富集镁,即“把Mg2+转化为哪种化合物从海水中分离出来”;二是从Mg(OH)2制取Mg。对于第一个命题,由物质的分离方法学生比较容易和沉淀法结合起来,进而通过镁化合物的溶解度判断转化为氢氧化镁是可行的,再通过实验的方法判断使用哪种沉淀剂;第二个命题学生在比较其它金属的制备方法,可以从电解、还原、置换、加热分解等角度设计可能的途径。这样处理学生就有可操作性,有着手点。
三、设置探究问题、尝试问题解决
在教学设计中,针对本课题难点有“海水中提取镁的沉淀剂的选择”、“工业制镁的方案的设计和选择”,采用了“问题探究”式教学方法,在富集、分离、碱的选择、冶炼方法和原料选择等一系列问题上,不提供现成的知识和结论,在教师的适度引导下,学生根据已有的知识和提供补充资料,通过让学生小组合作的方式解决真正的问题,来学习隐含于问题背后的科学知识。
1.围绕三个探究过程
设计中主要从三种探究进行:实验探究——从海水中富集镁的方案,方案探究——从Mg(OH)2到Mg单质的可能性方案,性质探究——镁的可能的化学性质。
(1)实验探究——从海水中富集镁的方案。
在镁的富集方法的判断上,通过镁的常见化合物和溶解性判断:把镁离子转化为氢氧化镁是可行的,在沉淀剂的选择上通过实验探究来判断。
实验中提供了1mol·L-1NaOH溶液、1mol·L-1KOH溶液、饱和Ca(OH)2溶液分别与模拟海水(0.05 mol·L-1MgCl2溶液)、模拟卤水(3 mol·L-1MgCl2溶液)反应,通过现象(只有模拟卤水与NaOH、KOH溶液反应生成白色沉淀)说明把Mg2+转变成Mg(OH)2是正确的,选用海水晒盐得到的卤水也是可行的;但是饱和石灰水和浓MgCl2溶液没有明显现象说明使用石灰水不可行,通过工业利润最大化判断沉淀剂的使用(提供各种常见碱的市场价格),推断应该是Ca(OH)2,并且类似于工业制取漂白粉使用石灰乳。
(2)方案探究——从Mg(OH)2到Mg的可能性方案
学习过程,我以为就是充分利用原有认知结构对新知识的固定作用,只有把新的学习内容中的要素与已有认知结构中特别相关的部分联系起来,才能有意义地习得新内容,这样的学习才有意义。如在讨论选择从Mg(OH)2到Mg的冶炼方法时,通过学生回忆初中学过的金属Fe、Cu等金属的冶炼、结合刚学过的活泼金属Na冶炼,激活了学生的原有的知识,在学生“已经知道的”与“需要知道的”知识之间架设起桥梁,为学生选择镁的冶炼方法提供知识的固定点。
(3)性质探究——镁的可能的化学性质
从已知推测未知是一个化学工作者必须具备的能力,在教学中从节日焰火中Mg是耀眼的明星引出Mg的可能的性质、结合学过的金属通性和活泼金属Na的性质,推测Mg可能的性质;并由学生板演可能的反应方程式:Mg和H2SO4反应、Mg和CuSO4反应;提供蒸馏水、酚酞、镁条由学生实验判断自己的推测是否正确。大多数同学能够结合钠和水的反应,通过滴加酚酞溶液变红判断生成了Mg(OH)2,同时通过Mg和滴有酚酞的蒸馏水反应没有Na和H2O剧烈得出Mg金属性没有Na强的结论。
对于Mg和CO2反应,这个实验现象很明显,但是从知识体系上看对学生的冲击是很大的,因为CO2一直是以灭火剂的形象出现的。同时引导学生回头看:进一步对从Mg(OH)2制取Mg的方案探究判断:用H2、C 或CO还原Mg(OH)2是不可行的。
2.体现四种角色的转换
在教学中设计了学生的多种角色的转化:企业家、化学工艺设计师、政府工作人员和化学研究者等角色,通过不同角色扮演,让学生有机会体验从多种、更真实的角度考虑问题,并对学生的今后的职业倾向有一定的影响。
企业家,更多地应该从成本和利润的角度,提出适合的厂址,把海水制镁的企业建立在连云港可以充分运用丰富的原材料:海水、贝壳可以制得CaO、进一步制得石灰乳用于沉淀Mg2+。
化学工艺设计师,主要是从把Mg2+富集为沉淀、并由Mg(OH)2制得Mg,参考其它金属的冶炼方法提出可能的途径,比如参考活泼金属Na可以采用电解方法制Mg,参考Fe、Cu可以采用还原法制Mg(H2、C 或CO还原法),参考Hg可以采用加热的方法制Mg,经甄别得出合适的途径。在此过程中学生充分运用已有的知识集体讨论,各种方法和方案的碰撞,在比较中获得知识。
作为政府工作人员,要合理地配置资源,引导相关企业互相合作,从完善上下游产业链的角度引导相关企业的加入,做到资源共享、降低成本,充分发挥和放大产业园的功能。
化学研究者,是培养学生发展的取向,如何参考已知的物质性质研究未知物质性质?一般通过“推测——实验验证”方法。在学习了Na、Fe、Cu等多种金属的性质后,Mg性质的学习可以让学生模拟化学研究者尝试通过金属通性和类比研究,得出Mg的可能的性质,再以实验验证。
四、明了课堂环节,合理编制流程
教学流程图,也有利于老师厘清教学思路,可以直观地显示整个课堂活动中各个要素之间的关系、反映出教师教学过程设计的逻辑性,可以让老师更明了教学重点、难点以及对重难点的突破更有针对性。
设计“镁的提取及应用”(苏教版)流程图,本流程在授课后又经过了修改。
五、机智应对“意外”,关注生成过程
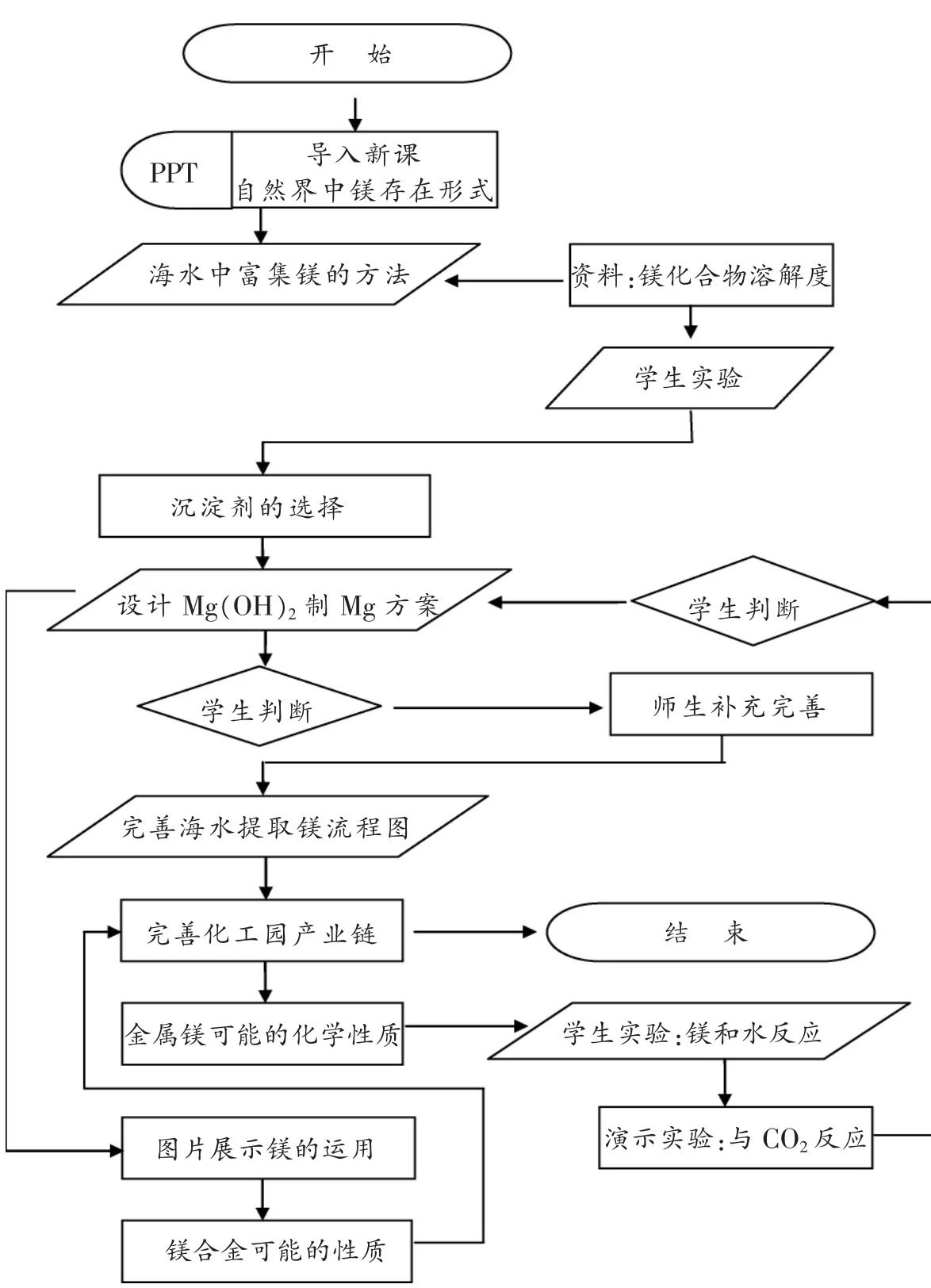
课堂,是一个具有生成性过程,正因为如此,准备再充分的教学设计也会遇到“意外”,面对意外,需要我们老师冷静面对、及时应对。在实际教学中“方案设计——从Mg(OH)2到Mg单质”环节,学生有三种回答的情况出乎意料:一种是Mg(OH)2和N2反应、二是Mg(OH)2和H2反应、三是Mg(OH)2和C反应。这三种方案的出现时以前没有设想过的,因为一般学生首先会考虑Mg(OH)2分解产生MgO再用H2或C还原,那么有没有必要解释Mg(OH)2的分解?如何解决这三个疑问?在课堂有限的时间内如何解答?
笔者是这样处理的,根据Mg(OH)2和H2反应,请学生回答可能的产物为“Mg和H2O”、“可以用C还原Mg(OH)2得到Mg和CO2”,这时联想到Mg和H2O、CO2的反应在性质探究中要学习,所以不直接进行判断:“利用现有知识还无法解决,那么我们能否通过以下的学习来解决”引导学生到镁的性质的学习上。还有同学提出“可以用N2与Mg(OH)2反应”,一句话带过:“氮气的化学性质很稳定,不和氢氧化镁反应”带过,不做过多地停留。
尽管实验已经不再是研究化学的唯一的途径,但是在中学阶段,我们还是需要加强对实验的研究。Mg与H2O的反应,我们一般实验都是采用先和滴有酚酞的冷水反应,加热后红色加深。在比赛前试上也是这样进行的,而且现象也和意料的一样。但是课前在准备室,我对Mg和H2O的反应进行加热,发现红色在加深后反而变淡了,当时可能时间也比较紧,于是决定放弃加热操作。现在想来可能是酚酞在加热时被氧化了、也可能是Mg(OH)2分解了抑制了电离使得氢氧根离子浓度减小。就是这样一个从高中到工作一直都“很乖”的实验居然有意外,我想很多实验可能都需要我们进一步推敲。
精彩的课堂不在于炫目的亮点,其魅力在于生成过程中,需要教学设计,更需要我们用表达精准、具有生成性、富有挑战性而有开放性的问题来引导学生,拓展学生的想象空间。
参考文献
[1]杨玉琴,倪娟.彰显“技术思想”的教学设计——以“镁的提取及应用”为例[J].化学教育,2014,(6)
[2]刘革平,龚继新.化学新课程该如何教——展示课“镁的提取”的教学评析[J].2012,(8)
doi:10.3969/j.issn.1008-0546.2015.03.023

