再生基因4(REG4)真核表达载体的构建及其蛋白在HEK 293T细胞中的表达、纯化
徐 杨,杜惠芬,李克生,柴丹丹,石晓玲,连晓雯,张学良(.甘肃省医学科学研究院医学生物技术研究中心,兰州 730050;.甘肃省肿瘤医院消化肿瘤内科,兰州 730050)
再生基因(regenerating gene,REG)家族属于钙依赖性凝集素(C 型凝集素)基因超家族,有四个亚型,该家族蛋白可能参与多种细胞和组织的再生[1]。REG4 属于该家族成员之一,编码再生胰岛衍生蛋白IV (regenerating islet-derived protein IV,Reg IV),是一种小分子分泌性蛋白质,分子量约为18.2 KD。已有研究证明,Reg IV 能够显著促进肿瘤细胞的生长、增殖、侵袭和迁移,抵抗凋亡,并可提高肿瘤细胞抗药性等作用[2-5]。因此,Reg IV在肿瘤诊断、预后及潜在治疗靶点[6]方面具有较大的应用前景。胃癌为消化系统常见恶性肿瘤[7],课题组前期对胃癌中Reg IV 和性别决定区Y 框蛋白9(SOX9)的调控关系进行了研究,通过构建真核表达载体pEGFP/RegIV,瞬时转染胃癌细胞系MKN-45 和AGS 细胞,发现Reg IV 可能通过调控SOX9 的表达水平参与胃癌细胞的侵袭和迁移[8]。由于pEGFP/RegIV 载体的标签蛋白较大及纯化问题使应用受限,为进一步实现Reg IV 在体内外生物功能的研究及抗体制备,本研究拟通过构建带His 标签的REG4 真核表达载体,并在人胚肾细胞293T 细胞(human erabryonic kidney 293 T cell,HEK 293T)细胞中表达,以期获得可用于研究的重组人Reg IV 蛋白。
1 材料与方法
1.1 细胞及质粒来源 pCDNA3.4-REG4 质粒及克隆菌株(南京钟鼎生物技术有限公司);HEK 293T 细胞(本室液氮冻存,来源于中科院上海细胞库)。
1.2 仪器与试剂 DMEM 高糖培养基(gibico,美国);新生牛血清(兰州民海生物工程有限公司);PEI(Polysciences,Inc.,美国);PVDF 膜(Merck Millipore,德国);化学显影试剂盒(Thermo,美国);ChemiDoc XRS+凝胶成像系统(BIO-RAD,美国);兔源REG4[Cell Signaling Technology(CST),美国];HRP 标记的山羊抗兔IgG[爱必信(上海)生物科技有限公司];鼠源β-actin,HRP 标记的山羊抗鼠IgG(Santa,美国);无内毒素小量质粒提取试剂盒II(Omega Bio-Tek,美国);DNA Marker,蛋白质Marker(Takara,日本);本研究所用其他相关化学试剂均为国产分析纯。
1.3 方法
1.3.1 pCDNA3.4-REG4 表达载体的构建与鉴定:根据GenBank REG4 基因已知序列,委托南京钟鼎生物技术有限公司进行基因合成,按照哺乳动物蛋白表达体系进行了密码子优化,将REG4 原有信号肽序列转换成钟鼎信号肽序列,C 端添加His 标签,合成并构建在pCDNA3.4 载体上(酶切位点为EcoR Ⅰ/BamH Ⅰ),构建策略见图1。将构建好的载体转化感受态大肠埃希菌TOP10,将转化菌涂布于LB 平板(含50 µg/ml 氨苄青霉素),37℃培养过夜。用无菌牙签挑取单菌落接种于LB 培养液(含50 µg/ml 氨苄青霉素)中,37℃,200 r/min 培养过夜。提取质粒,对重组表达质粒进行双酶切( EcoR Ⅰ/BamH Ⅰ)鉴定及序列测定,鉴定正确的重组表达质粒命名为pCDNA3.4-REG4。
1.3.2 pCDNA3.4-REG4 质粒的提取:取钟鼎生物交付鉴定正确的菌液,按1∶50 比例接种 LB(含50µg/ml 氨苄青霉素)培养液,37℃,200 r/min 培养过夜。根据质粒提取试剂盒操作说明提取质粒,测定质粒浓度,于-75℃冰箱冻存。
1.3.3 细胞培养与转染:HEK 293T 细胞接种于含 100 ml/L 胎牛血清的 DMEM 高糖培养液中,37℃,5%(v/v)CO2培养箱中常规培养。转染前1 天,将生长良好的细胞消化计数铺于细胞瓶中,细胞密度约1.8×106个/瓶,待细胞达到70%~80% 融合时,按照PEI 常规转染方法将pCDNA3.4-REG4质粒瞬时转染至HEK 293T 细胞(作为实验组),同时以pEGFP-C1 质粒作为转染对照组,未转染重组质粒的HEK 293T 细胞作为空白对照组,转染30h 后分别收集实验组及空白对照组的细胞和细胞培养液上清,细胞悬于0.01 mol/L PBS(pH 7.4)缓冲液中,均于-75℃冰箱冻存。荧光显微镜观察转染对照组(pEGFP-C1 质粒)转染情况。
1.3.4 重组蛋白的SDS-PAGE 及WB 鉴定:采用三氯乙酸(tirichloroac etic acid,TCA)[9]法从细胞培养液上清沉淀蛋白,分别将收集的细胞、细胞培养液上清蛋白样品用上样缓冲液处理后进行 SDSPAGE 电泳,然后进行蛋白染色鉴定及WB 实验。WB 一抗为兔源REG4、鼠源β-actin(均是1∶1 000 稀释),二抗为HRP 标记的山羊抗兔IgG(1∶5 000 稀释)、山羊抗鼠IgG(1∶4 000 稀释),用ChemiDoc XRS+凝胶成像系统成像,β-actin 为内参蛋白。
1.3.5 重组蛋白的纯化:Reg IV 过表达HEK 293T细胞经-75℃和常温反复冻融3 次,超声10 次(超声功率100 W,超声/间隙时间3s/3s),然后与平衡好的镍柱填料混合,4℃孵育4 h,用不同浓度咪唑缓冲液进行洗脱,留样检测。收集含目的蛋白样品,依次用30%,80%饱和硫酸铵分级沉淀蛋白,沉淀用0.01 mol/L PBS(pH 7.4)缓冲液溶解后以Sephacryl S-400 柱进行纯化,收集主蛋白峰,进行SDS-PAGE 分析,再进行WB 验证。
2 结果
2.1 pCDNA3.4-REG4 表达载体的鉴定 重组表达质粒pCDNA3.4-REG4 的双酶切产物经琼脂糖凝胶电泳分析,可见约500 bp 的目的片段,与理论值一致(495 bp),见图2。测序结果显示,经密码子优化的目的蛋白序列与靶蛋白序列(序列号:NP_001152824.1)相比,除信号肽外其余氨基酸序列完全一致,共编码Reg IV 去信号肽序列的136个氨基酸残基,表明重组质粒构建成功,此质粒C末端具有His 标签,分子量理论值约为16.7 KD。

图2 pCDNA3.4-REG4 质粒双酶切验证
2.2 重组人Reg IV 蛋白过表达鉴定 转染对照组(pEGFP-C1 质粒)经荧光显微镜观察,显示转染效率约50%,表明转染成功。WB 结果显示,与空白对照组相比,仅实验组(pCDNA3.4-REG4 质粒)的细胞在Reg IV 蛋白预期位置(Mr 约15 KD)检测到特异性条带,表明此重组蛋白过表达成功并定位于胞内,未分泌到细胞培养液中,见图3。
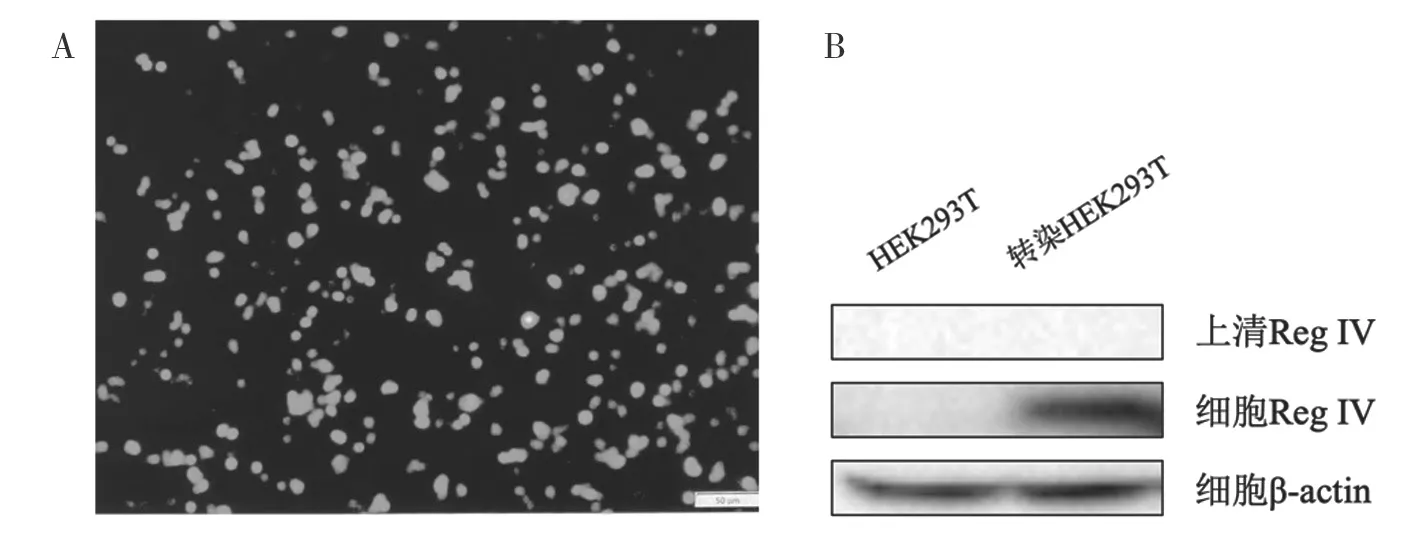
图3 质粒转染HEK 293T 细胞验证
2.3 重组蛋白的纯化鉴定 镍柱收集样品经SDSPAGE 检测,结果显示,目的蛋白主要在与镍柱结合后的残液及流穿液中;WB 结果验证了SDSPAGE 的结果,WB 还显示200 mmol/L 咪唑洗脱液仅有微弱的目的条带,说明目的蛋白无法与柱材有效结合。将含目的蛋白的残液和流穿液合并后经硫酸铵分级沉淀,Sephacryl S-400 柱纯化得到的样品经SDS-PAGE 检测,结果显示纯化获得了目的蛋白,WB 结果验证了SDS-PAGE 的结果,见图4。

图4 蛋白纯化鉴定
3 讨论
Reg IV 异常表达与感染、炎症以及多种癌症有关,其表达程度可作为预测恶性肿瘤发生、侵袭性行为和不良预后的指标[2,10],而且它还可能是耐药患者特定亚群的治疗靶点[5]。但目前对于Reg IV 的生物学功能如相关受体、调节因子以及耐药机制等研究还不透彻,部分原因是生物活性蛋白的获取有限。国内外学者已进行了有关Reg IV 在原核和酵母真核表达系统的研究[11-12],但未见在哺乳动物细胞表达系统的相关报道,而此系统在蛋白的起始信号、加工、分泌、糖基化方面具有独特优势,能够指导哺乳动物蛋白质的正确折叠,提供蛋白质表达所需的内源性翻译后修饰,还可提供接近天然的脂质环境,使产生的外源蛋白质在活性方面远胜于原核和酵母真核表达系统,更接近于天然蛋白质[13-14]。因此,本研究采用此表达系统进行Reg IV 蛋白的表达。
本研究通过基因工程技术成功构建了pCDNA3.4-REG4 质粒,并转染HEK 293T 细胞,结果显示重组人Reg IV 蛋白成功表达并定位于胞内,未分泌到细胞培养液上清中,而天然Reg IV 蛋白为小分子分泌性蛋白质,推测此重组蛋白在上清中检测不到的原因可能是更换的钟鼎信号肽不利于蛋白分子进入分泌通路,且蛋白本身不稳定易降解所致。重组人Reg IV 蛋白C 端具有6*His 标签,理论上可以与镍柱结合,在不同浓度咪唑缓冲液中被洗脱纯化,但实验发现此蛋白无法和柱材有效结合,一方面可能是His 标签暴露不全、降解,另一方面可能是重组蛋白分子量小,表达量低,与镍柱结合力弱所致。考虑到影响重组蛋白表达的因素较多,且Reg IV蛋白自身也不稳定,蛋白表达和纯化过程仍需进一步的摸索,本研究今后拟对细胞的悬浮培养、转染后培养策略以及纯化方法等方面进行进一步系统考察,从而提高靶蛋白的表达水平及蛋白纯度,以利于下游的应用研究。
综上所述,本研究成功构建了重组人Reg IV蛋白的哺乳动物细胞表达体系,并对目的蛋白进行了初步纯化鉴定,为后续开发临床应用试剂盒以及研究Reg IV 在肿瘤诊断和靶向治疗方面的应用奠定了良好的基础。
- 现代检验医学杂志的其它文章
- 急性肺栓塞患者血清ADAM15和MMP-2表达水平及其与疾病严重程度的相关性研究
- 肺炎支原体感染诱发哮喘患儿血清中miR-424-5p和CX3CL1表达水平及与预后预测价值研究
- ALKBH5调控GEFT的m6A修饰对胆管癌转移及EMT的实验研究
- LncRNA NNT-AS1通过调控miR-582-5p/NCKAP1轴激活Hippo-YAP/TAZ信号通路促进膀胱癌细胞增殖、迁移、侵袭和干细胞干性影响
- 血浆外泌体miR-4306表达水平联合CT征象对单发非实性肺结节良恶性鉴别的价值研究
- 白细胞介素-1β基因(rs16944)单核苷酸多态性与骨髓增生异常综合征易感性及临床特征的相关性研究

