ALKBH5调控GEFT的m6A修饰对胆管癌转移及EMT的实验研究
王希方,郑 伟,马东瑞,何 莉,孙晶莹,孙 杨,孟 莲,孙 超
(1.陕西省人民医院 a.肿瘤内科;b.肝胆外科;c.教学处;d.中心实验室;e.统计室,西安 710068;2.石河子大学医学院第一附属医院病理科,新疆石河子 832008)
胆管癌(cholangiocarcinoma,CCA)是肝脏第二大原发恶性肿瘤,约占肝脏原发恶性肿瘤的5%~30%,其在中国的发病率持续上升[1-3]。CCA发病时无突出的临床表现,因此初次诊断时多为终末期,目前迫切需要寻找到新的治疗方式[4]。上皮间充质转化(epithelial mesenchymal transition,EMT)参与CCA 的转移和复发,CCA 细胞通过EMT 获得了更具侵袭性的表型[6]。因此,通过调节EMT 来抑制转移可能是治疗CCA 的一个有效策略。鸟嘌呤核苷酸交换因子T(guanine nucleotide exchange factor T,GEFT),也称为Rho 鸟嘌呤核苷酸交换因子25,参与癌细胞的增殖、迁移和侵袭等多种过程[7]。先前的研究表明,GEFT 在某些恶性肿瘤中作为潜在的致癌基因发挥作用,例如乳腺癌和横纹肌肉瘤[8-9]。此外,GEFT 的高表达可促进EMT 过程[10]。但GEFT 在CCA 进展和转移方面的潜在功能和途径尚不清楚。越来越多的证据表明,6-甲基腺苷(6-Methyladenosine,m6A)甲基化作为一种重要的转录后基因调控机制,参与了CCA的发病机制[11-12]。alkB 同源蛋白5(alkB homolog 5,ALKBH5)是一种m6A 去甲基化酶,参与m6A修饰的调节,并控制各种细胞过程。ALKBH5 介导的m6A 去甲基化通过影响RNA 代谢中的多种事件(例如mRNA 剪切、修饰和翻译等)来调节基因表达。m6A 去甲基化酶ALKBH5 主要是通过以m6A 依赖的方式对致癌基因或抑癌基因进行转录后调节,在多种人类恶性肿瘤中发挥关键作用。据报道,ALKBH5 调节肝内CCA 中程序性死亡配体-1(programmed cell death 1 ligand 1,PD-L1)的表达和肿瘤免疫环境[13]。然而,目前关于m6A参与CCA 发病机制的研究仍十分有限。本研究旨在探讨ALKBH5 是否通过调控GEFT 的m6A 修饰水平来影响CCA 的转移及EMT。
1 材料与方法
1.1 研究对象 人胆管上皮癌细胞系(HuCCT1)购自美国ATCC。HuCCT1 细胞培养在添加10g/dl胎牛血清(fetal bovine serum,FBS)的RPMI 1640培养液中于5% (v/v)CO2,37℃环境中培养。
1.2 仪器与试剂 RPMI 1640 培养液(货号:11875093)和FBS(货号:10100147)购自美国Gibco 公司;阴性对照shRNA 慢病毒(NC-sh)、ALKBH5 shRNA 慢病毒(ALKBH5-sh)、阴性对照过表达慢病毒(NC-LV)、ALKBH5 过表达慢病毒(ALKBH5-LV)和GEFT shRNA慢病毒(GEFT-sh)购自吉玛基因。四甲基偶氮唑盐(MTT,货号:M8180-1)和GEFT(货号:K110033P)一抗购自北京索莱宝科技有限公司。Transwell(8 μm 孔径,货号:3422)购自美国Corning 公司;Annexin V-FITC/PI 试剂盒(货号:C1062M),Trizol(货号:R0016),RIPA 裂解液(货号:P0013D)和BCA 蛋白测试盒(货号:P0012)购自碧云天生物技术研究所。引物购自生工生物。逆转录试剂盒(货号:RR047Q)和TB Green Premix Ex Taq II(货号:RR820B)购自日本Takara 公司;β-actin 一抗(货号:ab8227)和HRP 标记的二抗(货号:ab6721)购自英国Abcam 公司;ALKBH5(货号:80283)一抗购自美国Cell Signaling Technology 公司;PolyA mRNA 纯化试剂盒(货号:S1560S)购自美国New England Biolabs 公司;RNA 甲基化免疫共沉淀试剂盒(货号:Bes5203-2)购自广州伯信生物科技有限公司。
1.3 方法
1.3.1 细胞培养及分组处理:将HuCCT1 细胞分为control 组、NC-sh 组、ALKBH5-sh 组、NC-LV组、ALKBH5-LV 组、ALKBH5-LV+NC-sh 组和ALKBH5-LV+GEFT-sh 组。将对数生长期的HuCCT1 细胞以2×105个细胞/孔的密度接种于6孔板,当细胞达到60%融合时,使用Lipofectamine 2000 试剂进行转染。control 组细胞正常培养不进行转染处理,NC-sh 组细胞转染阴性对照shRNA慢病毒,ALKBH5-sh 组细胞转染ALKBH5 shRNA慢病毒,NC-LV 组细胞转染阴性对照过表达慢病毒,ALKBH5-LV 组细胞转染ALKBH5 过表达慢病毒,ALKBH5-LV+NC-sh 组细胞同时转染ALKBH5 过表达慢病毒和阴性对照shRNA 慢病毒,ALKBH5-LV+GEFT-sh 组细胞同时转染ALKBH5 过表达慢病毒和GEFT shRNA 慢病毒,转染时间为48 h。通过RT-qPCR 验证转染效率。
1.3.2 细胞增殖测定:HuCCT1 细胞经过转染后,以5×103个细胞/孔的密度接种于96 孔板中,并在37℃条件下培养48 h,加入MTT 继续培养孵育4 h,弃上清。加入DMSO,室温缓慢摇晃10 min,然后于酶标仪490 nm 处测量吸光度A值。
1.3.3 细胞凋亡测定:HuCCT1 细胞经过转染后,以1×105个细胞/孔的密度接种在6 孔板中并在37℃培养48 h,PBS 重悬细胞。取5×104个HuCCT1 细胞8 000 r/min 离心5 min,弃上清,加入195 μl 结合缓冲液,再依次加入5 μl 的Annexin V-FITC 和10 μl 的PI,避光孵育5 min,使用流式细胞仪检测细胞凋亡率。
1.3.4 细胞迁移和侵袭测定:HuCCT1 细胞经过转染后,取1×104个HuCCT1 细胞重悬于200 μl 无血清培养液中,然后添加到Transwell 上室。将800 μl含20g/dl FBS的培养液加入到下室。孵育48 h后,4g/dl 多聚甲醛固定HuCCT1 细胞30 min,1g/dl结晶紫染色15 min。显微镜下进行迁移细胞计数。侵袭实验中,预先使用50 μl 的Matrigel(250 μg/ml)包被上室,其他步骤与迁移实验相同。
1.3.5 RT-qPCR 检测mRNA表达水平:采用RT-qPCR检测HuCCT1 细胞中的ALKBH5,GEFT,B 淋巴细胞瘤-2 相关X 蛋白(Bcl2-associated X,Bax),B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2),基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2),基质金属蛋白酶2(matrix metalloproteinase 9,MMP-9),上皮型钙黏蛋白(E-cadherin),神经型钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)的mRNA 表达水平。Trizol 提取各组细胞的总RNA,通过NanoDrop 2000 超微量分光光度计测定总RNA 的浓度和纯度,按照逆转录试剂盒进行逆转录反应。使用TB Green Premix Ex Taq Ⅱ在Bio-Rad CFX96 荧光定量PCR 仪上进行扩增。扩增条件如下:95℃ 5 min,95℃ 10 s,60℃ 20 s,72℃15 s,40 次循环。β-actin 作为内参,使用2-△△Ct法计算相对表达量,引物序列见表1。
1.3.6 Western blot 检测蛋白表达水平:采用Western blot 检测HuCCT1 细胞中的ALKBH5 和GEFT 的蛋白表达水平。RIPA 裂解HuCCT1 细胞提取总蛋白,通过BCA法测定总蛋白浓度,然后总蛋白(30 μg/泳道)上样,采用10g/dl SDS-PAGE 上进行电泳并转移到PVDF 膜上,5g/dl 脱脂牛奶封闭1 h,然后膜与ALKBH5(1∶3 000 稀释),GEFT(1:3000 稀释)和β-actin(1∶5 000 稀释)一抗4℃孵育过夜,再与HRP 标记的二抗(1∶5 000 稀释)室温孵育1 h,ECL 显影和凝胶成像。β-actin 作为内参。
1.3.7 甲基化RNA 免疫共沉淀结合qPCR 技术(MeRIP-qPCR)检测甲基化水平:采用MeRIPqPCR 检测HuCCT1 细胞中GEFT m6A 甲基化水平。Trizol 提取各组细胞的总RNA,通过PolyA mRNA 纯化试剂盒纯化总RNA。将m6A 抗体和IgG 的抗体分别添加到免疫共沉淀缓冲液中然后与蛋白质A/G 磁珠孵育1 h。将RNA 和磁珠-抗体复合物加入到免疫共沉淀缓冲液中4℃孵育过夜。使用洗脱缓冲液将结合的RNA 进行洗脱,然后用苯酚-氯仿提取纯化,并进行qPCR 分析。GEFT m6A 甲基化位点引物序列如下:F:5’-GTAC GCGGCCTAGAACTGCG-3’,R:5’-GTTTGCGGA CAGTTCGTACAG-3’。β-actin 作为内参。
1.4 统计学分析 使用GraphPad Prism 8.0 软件对数据进行统计分析和作图。细胞实验中每组设置6个复孔。计量资料以均数±标准差(±s)表示,多组间比较采用方差分析(ANOVA),组间两两比较采用LSD 检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 ALKBH5 和GEFT 对HuCCT1 细胞增殖的调控作用 见表2和图1。与control组和NC-sh组比较,ALKBH5-sh 组 的ALKBH5 mRNA,ALKBH5 蛋白,GEFT mRNA 和GEFT 蛋白水平均降低,差异具有统计学意义(F=684.705,756.058,339.612,662.205,均P<0.001)。与control 组和NC-LV 组比较,ALKBH5-LV 组的ALKBH5 mRNA,ALKBH5蛋白,GEFT mRNA 和GEFT 蛋白水平均升高,差异具有统计学意义(F=720.275,451.295,510.924,42.421,均P<0.001)。与ALKBH5-LV+NC-sh 组比较,ALKBH5-LV+GEFT-sh 组的GEFT mRNA 和GEFT蛋白水平均降低,差异具有统计学意义(t=16.215,9.454,均P<0.001)。各组细胞的相对细胞活力差异有统计学意义(F=223.258,P<0.001)。与control 组(100.00%±3.90%) 和NC-sh 组(100.57%±3.84%)比较,ALKBH5-sh 组(54.31%±5.64%)的相对细胞活力降低,差异具有统计学意义(F=205.415,均P<0.001)。与control 组(100.00%±3.90%)和NC-LV组(100.54%±3.31%)比较,ALKBH5-LV组(135.12%±4.86%)的相对细胞活力升高,差异具有统计学意义(F=146.451,均P<0.001)。与ALKBH5-LV+NC-sh组(129.29%±5.35%) 比较,ALKBH5-LV+GEFT-sh组(70.67%±5.72%)的相对细胞活力降低,差异具有统计学意义(t=18.333,,均P<0.001)。

图1 Western blot 检测各组HuCCT1 细胞中ALKBH5 和GEFT 蛋白表达水平
表2 各组HuCCT1 细胞中ALKBH5 和GEFT 的mRNA 和蛋白表达水平(±s)
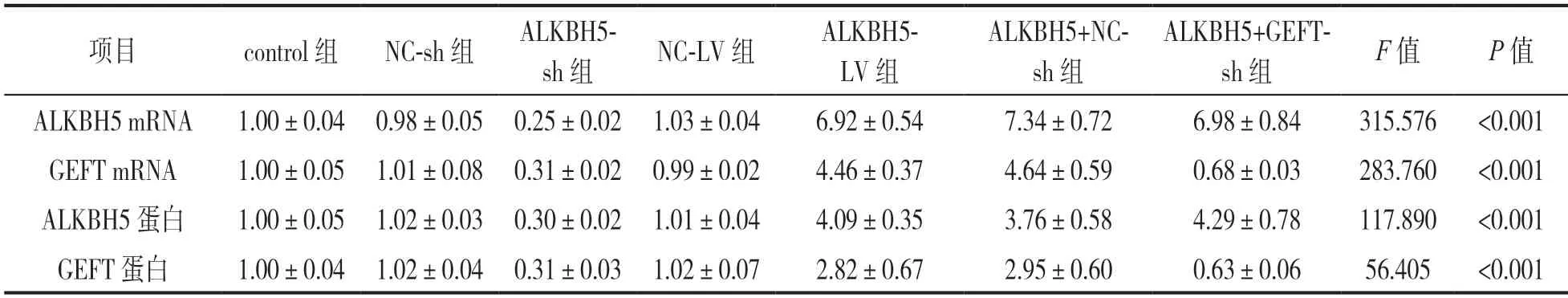
表2 各组HuCCT1 细胞中ALKBH5 和GEFT 的mRNA 和蛋白表达水平(±s)
项目control 组NC-sh 组ALKBH5-sh 组NC-LV 组ALKBH5-LV 组ALKBH5+NCsh 组ALKBH5+GEFTsh 组F 值P 值ALKBH5 mRNA1.00±0.04 0.98±0.05 0.25±0.02 1.03±0.046.92±0.547.34±0.726.98±0.84315.576<0.001 GEFT mRNA1.00±0.05 1.01±0.08 0.31±0.02 0.99±0.024.46±0.374.64±0.590.68±0.03283.760<0.001 ALKBH5 蛋白1.00±0.05 1.02±0.03 0.30±0.02 1.01±0.044.09±0.353.76±0.584.29±0.78117.890<0.001 GEFT 蛋白1.00±0.04 1.02±0.04 0.31±0.03 1.02±0.072.82±0.672.95±0.600.63±0.0656.405<0.001
2.2 ALKBH5 和GEFT 对HuCCT1细胞凋亡的调控作用 见表3 和图2。与Control 组和NC-sh 组比较,ALKBH5-sh 组的细胞凋亡率和Bax mRNA水平升高,Bcl-2 mRNA 水平降低,差异具有统计学意义(F=1995.868,340.917,321.576,均P<0.001)。与control 组和NC-LV 组比较,ALKBH5-LV 组的细胞凋亡率和Bax mRNA 水平降低,Bcl-2 mRNA 水平升高,差异具有统计学意义(F=71.031,225.970,217.678,均P<0.001)。与ALKBH5-LV+NC-sh 组比较,ALKBH5-LV+GEFTsh 组的细胞凋亡率和Bax mRNA 水平升高,Bcl-2 mRNA(0.69±0.09)水平降低,差异具有统计学意义(t=9.571,30.872,38.331,均P<0.001)。
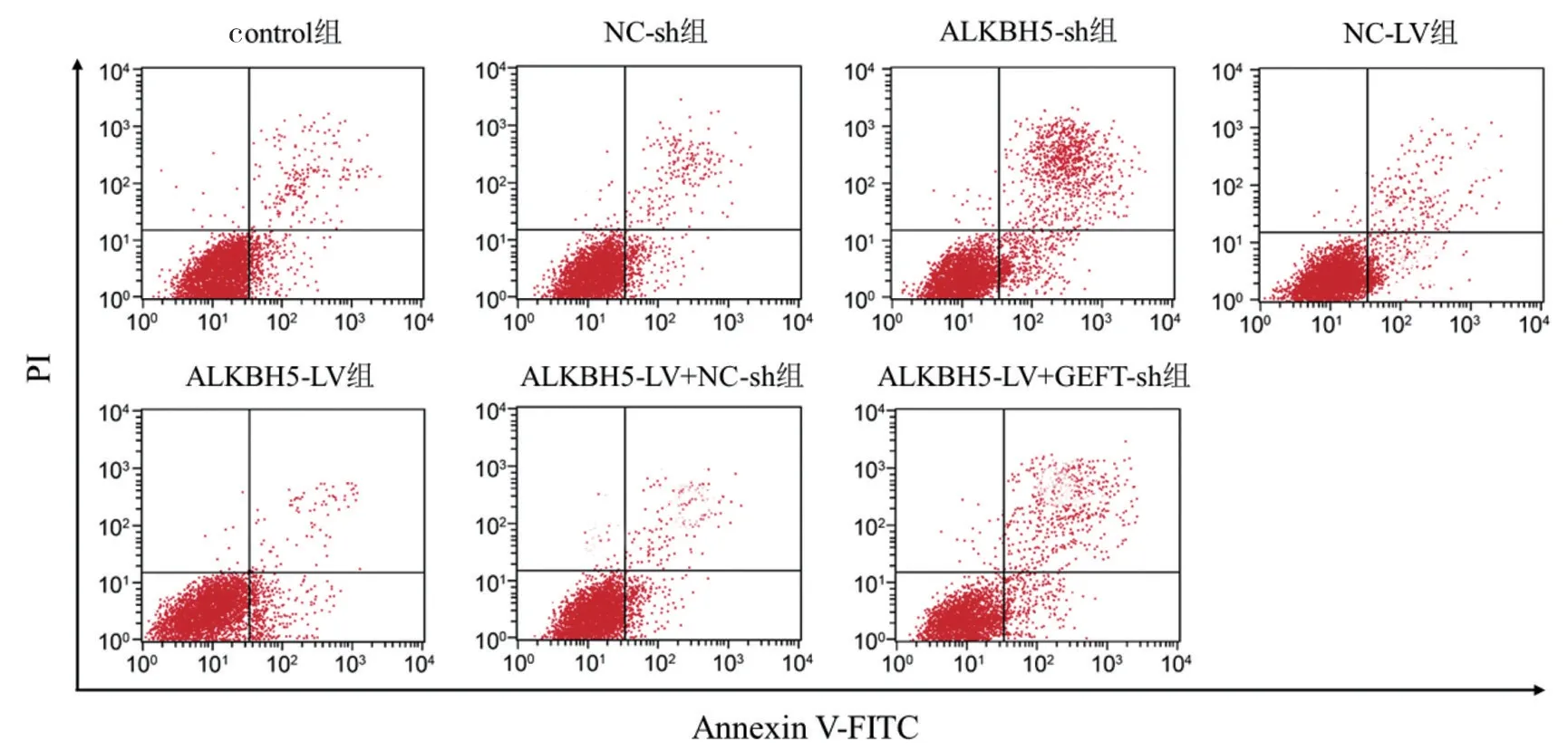
图2 流式细胞仪检测HuCCT1 细胞凋亡情况
表3 各组HuCCT1 细胞中细胞凋亡相关指标表达比较(±s)

表3 各组HuCCT1 细胞中细胞凋亡相关指标表达比较(±s)
项目control 组 NC-sh 组 ALKBH5-sh 组 NC-LV 组 ALKBH5-LV 组 ALKBH5+NC-sh 组 ALKBH5+GEFT-sh 组F 值P 值凋亡率(%) 5.05±0.48 4.82±0.40 27.88±1.10 5.16±0.58 2.51±0.02 2.50±0.03 6.77±1.091 085.899<0.001 Bax mRNA 1.00±0.04 0.98±0.07 5.34±0.57 0.97±0.05 0.45±0.05 0.46±0.04 1.34±0.06 361.734<0.001 Bcl-2 mRNA 1.00±0.05 1.04±0.04 0.48±0.03 1.03±0.08 4.22±0.52 4.39±0.22 0.69±0.10 293.694<0.001
2.3 ALKBH5 和GEFT 对HuCCT1 细胞迁移和侵袭的调控作用 见表4 和图3。与control 组和NC-sh组比较,ALKBH5-sh 组的迁移和侵袭细胞数量降低,差异具有统计学意义(F=76.763,43.347,均P<0.001)。与control 组和NC-LV 组比较,ALKBH5-LV 组的迁移和侵袭细胞数量升高,差异具有统计学意义(F=27.888,32.804,均P<0.001)。与ALKBH5-LV+NC-sh 组比较,ALKBH5-LV+GEFT-sh 组的迁移和侵袭细胞数量降低,差异具有统计学意义(t=7.704,7.175,均P<0.001)。与control 组和NC-sh 组比较,ALKBH5-sh 组的MMP2 和MMP9 mRNA 水平均降低,差异具有统计学意义(F=757.446,326.983,均P<0.001)。与control 组和NC-LV 组比较,ALKBH5-LV 组的MMP2 和MMP9mRNA 水平均升高,差异具有统计学意义(F=283.083,467.846,均P<0.001)。与ALKBH5-LV+NC-sh 组比较,ALKBH5-LV+GEFTsh 组MMP2 和MMP9 的mRNA 水平均降低,差异具有统计学意义(t=16.255,23.276,均P<0.001)。
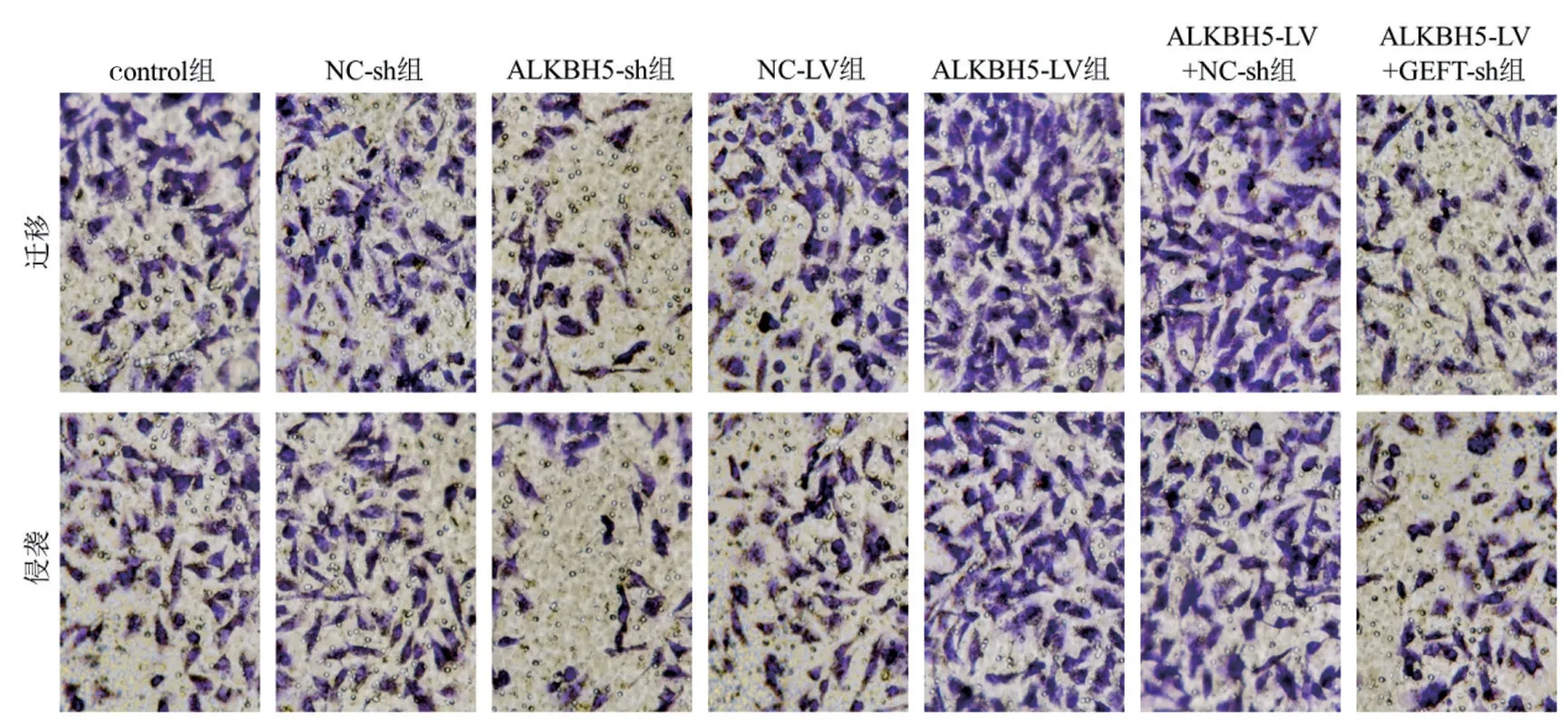
图3 ALKBH5 和GEFT 对HuCCT1 细胞迁移和侵袭的影响(×400 倍)
表4 各组HuCCT1 细胞中细胞迁移和侵袭数量及相关指标表达比较(±s)

表4 各组HuCCT1 细胞中细胞迁移和侵袭数量及相关指标表达比较(±s)
项目Control 组NC-sh 组 ALKBH5-sh 组 NC-LV 组 ALKBH5-LV 组ALKBH5+NC-sh 组ALKBH5+GEFT-sh 组F 值P 值迁移细胞数 59.53±7.18 66.09±5.36 29.33±3.15 64.94±4.52 84.76±6.48 82.33±8.1049.64±6.51355.181<0.001侵袭细胞数 49.59±6.73 53.53±7.28 24.99±1.07 45.66±5.40 70.34±4.70 73.58±9.8340.05±5.8658.628<0.001 MMP2 mRNA 1.00±0.05 0.99±0.030.36±0.02 1.01±0.03 2.00±0.13 1.94±0.150.81±0.0842.685<0.001 MMP9 mRNA 1.01±0.05 0.98±0.060.33±0.04 1.01±0.03 2.40±0.15 2.30±0.140.78±0.09459.758<0.001
2.4 ALKBH5 和GEFT 对HuCCT1 细胞EMT 的调控作用 见表5。与control 组和NC-sh 组比较,ALKBH5-sh 组的E-cadherin mRNA 水平升高,N-cadherin 和Vimentin mRNA 水平降低,差异具有统计学意义(F=201.298,504.058,317.305,均P<0.001)。与control 组和NC-LV 组比较,ALKBH5-LV 组的E-cadherin mRNA 水平降低,Ncadherin 和Vimentin 水平升高,差异具有统计学意义(F=617.990,175.551,215.997,均P<0.001)。与ALKBH5-LV+NC-sh 组比较,ALKBH5-LV+GEFTsh 组的E-cadherin mRNA 水平升高,N-cadherin 和Vimentin mRNA 水平降低,差异具有统计学意义(t=16.598,77.872,16.728,均P<0.001)。
表5 各组HuCCT1 细胞中E-cadherin,N-cadherin 和Vimentin 的mRNA 表达水平(±s)

表5 各组HuCCT1 细胞中E-cadherin,N-cadherin 和Vimentin 的mRNA 表达水平(±s)
项目Control 组NC-sh 组ALKBH5-sh 组 NC-LV 组 ALKBH5-LV 组ALKBH5+NC-sh 组ALKBH5+GEFT-sh 组F 值P 值E-cadherin1.00±0.021.02±0.055.29±0.741.01±0.030.43±0.050.41±0.011.40±0.15213.718<0.001 N-cadherin1.00±0.030.98±0.050.37±0.031.00±0.094.72±0.684.49±0.110.69±0.06298.279<0.001 Vimentin1.00±0.070.97±0.040.38±0.030.98±0.063.39±0.393.58±0.410.69±0.10216.860<0.001
2.5 ALKBH5 对HuCCT1 细胞GEFT m6A 甲基化修饰的影响 各组细胞的GEFT m6A 甲基化水平差异具有统计学意义(F=232.230,P<0.001)。与control 组(1.00±0.032)和NC-sh 组(1.02±0.028)比较,ALKBH5-sh 组(3.42±0.440)的GEFT m6A甲基化水平升高,差异具有统计学意义(F=177.365,均P<0.001)。与control 组(1.00±0.032)和NC-LV组(0.99±0.055)比较,ALKBH5-LV组(0.41±0.033)的GEFT m6A 甲基化水平降低,差异具有统计学意义(F=399.929,均P<0.001)。
3 讨论
m6A 甲基化作为一种重要的转录后基因调控机制,参与了CCA 的发病机制[11-12]。m6A 甲基化失调可引起RNA 代谢缺陷[14]。ALKBH5 是一种m6A去甲基化酶,负责将甲基从腺嘌呤上去除,介导RNA 的去甲基化修饰过程。ALKBH5 介导的基因转录后调控对于正常生理和病理生理事件都至关重要。研究表明,ALKBH5 可以调节癌症的表观转录组,引起细胞增殖、存活、侵袭和转移、药物敏感性、癌症干细胞状态和癌症免疫的改变[15]。在人肝内CCA 细胞系中,ALKBH5 去除了PD-L1 mRNA 的3’UTR 中的m6A 修饰,并以YTH 结构域N6-甲基腺嘌呤RNA 结合蛋白2 依赖性方式减少PD-L1 降解,从而促进了PD-L1 的表达,抑制了T 细胞的细胞毒性并介导肝内CCA 细胞的免疫逃逸[13]。本研究表明,下调ALKBH5 抑制了HuCCT1 细胞的增殖、迁移和侵袭,并诱导了细胞凋亡,升高了促凋亡基因Bax 的mRNA 水平,降低了抗凋亡基因Bcl-2 的mRNA 水平,降低了癌细胞转移相关基因MMP2和MMP9 的mRNA 水平。而上调ALKBH5 则效果相反。这些结果提示ALKBH5 在CCA 中属于一种致癌基因,其高表达增加了CCA 细胞的活性和转移能力。
m6A 修饰可能为CCA 临床治疗提供新的途径,但目前关于m6A 参与CCA 发病机制的研究仍十分有限,尚无与CCA 细胞中GEFT m6A 修饰有关的研究。近年来临床研究发现,GEFT 表达与肿瘤细胞的病理分级和预后相关。GEFT 在横纹肌肉瘤中表达上调,下调GEFT 的表达可抑制横纹肌肉瘤细胞增殖、侵袭和迁移,并诱导细胞凋亡[8]。GEFT的过表达可提高横纹肌肉瘤细胞的增殖、迁移和侵袭能力,抑制细胞凋亡[10]。与正常肠黏膜相比,结直肠癌组织中GEFT 的表达增加,并且GEFT 高表达的结直肠癌患者预后较差,GEFT 的高表达与CRC 中的淋巴结转移相关[10]。GEFT 在结肠癌等许多恶性肿瘤中均有异常表达[16],GEFT 的表达与肿瘤细胞的病理分级和预后相关[17]。本研究结果显示,下调ALKBH5 表达水平抑制了HuCCT1 细胞中GEFT 的表达,上调ALKBH5 表达水平则促进了GEFT 的表达。进一步研究证实,下调GEFT 未影响HuCCT1 细胞中ALKBH5 的表达,但逆转了ALKBH5 对HuCCT1 细胞增殖、迁移、侵袭和凋亡的影响。这些结果证实ALKBH5 可能通过调控GEFT 来影响CCA 的发生发展。
抑制EMT 是抑制肿瘤转移的关键。EMT 过程中,上皮细胞失去细胞极性,上皮细胞骨架发生重组,失去与基底膜的连接,同时癌细胞分泌大量MMP-2 和MMP-9 降解细胞外基质[18],导致癌细胞获得了更高的迁移和侵袭能力[19]。在CCA 中EMT参与转移和复发,因此,通过调节EMT 来抑制肿瘤转移可能是治疗CCA 的有效策略。本研究结果显示,下调ALKBH5 表达水平抑制了HuCCT1 细胞的EMT 过程,而上调ALKBH5 表达水平则促进了EMT 过程。进一步研究证实,下调GEFT 逆转了ALKBH5 对HuCCT1 细胞EMT 的影响。这些结果证实ALKBH5 通过调控GEFT 来影响CCA 的EMT 过程。其他文献报道,GEFT 上调了横纹肌肉瘤细胞中N-cadherin,Snail,Slug,Twist,Zeb1 和Zeb2 的表达水平,并降低了E-cadherin 的表达水平,GEFT 通过激活Rac1/Cdc42 PAK 信号通路诱导的EMT来加速横纹肌肉瘤细胞的肿瘤发生和转移[10]。ALKBH5 促进乳腺浸润性导管癌侵袭和转移可能与增强EMT 和血管生成有关[20],亦支持本研究结果。
m6A 甲基化参与调节CCA 的EMT 过程[11,21]。其他文献报道,横纹肌肉瘤细胞中GEFT 基因启动子甲基化水平低于正常横纹肌组织[10]。RNA m6A 甲基化抑制了胶质母细胞瘤中的EMT 过程,ALKBH5通过降低RNA m6A 甲基化水平在体内增强了胶质母细胞瘤的生长并增强了胶质瘤的EMT 过程[22]。本研究结果显示,下调ALKBH5 表达水平升高了HuCCT1 细胞GEFT m6A 甲基化水平,而上调ALKBH5 表达水平则降低了GEFT m6A 甲基化水平。这些结果说明ALKBH5 可能通过调控GEFT m6A 甲基化修饰来影响CCA 的转移及EMT。
综上所述,本研究表明ALKBH5 和GEFT 均促进CCA 细胞的生长和转移,ALKBH5 可能通过调控GEFT m6A 甲基化修饰来影响CCA 的转移及EMT过程。本研究创新性地剖析ALKBH5 参与CCA 的EMT 发生的具体机制,与GEFT m6A 甲基化修饰相结合,进一步深入探索这两者之间的关系,为深入探究CCA 发生发展的分子机制打开了新视野。

