慢性肾病Ⅲ~Ⅴ期患者血清Klotho,OTA和Bcl-3表达水平与疾病预后的相关性研究
宋 强,李永钢(内蒙古包钢医院检验科,内蒙古包头 014010)
慢性肾病(chronic kidney disease,CKD)可发展为终末期肾病,需肾脏替代治疗[1-2]。虽然肾小球滤过率能反映CKD 的疾病程度,但贫血、脑卒中等疾病可降低肾小球滤过率,影响评估准确性[3]。Klotho 蛋白是参与尿磷酸盐排泄过程的蛋白[4]。FREUNDLICH 等[5]研究发现,CKD 患者血清中Klotho 水平下降,有助于CKD 的早期诊断。赭曲霉毒素A(Ochratoxin A,OTA)是由青霉属和曲霉属菌产生的次级代谢物,具有肝肾毒性、致畸和免疫毒性[6]。研究发现,CKD 患者血清OTA 水平升高,具有促进凝血、抑制免疫等作用,促进CKD疾病进展[7-8]。B 细胞淋巴瘤因子3(B-cell lymphoma factor 3,Bcl-3)是IκB 家族的成员[9]。BARINOTTI等[10]发现,CKD 患者血清Bcl-3 表达升高,与肾纤维化程度有关,是反映CKD 疾病进展的血清标志物。目前CKD Ⅲ~Ⅴ期患者血清Klotho,OTA 和Bcl-3 表达的临床意义尚不清楚。本研究通过研究CKD Ⅲ~Ⅴ期患者血清Klotho,OTA 和Bcl-3 表达与肾功能及预后的关系,为临床诊治提供参考价值。
1 材料和方法
1.1 研究对象 选取内蒙古包钢医院自2018 年1月~2019 年1 月期间收治的原发性CKD Ⅲ~Ⅴ期患者118 例为研究对象。纳入标准:①CKD 的诊断符合2002 年美国国家肾脏基金会制定的K/DOQI(Kidney Disease Outcome Quality Initiative)指南中的标准[11];②年龄≥18 岁,CKD 病史>6 个月,估计肾小球滤过率(estimated glomerular filtration rate,eGFR)<60ml/min;③临床病历资料完整;④患者无精神障碍性疾病,能够配合相关检查及随访。排除标准:①继发性肾病,如糖尿病肾病、高血压肾病、狼疮性肾炎等;②eGFR ≤5 ml/min,已开始透析的CKD 患者或预计短期内(≤3 个月)将进行透析治疗;③伴有自身免疫性疾病,糖皮质激素用药史或长期服用免疫抑制剂史等;④并发急性肾损伤、急性肾衰竭等疾病;⑤伴有其它肾脏疾病,如多囊肾、孤立肾等。CKD 患者病程2~13年,其中男性78 例,女性40 例;年龄45~68(58.18±3.63)岁;体质量指数(body mass index,BMI)22.27±2.30 kg/m2;参考K/DOQI 中CKD 诊断标准[11]:CKD Ⅲ期51 例,CKD Ⅳ期47 例,CKDⅤ期20 例。以同期我院健康查体的健康者60 例为对照组,其中男性37 例,女性23 例;年龄43~67(57.74±2.30)岁;BMI 22.41±2.29 kg/m2。两组在性别、年龄、体质量指数之间差异无统计学意义(均P>0.05)。患者对本研究知情同意并签署知情同意书,本研究已获得伦理委员会批准通过。
1.2 仪器与试剂 人Klotho ELISA 试剂盒(上海梵态生物公司,货号FT-P31156R)。OTAELISA 试剂盒(上海研域生物公司,货号398637)。人Bcl-3 ELISA 试剂盒(上海臻科生物公司)。采用赛默飞 Varioskan LUX 酶标仪进行测定。
1.3 方法
1.3.1 血清Klotho,OTA,Bcl-3 水平检测:留取CKD 组患者治疗前及对照组清晨空腹静脉血5ml,3 000 r/min 离心10min,取血清于-20℃保存待用。采用酶联免疫吸附实验(双抗体夹心法)检测血清Klotho,OTA 和Bcl-3 水平。实验步骤按说明书进行,酶标仪检测各孔A450nm值,并根据标准品浓度的A值,计算每孔样品的浓度值。以血清Klotho,OTA 和Bcl-3 水平的均值2.54 mg/L,2.11 mg/L 和81.25 pmol/L为临界值,分为Klotho高表达组(n=60)和低表达组(n=58),OTA 高表达组(n=59)和低表达组(n=59),Bcl-3 高表达组(n=60)和低表达组(n=58)。
1.3.2 观察指标:收集所有研究对象性别、年龄、体质量指数(body mass index,BMI)、高血压史等一般临床资料,收集患者入院后第一天24 h 尿蛋白量、血红蛋白、清蛋白、总胆固醇、三酰甘油、血肌酐、尿素氮、血尿酸和血磷等实验室检查指标。应用肾脏病饮食改良研究公式(the modification of diet in renal disease equation,MDRD)计算eGFR=186×(Scr/88.4)-1.154×年龄-0.203×0742(女性)。
1.3.3 随访:以入组时间为起点,对所有CKD 患者进行随访,每三个月随访一次,以门诊或电话方式进行随访,随访内容为患者需要肾脏替代治疗或死亡,记录肾脏存活情况,随访截止时间为2022年3 月30 日。
1.4 统计学分析 采用SPSS 20.0 统计软件进行数据分析。符合正态性分布的计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验,三组间均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。计数资料以率(%)表示,组间比较采用卡方检验。相关性分析采用Pearson相关性分析。用Kaplan-Meier 生存分析(Log-Rank检验)血清Klotho,OTA和Bcl-3水平对CKD Ⅲ~Ⅴ期患者肾脏存活率的影响。单因素及多因素COX回归分析影响CKD Ⅲ~Ⅴ期患者肾脏结局事件发生的因素。P<0.05 为差异具有统计学意义。
2 结果
2.1 各组一般资料及血清Klotho,OTA 和Bcl 3 水平比较 见表1。CKD 组高血压史、血肌酐、尿素氮、血尿酸、血磷、24h 尿蛋白量、OTA 及Bcl-3高于对照组,而血红蛋白、清蛋白、eGFR,Klotho低于对照组,差异具有统计学意义(均P<0.05)。
表1 各组一般资料及血清Klotho,OTA,Bcl-3水平比较(±s)
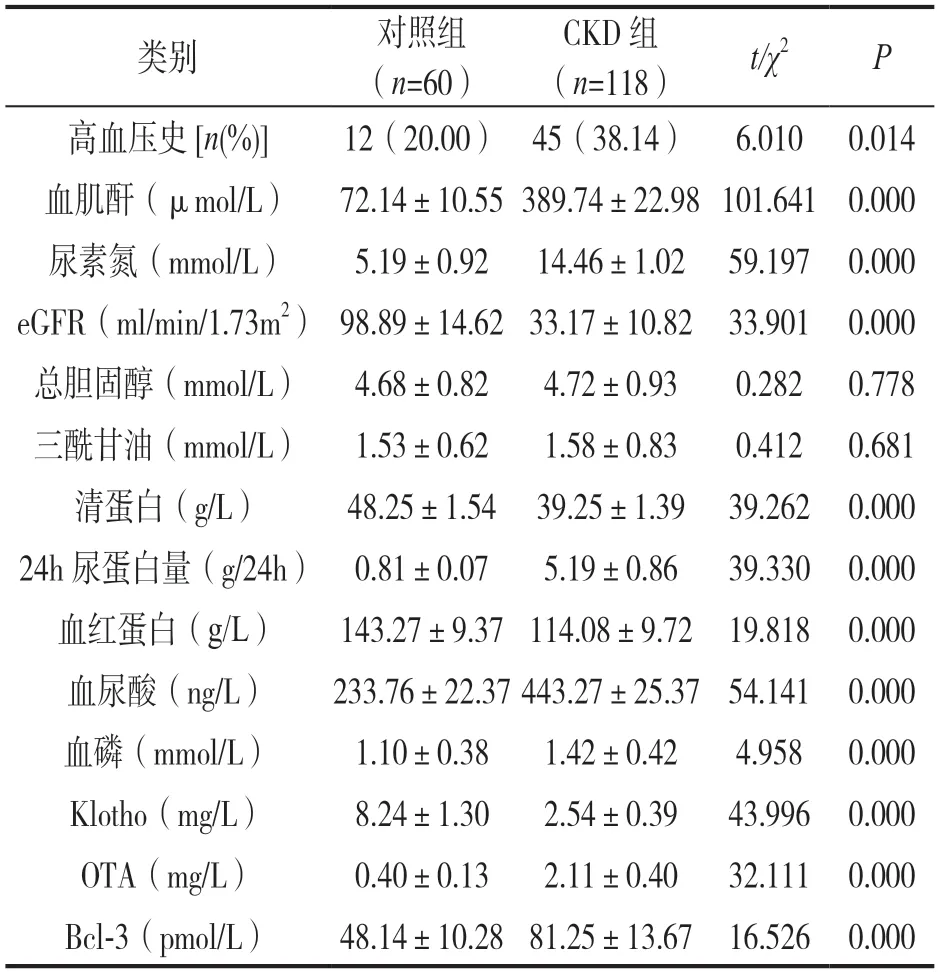
表1 各组一般资料及血清Klotho,OTA,Bcl-3水平比较(±s)
类别对照组(n=60)CKD 组(n=118)t/χ2P高血压史[n(%)]12(20.00) 45(38.14) 6.010 0.014血肌酐(μmol/L) 72.14±10.55 389.74±22.98 101.641 0.000尿素氮(mmol/L)5.19±0.92 14.46±1.02 59.197 0.000 eGFR(ml/min/1.73m2) 98.89±14.62 33.17±10.82 33.901 0.000总胆固醇(mmol/L)4.68±0.824.72±0.930.282 0.778三酰甘油(mmol/L)1.53±0.621.58±0.830.412 0.681清蛋白(g/L)48.25±1.54 39.25±1.39 39.262 0.000 24h 尿蛋白量(g/24h) 0.81±0.075.19±0.8639.330 0.000血红蛋白(g/L)143.27±9.37 114.08±9.72 19.818 0.000血尿酸(ng/L)233.76±22.37 443.27±25.37 54.141 0.000血磷(mmol/L)1.10±0.381.42±0.424.958 0.000 Klotho(mg/L)8.24±1.302.54±0.3943.996 0.000 OTA(mg/L)0.40±0.132.11±0.4032.111 0.000 Bcl-3(pmol/L)48.14±10.28 81.25±13.67 16.526 0.000
2.2 不同CKD 分期患者血清Klotho,OTA 和Bcl-3水平比较 见表2。不同CKD 分期患者血清Klotho,OTA 和Bcl-3 比较,差异具有统计学意义(均P<0.05)。CKD 分期越高,血清Klotho 越低,血清OTA,Bcl-3 越高。CKD Ⅴ期患者血清Klotho,OTA 和Bcl-3 水平明显高于CKD Ⅳ期和CKD Ⅲ期患者,差异均有统计学意义(q=20.147,28.709,9.433,13.920; 11.287,15.545,均P=0.000)。CKD Ⅳ期患者血清Klotho,OTA 和Bcl-3 水平明显高于CKD Ⅲ期患者,差异具有统计学意义(q=10.858,5.709,5.381,均P=0.000)。
表2 不同CKD 分期患者血清Klotho,OTA,Bcl 3 水平比较(±s)
项目CKD Ⅲ期(n=51)CKD Ⅳ期(n=47)CKD Ⅴ期(n=20)FP Klotho(mg/L)3.13±0.372.53±0.411.06±0.37206.0710.000 OTA(mg/L)1.80±0.382.13±0.412.85±0.4548.5440.000 Bcl-3(pmol/L)71.49±10.6180.90±12.66106.96±14.8760.4460.000
2.3 血清Klotho,OTA,Bcl 3 与肾功能指标的相关性 见表3。CKD 组患者中,血清Klotho 与eGFR 呈显著正相关(r=0.627),血清OTA,Bcl-3与eGFR 呈显著负相关(r=-0.537,-0.489,均P<0.05)。血清Klotho 表达与OTA,Bcl-3 表达呈显著负相关(r=-0.689,-0.703,均P<0.05)。

表3 血清Klotho,OTA,Bcl-3 与肾功能指标的相关性
2.4 血清Klotho,OTA 和Bcl 3 水平对CKD Ⅲ~Ⅴ期患者的预后影响 随访6~36 个月,平均随访时间21.58±6.12 个月,47 例患者发生肾脏结局事件,肾脏存活71 例,肾脏存活率为60.17%(71/118)。低Klotho 组肾脏存活率为44.83%(26/58),低于高Klotho 组的75.00%(45/60),差异具有统计学意义(Log rankχ2=6.988,P=0.008);高OTA 组肾脏存活率为40.68%(24/59),低于低OTA 组的79.66%(47/59),差异具有统计学意义(Log rankχ2=7.247,P=0.000);高Bcl-3 组肾脏存活率为46.67%(28/60),低于低Bcl-3 组的74.14%(43/58),差异具有统计学意义(Log rankχ2=7.198,P=0.000),见图1。
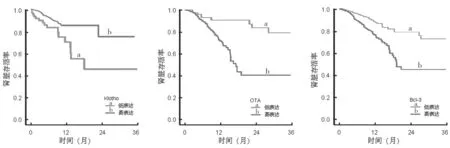
图1 Kaplan Meier 曲线分析血清Klotho,OTA,Bcl 3 对肾脏存活率的影响
2.5 单因素及多因素COX 回归分析影响肾脏结局事件的因素 见表4,5。24h 尿蛋白量升高,eGFR 降低、血清Klotho 降低,OTA 升高,Bcl-3升高是影响CKD Ⅲ~Ⅴ期患者肾脏结局事件发生的独立危险因素。

表4 单因素COX 回归分析影响肾脏结局事件发生的因素

表5 多因素COX 回归分析影响肾脏结局事件发生的因素
3 讨论
我国CKD 疾病负担重,患病率约为10.8%,其中CKD Ⅲ~Ⅴ期患病率相对较低,但更容易进展为终末期肾病,需要接受肾脏替代治疗维持机体内环境稳定[12]。目前CKD 尚无有效的防治手段,早诊断、早治疗及预后预测对于提高CKD 患者的肾脏存活率至关重要。CKD 的病因多样,包括高血压、糖尿病及急性肾损伤等已知病因,也可由环境中的有毒物质等因素导致。各种因素引起肾内外细胞的氧化应激、炎症性损伤,导致肾间质中成纤维细胞的活化、肾小球硬化等病理改变,促进CKD 向终末期肾病的发展。深入研究CKD 的病因及疾病机制,识别CKD 尤其是CKD Ⅲ期以上患者肾功能进展的危险因素,有助于临床早期识别高危患者。
Klotho 蛋白是一种单跨膜蛋白,其细胞外结构域可以被金属蛋白酶切割释放到血清、尿液和脑脊液等体液中被检测到。功能上,Klotho 是一种肾脏保护因子,参与维持钙磷平衡调节,并作为一种抗炎因子抑制肾纤维化发挥其保护肾功能的生物学效应[13]。本研究中,CKD 患者血清Klotho 水平降低,这与FREUNDLICH 等[5]学者研究报道一致,该研究证实在CKD 患者早期即出现血清和尿液中Klotho 水平降低,是早期诊断CKD 的生物标志物。CKD 中Klotho 水平降低的机制可能与转录后调控异常有关。MENCKE 等[14]发现,多种有害刺激诱导肾小管上皮细胞损伤后,无义mRNA 降解因子能够促进Klothom RNA 降解,导致Klotho 蛋白的翻译和分泌减少。本研究发现,CKD 分期越高,血清Klotho 水平降低更为明显,提示血清Klotho水平能够反映CKD 疾病严重程度。LIU 等[15]发现,Klotho 作为成纤维细胞生长因子23 受体的共受体,其表达下调抑制成纤维细胞生长因子23 及下游细胞外信号调节激酶1/2 通路,导致磷酸钠协同转运蛋白表达缺失,近端肾小管上皮细胞不能排泄磷酸盐,导致血磷升高,加重肾功能损伤。此外,Klotho 的表达降低能够促进转化生长因子β 结合到转化生长因子β Ⅱ受体,诱导肾小管上皮细胞发生上皮间质转化,促进肾纤维化[16]。本研究发现,Klotho 低表达的CKD 患者肾脏存活率较低,并且Klotho 低表达是CKD Ⅲ~Ⅴ期患者发生肾结局事件的独立危险因素,表明检测血清Klotho 水平有助于判断CKD Ⅲ~Ⅴ期患者的临床预后,可能是新的预后判断的血清标志物。FREUNDLICH 等[5]学者报道,通过外源性的补充Klotho 或内源性过表达Klotho 能够抑制肾脏纤维化的发生,延缓CKD 的疾病进展。因此,以Klotho 为靶点的临床治疗可能有助于延缓CKD Ⅲ~Ⅴ期患者的疾病进展,增加肾脏存活率,减少肾结局事件的发生,是潜在的临床治疗方案,值得深入研究。
OTA 作为一种真菌毒素,进入机体后主要在胃和近端空肠被吸收,未吸收的OTA 可以到达后肠与肠道菌群相互作用,产生有毒代谢产物,对肾功能造成损伤[17]。近年来发现,血清OTA 在肾结石、慢性肾衰竭及透析患者中表达升高,其表达升高通过激活核因子kB 通路,诱导促炎症微环境,加重肾脏炎症病理损伤[8]。本研究中,CKD 患者血清OTA 显著升高,其原因一方面是CKD 患者胃肠道黏膜上皮细胞功能障碍,肠黏膜上皮细胞完整性破坏、黏液屏障的丧失及肠道菌群失调,均导致OTA 吸收增加[18]。另一方面,由于肾脏是OTA 的主要排泄器官,CKD 患者肾小球滤过率的下降导致血清OTA 水平的升高。本研究中,CKD 分期越高,血清OTA 水平升高越明显,提示血清OTA 升高与CKD 疾病严重程度有关。其机制是OTA 能够激活肾纤维化基因如α-SMA及波形蛋白等的表达,促进肾纤维化的发生,加重肾功能损伤[19]。此外,OTA 还能够通过激活NOD 样受体3 炎症小体,促进肾小管上皮细胞发生细胞焦亡,白介素1β 及白介素18 等大量促炎细胞因子释放,加重肾脏炎症反应,促进肾脏功能的恶化[19]。本研究进一步分析发现血清OTA 高表达CKD 患者肾脏存活率较低,提示检测血清OTA 水平有助于CKD Ⅲ~Ⅴ期患者预后预测。DU 等[20]在肾小球系膜细胞和肾小管上皮细胞中进行了体外实验,发现无毒浓度的OTA(0.25 mg/kg)能够激活转化生长因子-β1/SMAD家族成员2 通路,加重阿霉素的细胞毒性及肾纤维化的发生,并在小鼠肾病模型进一步证实,OTA 增加了肾病小鼠中纤维化因子、α-平滑肌肌动蛋白和波形蛋白的表达,诱导的肾纤维化加重,肾损伤加重。因此,血清OTA 是一种新的CKD Ⅲ~Ⅴ期患者预后相关血清标志物,值得临床关注。
Bcl-3 编码基因位于19q13.32,编码蛋白是一种转录共激活因子,通过结合核因子kB,发挥调控下游靶基因表达的作用,广泛参与炎症、肿瘤及CKD 等疾病的病理生理学过程[10,21]。本研究发现,CKD 患者血清Bcl-3 表达升高,其机制尚不清楚,可能是转化生长因子β 信号通路的激活促进Bcl-3 表达。BARINOTTI 等[10]学者在单侧输尿管梗阻的动物模型中发现,在肾梗阻纤维化早期,肾小管上皮细胞损伤凋亡后Bcl-3 释放到血清中,导致血清Bcl-3 水平升高。此外,梗阻肾组织中转化生长因子β 表达升高能够促进Bcl-3 的表达,导致下游肾纤维化基因如α-平滑肌肌动蛋白表达上调,导致肾功能恶化[10]。本研究中,血清Bcl-3 水平与CKD 疾病严重程度有关,且与eGFR 呈显著正相关,与BARINOTTI 等[10]学者报道一致,提示血清Bcl-3 水平升高参与促进CKD 的疾病进展。Bcl-3 能够通过激活转化生长因子β 信号通路的传导,促进肾纤维化。CARR 等[22]研究发现,Bcl-3与SMAD 家族成员3 结合并保护SMAD 家族成员3 免于泛素化和降解,进而激活转化生长因子β 信号通路,促进肾小管细胞发生上皮间质转化及肾间质纤维化,导致CKD 疾病进展。本研究中,血清Bcl-3 高表达CKD 患者肾脏存活率较低,是影响肾结局事件发生的独立危险因素。因此,Bcl-3 是一种新的反映CKD 疾病进展的血清标志物,有助于评估CKD Ⅲ~Ⅴ期患者的临床预后。本研究中,血清Klotho 与OTA,Bcl-3 表达呈显著负相关。研究表明,核因子kB 能够抑制肾小管上皮细胞Klotho 的表达,而Bcl-3 作为核因子kB 的辅因子,在促炎因子的刺激下能够增强核因子kB 的表达及活性,进而抑制Klotho 的表达[23]。此外,OTA 的肾毒性损伤肾小管上皮细胞,并促进白介素1β,白介素-6 等促炎因子的释放,而这些促炎因子能够激活核因子E2 相关因子2,抑制抗衰老因子Klotho 的表达,促进细胞衰老[24]。但三者之间的关系及在CKD 中的作用机制有待今后深入探索。
综上所述,CKD Ⅲ~Ⅴ期患者血清Klotho 水平降低,OTA 和Bcl-3 水平升高,血清Klotho,OTA 和Bcl-3 水平与eGFR 有关,有助于反映CKDⅢ~Ⅴ期患者疾病严重程度。血清 Klotho 降低,OTA 升高,Bcl-3 升高是影响CKD Ⅲ~Ⅴ期患者肾脏结局事件发生的独立危险因素,为预后评估提供参考价值。但本研究样本量有限,未对CKD Ⅲ~Ⅴ期患者进行分层分析,有待今后设计多中心临床试验,扩大样本量进一步验证本研究的结论。

