速率法检测血清α-L-岩藻糖苷酶(AFU)改良试剂中添加烷基糖苷的实验性能评价
崔 倩,耿志欣,吴 娟,王梦林,裴 兵
(南京医科大学附属宿迁市第一人民医院医学检验科,江苏宿迁 223800)
α-L 岩藻糖苷酶(α-L-fucosidase,AFU)是催化α-L 岩藻糖苷键水解的酶,在人体各组织细胞和体液中可以检测出,是近年来确立的诊断肝癌的敏感指标[1]。检测结果降低见于遗传性α-L-岩藻糖苷酶缺乏引起的岩藻糖积蓄病。检测结果升高见于原发性肝癌、转移性肝癌、肝硬化和急性肝炎等疾病[2]。AFU 的测定方法有荧光法、比色法、速率法等,前两者难以自动化,目前很少使用。其中速率法检测时标本中内源性干扰物胆红素、血红蛋白、乳度等对测定结果有一定的影响[3],主要原因是稳定剂的结合机制导致。我们使用进口原装AFU试剂比国内同种试剂性能稳定的原因是采用一种类似表面活性物质[4]。据文献报道[5],烷基糖苷(alkyl polyglucoside,APG)配伍性能好,能与各种离子型、非离子型表面活性剂复配。APG 与非离子表面活性剂相比,具有临界胶束浓度高、可用透析法除去、蛋白质不易变性、紫外线穿透性能高等优点,因而APG 在膜蛋白的增溶、再构成的生物化学领域作用效果好[6],本文选取APG 作为改良试剂的表面活性剂,起到增加该试剂的性能稳定性。
1 材料与方法
1.1 研究对象 选取2022 年9~10 月在南京医科大学附属宿迁市第一人民医院就诊患者的AFU血清低、中、高值分别为18±0.2,62±0.5 和210±0.8U/L,血清样本200 份进行双检测值验证。其中男性100 例,女性100 例,年龄18~75(43.53±3.27)岁,患者年龄、性别等一般资料比较,差异无统计学意义(t=0.845,0.914,均P>0.05)。
1.2 仪器与试剂 仪器:可调式移液器、磁力搅拌器、酸度计、分析天平(上海精学科学仪器有限公司);贝克曼全自动生化仪 AU5800(海尔施生物医药股份有限公司)。试剂:α-L-岩藻糖苷酶测定试剂盒(CNPF 底物法)[批号:20220106S,骏实生物科技(上海)有限公司];进口AFU 试剂[批号:20220109M,贝克曼库尔特(苏州)有限公司];质控品(高值批号20220503,中值批号20220502,低值批号20220701,上海昆涞生物科技有限公司);抗坏血酸12g/L,胆红素550μmol/L,脂血指数0.5mg/L,血红蛋白3g/L(武汉生之源生物科技有限公司)。
1.3 方法
1.3.1 改良试剂:使用分析天平称取APG,用可调式移液器调整APG 浓度在2mmol/L,测定酸碱度,磁力搅拌器混合后加入R1 试剂[枸椽酸盐缓冲液(100mmol/L),烷基糖苷(2mmol/L)]和R2 试剂[枸椽酸盐缓冲液(100mmol/L),2-氯-4-硝基苯-α-L-岩藻糖苷(5mmol/L)],进行分装备用。
1.3.2 精密度验证:依据NCCLS(EP5-A2)在全自动贝克曼全自动生化仪 AU5800 进行两种AFU 试剂的精密度验证。选用患者AFU 低、中、高值血清样本浓度分别为18±0.2,62±0.5 和210±0.8U/L,每份样本同日内重复检测20 次以验证批内不精密度,连续测定20 天,每天上、下午各测定2 次,用于评估批间及日间不精密度。计算各参数的变异系数。
1.3.3 线性实验:依据NCCLS(EP6-A)的方法,分别取购买自Sigma 公司的α-L-岩藻糖苷酶高值质控品和接近线性下限的低值质控品,混合成6 个稀释浓度。用改良试剂分别测试以上样本,每个稀释浓度测试3 次,分别求出每个稀释浓度检测结果的均值。以稀释浓度为自变量,以检测结果均值为因变量求出线性回归方程。
1.3.4 干扰性实验:取新鲜混合血清样本,分成2 等份,然后将每等份再分成4 等份,加入不同的干扰物质,添加试剂前后测定血清中AFU 的活性,对照组测定结果与加入不同干扰物质后各组的测定结果。相对偏差(%)=(干扰样本的测定均值-对照样本的测定均值)/对照样本的测定均值×100%。
1.3.5 比对性实验:参照CLSI EP9-A2 的方法,用AFU 浓度范围(0~170U/L)的50 个不同浓度的病人新鲜血清样本,用改良试剂与进口试剂同时进行测试。
1.3.6 稳定性实验:将新配制的改良试剂,均匀分装各12 组,每组的试剂量为R1:20ml,R2:5ml。放置到2~8℃冰箱中,每月的同一天取出两组试剂检测低高AFU 质控品。
1.4 统计学分析 数据均采用SPSS 19.0 统计进行分析,符合正态分布的计量数据以均数±标准差(±s)表示,两组正态计量资料比较,应用方差分析,两组相互比较采用两独立样本t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 精密度验证 见表1,表2。改良试剂与国产试剂同时用贝克曼AU5800 生化仪测定,配置AFU试剂检测低值为CV批内=2.10%,CV批间=2.62%;中值为CV批内=1.19%,CV批间=1.90%;高值为CV批内=0.67%,CV批间=1.20%;国产AFU 试剂检测低值为CV批内=2.78%,CV批间=3.14%;中值为CV批内=3.09%,CV批间=3.30%;高值为CV批内=1.91%,CV批间=2.40%。改良试剂批内及批间总变异系数1.32%,2.59%,国产试剂批内及批间总变异系数为1.91%,2.95%,均符合批内及批间CV≤5%要求,差异均有统计学意义(均P<0.01)。

表1 改良试剂和国产AFU 试剂批内精密度比较(n=20)
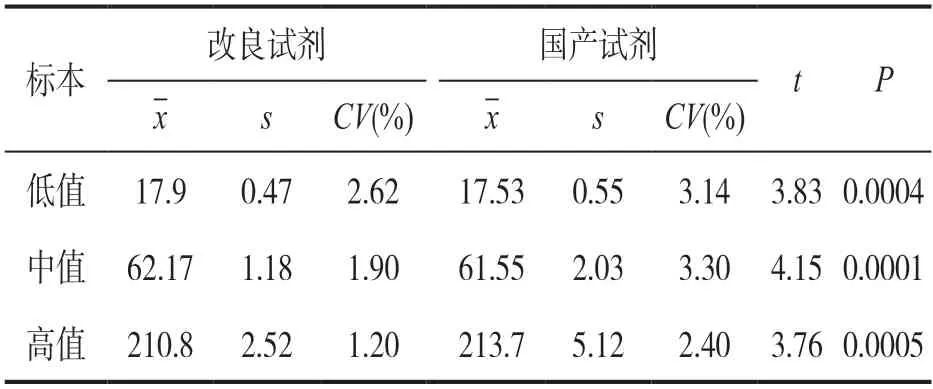
表2 改良试剂和国产AFU 试剂批间精密度比较(n=20)
2.2 线性范围 见图1。线性方程Y=1.004 5X-0.548 5,相关系数r2=0.999 7,测量值之间的相关性极好,通过实验证明改良试剂线性范围为0~300U/L,完全能满足临床检验诊断的需求。
2.3 干扰性实验 见表3。改良试剂在抗坏血酸≤12g/L,胆红素≤550μmol/L,脂血指数≤0.5mg/L,血红蛋白≤3g/L 对测试结果均无显著干扰(P<0.05)。而对照组国内某AFU 试剂在上述浓度干扰物质存在时,受到明显干扰,相对偏差较大。

表3 两种试剂干扰实验结果
2.4 比对实验 见图2。改良试剂与某进口试剂分别按标准操作程序对50 例临床新鲜血清标本进行测定,其相关系数r2=0.999 8,说明二者相关性良好。
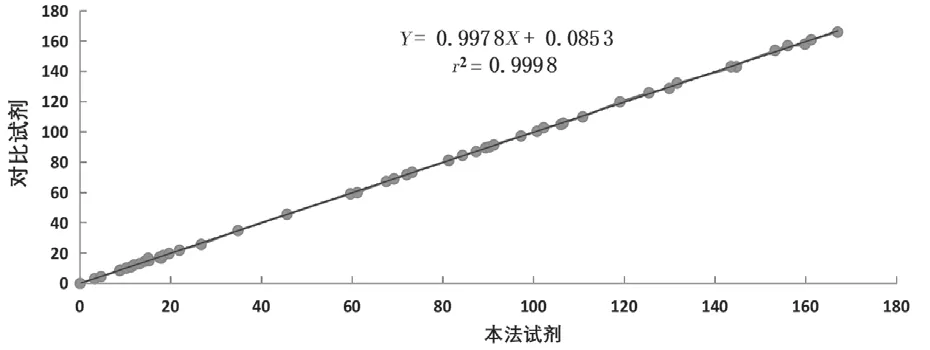
图2 改良试剂与进口试剂临床样本比对结果
2.5 稳定性实验 取出放在2~8℃冰箱中的改良试剂每天检测结果,连续检测一年,质控品-1 靶值:28.94U/L;s:0.34;CV:1.18%;AFU 质控品-2 靶值:12.15U/L;s:0.13;CV:1.04%,见图3。本试剂在2~8℃储存条件下非常稳定。

图3 改良试剂稳定性测试结果
3 讨论
AFU 采用CNP-AFU 底物法检测活性是目前较为理想的方法,也是目前最先进的方法[7]。该方法是在酸性条件下,样本中的AFU 将含呈色基团的底物CNP-AFU 的1,4 位糖苷键水解,使反应在405nm 处产生最大吸光度,通过测定吸光度的变化,即可计算出样本中AFU 的活性。AFU 试剂中使用的防腐剂主要是叠氮钠(NaN3),使用防腐剂不能与试剂盒中的任何成分发生反应,不能影响试剂盒的检测效果。叠氮酸(HN3)是体外诊断试剂中最常用的防腐剂之一,可抑制细菌生长,溶于水、液氨,不溶于乙醚,微溶于乙醇,用量一般为0.1%~0.5%。多数情况下行之有效,但由于NaN3含有氨基,会干扰辣根过氧化物酶(HRP)、超氧化物歧化酶、触酶等多种酶,所以一般含有HRP 的试剂都不建议使用,从而影响酶检测结果,所以添加另一种新的防腐剂来稳定检测结果是临床试验血清酶检测所需要解决的问题。
本文[8]通过添加烷基糖苷的AFU 试剂使用新型生物缓冲液-MES 缓冲液(Goods 缓冲液的一种)对样品无副作用,并且在MES 缓冲液中产物CNP的摩尔吸光系数较高,配伍性能好,能与各种离子型、非离子型表面活性剂作用,溶解性好,耐强碱和电解质,有良好的增稠能力,还有防腐作用,使试剂性能稳定性更好,可大大提高测试结果精密度。
参照NCCLS 方法[9],对改良试剂与国内试剂的精密度实验从低中高样品检测结果的变异系数观察,改良试剂批内及批间总变异系数为1.32%,2.59%;国产试剂批内及批间总变异系数为1.91%,2.95%,改良试剂明显低于国产试剂,精密度优于国产试剂。由于酶本身的抗干扰性差,血清溶血、脂血等因素对测定结果有影响,表3 中[10]改良试剂相对偏差(RSD)明显低于某国产试剂,当RSD值越小时精密度越高,重复性越好,改良试剂的抗干扰能力越强。同时与进口试剂实验比对,二者相关系数好,有良好的可比性。试剂的稳定性显示CV良好的开瓶稳定性也好(至少12 个月),在使用一年内无显著变化,完全适合临床使用,能满足商品试剂盒的国家质量指标参数要求[11]。
综上所述[12],改良试剂为液体试剂,有表面活性、防腐及稳定作用。优点主要是检验结果重复性好,稳定性好,抗干扰性好,配置简单。缺点主要是缺乏临床应用,需要大量的检测数据进一步论证。总之为临床试剂的研究及转化应用打好基础。
- 现代检验医学杂志的其它文章
- 急性肺栓塞患者血清ADAM15和MMP-2表达水平及其与疾病严重程度的相关性研究
- 肺炎支原体感染诱发哮喘患儿血清中miR-424-5p和CX3CL1表达水平及与预后预测价值研究
- ALKBH5调控GEFT的m6A修饰对胆管癌转移及EMT的实验研究
- LncRNA NNT-AS1通过调控miR-582-5p/NCKAP1轴激活Hippo-YAP/TAZ信号通路促进膀胱癌细胞增殖、迁移、侵袭和干细胞干性影响
- 血浆外泌体miR-4306表达水平联合CT征象对单发非实性肺结节良恶性鉴别的价值研究
- 白细胞介素-1β基因(rs16944)单核苷酸多态性与骨髓增生异常综合征易感性及临床特征的相关性研究

