加工过程中褐藻岩藻黄素的特征光谱变化
乔子纯,,2,3,4,,2,3,4,,2,3,4,,2,3,4,,
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.厦门市海洋功能食品重点实验室,福建 厦门 361021;3.福建省海洋功能食品工程技术研究中心,福建 厦门 361021;4.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021)
0 引言
岩藻黄素(fucoxanthin),又名褐藻黄素、岩藻黄质,其产量约占自然界中类胡萝卜总产量的 10%[1]。岩藻黄素主要存在于褐藻、硅藻、金藻及黄绿藻中,是可食性褐藻如海带(Laminariajaponica)、 裙带菜 (Undariapinnatifida)、 羊栖菜(Sargassumfusiforme)等中的重要功能活性物质[2]。研究表明,岩藻黄素对人体有许多益处,如预防肥胖[3-5]、抗肿瘤[6]、抗氧化[7]、抗炎[8]等,在食品、化妆品、生物医药等领域也具有广泛的应用。
由于岩藻黄素来源广泛,在多种药理活性方面具有良好的应用前景,有关岩藻黄素提取与分离纯化、生物活性评价以及生理代谢机理等方面已成为研究热点。然而,岩藻黄素是一种脂溶性物质,在有机溶剂中有较好的溶解度,但是在水溶液中却很难溶解,这就限制了其在食品中的应用。此外,在利用岩藻黄素开发产品时,温度、氧气、酸碱、光照、高压等外界加工条件对其影响较大,在这些条件下岩藻黄素的稳定性如何还并不清楚。这些加工属性问题对科学加工岩藻黄素、保持其营养价值十分关键。因为岩藻黄素有很长的共轭双键,并且其分子结构中具有特殊的丙二稀和5,6-环氧烷,这种特殊结构决定了岩藻黄素具有许多重要的生理功能。而岩藻黄素的降解会破坏这些特殊结构,因此会影响其生理功能及营养价值[9]。
本文在控制有机溶剂加入量的前提下,研究观察岩藻黄素在不同的加工条件(光照强度、pH、高温蒸煮、高压)下的稳定性,为减少岩藻黄素在加工过程中的营养损失提供理论基础。
1 材料与方法
1.1 材料、试剂与仪器
岩藻黄素标品、乙醇为色谱纯,均购于Sigma公司。
UV-755B紫外-可见分光光度计,上海元析仪器有限公司;Millipore Elix®15纯水仪,默克化工有限公司。
1.2 实验方法
1.2.1 岩藻黄素溶液的制备
称取0.8 mg岩藻黄素标品置于烧杯中,用1.5 mL的无水乙醇将岩藻黄素溶解,然后加入58.5 mL超纯水,得到0.02 mmol/L的岩藻黄素溶液。所使用的有机溶剂体积分数不超过3%。
1.2.2 光照强度对岩藻黄素稳定性的影响
分别取配制好的岩藻黄素溶液3.0 mL于2个样品瓶中,使用氮气驱走上部空气,之后盖紧瓶盖,将这两个样品瓶分别置于暗处、自然光(普通的60 W日光灯)中,每24 h分别进行全波长扫描测定吸光度值。
1.2.3 高压环境对岩藻黄素稳定性的影响
取配制好的岩藻黄素溶液3.0 mL于样品瓶中,使用氮气驱走上部空气,之后盖紧瓶盖,将其试剂瓶置于高压灭菌锅中进行高压(121 ℃,0.1 MPa)处理15 min,分别测定高压前后的吸光度值。
1.2.4 煮制加工对岩藻黄素稳定性的影响
取配制好的岩藻黄素溶液3.0 mL于样品瓶中,使用氮气驱走上部空气,之后盖紧瓶盖,将其试剂瓶置于100 ℃沸水浴中2.0 h,分别测定沸水浴前后的吸光度值。
1.2.5 pH值对岩藻黄素稳定性的影响
分别取配制好的岩藻黄素溶液4.0 mL于3个样品瓶中,分别标记为1,2,3号。将1号样品瓶用0.1 mol/L的盐酸溶液调pH值至3.0;2号样品瓶用0.1 mol/L的氢氧化钠溶液调pH值至8.0;3号样品瓶不调整pH值。分别取各样品瓶中的岩藻黄素溶液2.0 mL,加入2.0 mL无水乙醇,使得岩藻黄素充分溶解,然后测定初始吸光度值。反应溶液加入样品瓶之后,使用氮气驱走上部空气,之后盖紧瓶盖,实验操作均在密闭条件下进行。将3个样品瓶同时放入4 ℃环境储存,7 d后取出,向这3组岩藻黄素溶液中分别加入2.0 mL无水乙醇,摇匀,完全溶解后进行全波长扫描测定吸光度值。
2 结果与讨论
2.1 岩藻黄素特征吸收光谱的确定
岩藻黄素的紫外-可见光谱图中,其特征吸收光谱值通常在440~470 nm。赵鹏[10]所报道的岩藻黄素特征吸收峰值是450 nm;Rajauria等[11]从褐藻长海条藻中分离纯化出岩藻黄素,对其进行光谱检测,得到其光谱特征吸收峰在446 nm。Pan等[12]的研究结果表明,物质会因为溶剂的改变或者环境的变化导致空间结构的变化而使得特征吸收峰出现偏移;Wang等[13]研究发现,岩藻黄素含有1个多烯烃骨架,属于丙二烯型类胡萝卜素,含有5,6单环氧基,9-共轭双键,还有羰基和羟基。由于这些功能性基团的存在,岩藻黄素极不稳定,易被氧化和异构化[14],也会使得特征吸收峰发生偏移。但是,之前关于岩藻黄素特征吸收峰的报道都是将岩藻黄素完全溶解于有机溶剂中,本文将有机溶剂的加入量控制在3%(体积分数)以下,溶剂的绝大部分是蒸馏水,因此最大吸收峰出现了一定偏移,范围在425~457 nm。
2.2 光照对岩藻黄素稳定性的影响
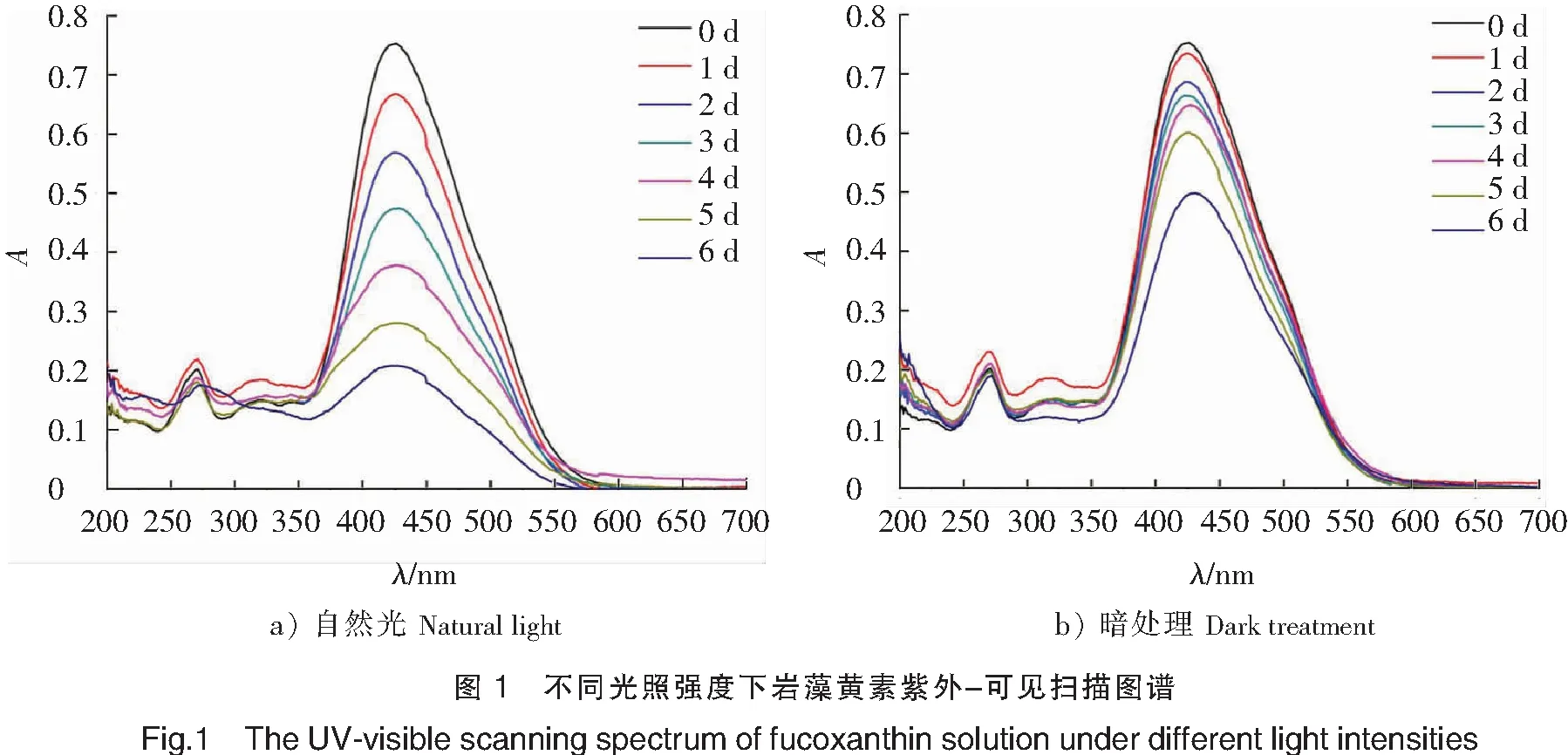
食品加工不可避免会遇到日晒光照的影响。光照对岩藻黄素稳定性的实验结果如图1所示,由图1可见,自然光照下的岩藻黄素随着时间的延长,425 nm处吸光度值显著降低,放置6 d后,吸光度值从0.75降到0.20以下(见图1a)。而暗处理的岩藻黄素在6 d的时间内吸光度值没有显著的降低(见图1b)。故在光照下,岩藻黄素的降解速度更快。Zhao等[15]研究发现,光照会引起岩藻黄素发生异构化,诱导岩藻黄素由13-顺式和13′-顺式转变成全反式,再由全反式转变成9′-顺式结构,从而发生降解,说明结构的变化影响了岩藻黄素的稳定性。同时,由图2岩藻黄素在不同光照强度中放置后所呈现的颜色可以看出,自然光下的岩藻黄素溶液比暗处理下的颜色浅,说明置于自然光下的岩藻黄素比置于暗处下的岩藻黄素分解速度快,这与焉振铃[16]的研究结果相同。由此可见,光照是影响岩藻黄素稳定性的一个重要因素,因为岩藻黄素具有热不稳定性。因此,在进行食品加工时,应尽可能地避免在光照下进行,选择光照强度低的方式,从而保证岩藻黄素的稳定性,避免营养损失。

2.3 煮制加工对岩藻黄素稳定性的影响
100 ℃是煮制食品的常用温度,日后对岩藻黄素进行食品加工,这个温度环境就是必须考虑的因素。煮制加工对岩藻黄素稳定性的实验结果如图3所示,可见,在100 ℃的环境中,岩藻黄素的降解程度明显,2 h后吸光度值就降为原来的一半。同时,从岩藻黄素置于100 ℃环境2 h前后的状态可以看出,岩藻黄素溶液的颜色明显变浅(见图4),说明其发生了一定程度的降解。这与陈晓利等[17]的研究结果一致,岩藻黄素在高温环境中降解速度快,不耐贮藏。此外,由图3还可见,吸收峰值也出现了一定的红移,最大吸收峰由425 nm变为446 nm,因此推测岩藻黄素的结构也发生了一定的变化。Davey等[18]研究发现,岩藻黄素降解分为2个阶段,第一阶段岩藻黄素先经异构化作用由全反式转变成顺势异构体,第二阶段为顺式岩藻黄素的氧化作用。在煮制加工过程中,高温环境会促进岩藻黄素的氧化分解,因此,岩藻黄素在食品加工过程中具有热不稳定性。
2.4 高压对岩藻黄素稳定性的影响
高压也是食品加工中经常使用到的单元操作。从图5岩藻黄素的吸光度值变化情况可以看出,经过高压处理的岩藻黄素发生了一定程度的降解,吸收峰值也同样出现了一定的红移,最大吸收峰由425 nm变为455 nm,因此推测岩藻黄素的结构在高压环境下也发生了一定的变化。同时由图6高压处理前后岩藻黄素溶液的颜色变化可直观看出,经过高压处理的岩藻黄素发生了降解。高压处理导致的岩藻黄素结构的变化以及降解,很难保持岩藻黄素的稳定性,从而造成营养作用不能够充分发挥。因此,在食品加工时,采用高压的单元操作直接对岩藻黄素进行处理是不可行的。对岩藻黄素进一步处理后,使其处于相对稳定状态下再进行高压的操作,可能会较为理想,这需要进一步的研究。

2.5 pH值对岩藻黄素稳定性的影响
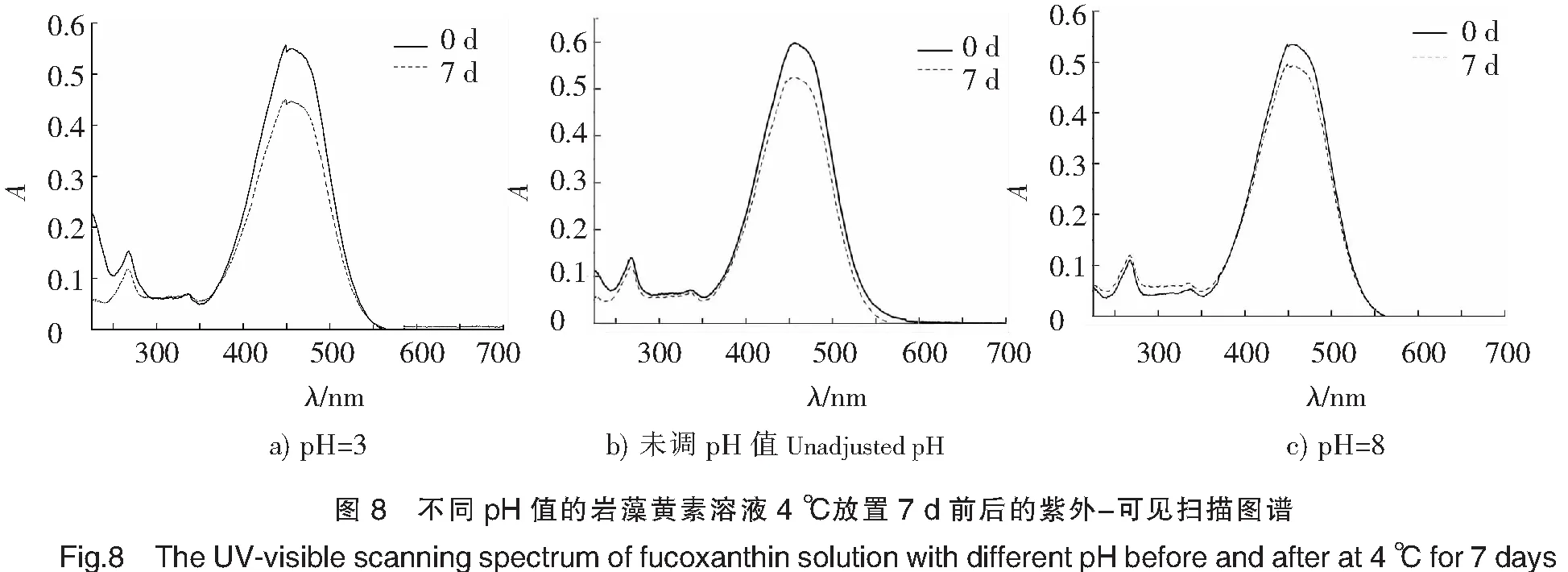
食品中碳酸饮料(pH<4)[19]为酸性,植物蛋白、运动饮料等为弱碱性,因此将岩藻黄素置于pH=3和pH=8环境中研究其稳定性。由图7的岩藻黄素溶液的状态可以看出,强酸(pH=3)环境对岩藻黄素的稳定性影响极大,导致岩藻黄素溶解性变差,有颗粒析出,而在未调pH值的中性、弱碱性环境下,岩藻黄素溶解性良好。将3种不同pH值(pH=3,pH=8,未调pH)的岩藻黄素溶液在放置前、后分别用无水乙醇按照1∶1(V/V)的比例重新溶解,对重新溶解完全的岩藻黄素溶液进行全波长扫描,结果如图8所示。放置7 d后,pH=3的岩藻黄素溶液吸光度值下降最为明显(见图8a),这与Hii等[20]的研究结果一致,酸性环境增加了岩藻黄素的降解。其次为未调pH值的岩藻黄素溶液(见图8b),而pH=8的岩藻黄素溶液吸光值减少最小(见图8c)。可见,岩藻黄素在碱性环境下的稳定性优于中性及酸性,应用到食品加工中应避免选择强酸性。因此,直接用于碳酸饮料等酸性饮品和食物是不恰当的,这会造成岩藻黄素在加工过程中的严重损失,使其营养功能不能充分发挥。而应选择碱性食品,以保证岩藻黄素的稳定性,尽可能保持其营养价值。

3 结论
本文通过控制有机溶剂加入量低于3%(体积分数)和绝大部分用蒸馏水溶解岩藻黄素的方式,研究了光照强度、100 ℃环境、高压、pH值对岩藻黄素稳定性的影响。结果表明,自然光照强度下岩藻黄素的稳定性明显低于黑暗环境;在100 ℃环境中放置2 h、高压处理15 min的岩藻黄素稳定性也明显降低,且吸收特征峰发生红移,推测岩藻黄素的结构在高温高压环境下发生了一定的变化;酸性(pH=3)对岩藻黄素的稳定性影响极大,会导致岩藻黄素颗粒析出,而岩藻黄素在碱性(pH=8)的条件下则相对稳定。
[1]MAEDA H,TSUKUI T,SASHIMA T,et al.Seaweed carotenoid,fucoxanthin,as a multi-functional nutrient[J].Asia Pac J Clin Nutr,2008,17(S1):196-199.
[2]闫相勇,刘翼翔,吴永沛,等.海带岩藻黄素的提取及纯化工艺研究[J].中国食品学报,2014,14(3):115-121.
[3]MATSUMOTO M,HOSOKAWA M,MATSUKAWA N,et al.Suppressive effects of the marine carotenoids,fucoxanthin and fucoxanthinol on triglyceride absorption in lymph duct-cannulated rats[J].European Journal of Nutrition,2010,49(4):243-249.DOI:10.1007/s00394-009-0078-y.
[4]WOO M,JEON S,SHIN Y C,et al.Anti-obese property of fucoxanthin is partly mediated by altering lipid-regulating enzymes and uncoupling proteins of visceral adipose tissue in mice[J].Molecular Nutrition & Food Research,2009,53(12):1603-1611.DOI:10.1002/mnfr.200900079.
[5]MAEDA H,HOSOKAWA M,SASHIMA T,et al.Fucoxanthin and its metabolite,fucoxanthinol,suppress a dipocyte differentiation in 3T3-L1 cells[J].Int J Mol Med,2006,18(1):147-152.DOI:10.3892/ijmm.18.1.147.
[6]MORI K,OOI T,HIRAOKA M,et al.Fucoxanthin and its metabolites in edible brown algae cultivated in deep seawater[J].2004,2(2):63-72.DOI:10.3390/md202063.
[7]HEO S,KO S,KANG S,et al.Cytoprotective effect of fucoxanthin isolated from brown algaeSargassumsiliquastrumagainst H2O2-induced cell damage[J].European Food Research and Technology,2008,228(1):145-151.DOI:10.1007/s00217-008-0918-7.
[8]SHIRATORI K,OHGAMI K,ILIEVA I,et al.Effects of fucoxanthin on lipopolysaccharide-induced inflammationinvitroandinvivo[J].Experimental Eye Research,2005,81(4):422- 428.DOI:10.1016/j.exer.2005.03.002.
[9]扈晓杰.岩藻黄素和豆渣膳食纤维对肥胖的预防作用及其机理研究[D].杭州:浙江大学,2013.
[10]赵鹏.海带中岩藻黄素的提取与纯化工艺研究[D].北京:北京化工大学,2010.
[11]RAJAURIA G,ABU-GHANNAM N.Isolation and partial characterization of bioactive fucoxanthin fromHimanthaliaelongatabrown seaweed:a TLC-based approach[J].International Journal of Analytical Chemistry,2013,2013:1-6.DOI:10.1155/2013/802573.
[12]PAN K,ZHONG Q,BAEK S J.Enhanced dispersibility and bioactivity of curcumin by encapsulation in casein nanocapsules[J].Journal of Agricultural and Food Chemistry,2013,61(25):6036-6043.DOI:10.1021/jf400752a.
[13]WANG S,LI Y,WHITE W,et al.Extracts from New ZealandUndariapinnatifidacontaining fucoxanthin as potential functional biomaterials against cancerinvitro[J].Journal of Functional Biomaterials,2014,5(2):29- 42.DOI:0.3390/jfb5020029.
[14]张文源,高保燕,雷学青,等.岩藻黄素的理化与生物学特性、制备技术及其生理活性研究进展[J].中国海洋药物,2015(3):81-95.DOI:10.13400/J.CNKI.CJMD.2015.03.013.
[15]ZHAO D,KIM S,PAN C,et al.Effects of heating,aerial exposure and illumination on stability of fucoxanthin in canola oil[J].Food Chemistry,2014,145:505-513.DOI:10.1016/j.foodchem.2013.08.0 45.
[17]陈晓利,汪曙晖,朱俊向,等.岩藻黄素在水、油模型体系中稳定性的研究[J].食品工业科技,2016(14):298-302.
[18]DAVEY M W,MELLIDOU I,KEULEMANS W.Considerations to prevent the breakdown and loss of fruit carotenoids during extraction and analysis in Musa[J].Journal of Chromatography A,2009,1216(30):5759-5762.DOI:10.1016/j.chroma.2009.06.022.
[19]梁文红,张剑,杨德琴,等.五类市售饮料的酸蚀性研究[J].牙体牙髓牙周病学杂志,2005(8):454- 457.DOI:10.3969/j.issn.1005-2593.2005.08.009.
[20]HII S L,CHONG P Y,WOO K K,et al.Stability studies of fucoxanthin fromSargassumbinderi[J].Aust J Basic Applied Sci,2010,4(10):4580- 4584.

