岩藻黄质的提取及其稳定性初探
丁建姿,李长青 ,姬广磊,姚艳艳,陈晓丽,常丽荣
1.威海长青海洋科技股份有限公司(荣成 264300);2.威海青逸未来生物技术有限公司(荣成 264300);3.寻山集团有限公司(荣成 264300);4.威海市渔业技术推广站(威海 264200)
岩藻黄质(Fucoxanthin)是胡萝卜素的含氧衍生物,是一种脂溶性色素,在藻类中含量丰富,其含量占类胡萝卜素总产量的10%以上[1]。研究证明岩藻黄质具有抗肥胖、抗肿瘤、抗氧化、抗炎症等生理活性[2-4]。Kei等研究发现岩藻黄质及代谢产物岩藻黄质醇在小鼠体内和体外试验中均可抑制原发性渗出性淋巴瘤细胞的生长,而对正常细胞几乎没有任何不良影响[5]。Woo等研究者发现岩藻黄质可以抑制肝脏的脂肪生成,增加肝脏的脂肪分解。在饲料中添加0.05%岩藻黄质可以改善肥胖小鼠的肝脏脂质状况,并具有降血脂和降血糖的作用[6]。Hayato等[7]研究表明岩藻黄质可以减轻脂肪组织的炎症,从而具有抗糖尿病的作用。多种功能发现使岩藻黄质在保健食品、医药、美容等领域具有更广阔的应用前景。
大型褐藻中岩藻黄质的含量一般在0.1~1 mg/g,提取率低[8]。大型藻生长周期比较长、养殖成本高,且本身多糖含量高,提取纯化过程困难,并不是岩藻黄质提取的最佳原料。而在海洋微藻中,岩藻黄质质量分数2~26.6 mg/g,比大型褐藻岩藻黄质浓度高1~3个数量级[9]。三角褐指藻(Phaeodactylum tricornutum Bohlin)中岩藻黄质含量尤其丰富,质量分数约15 mg/g,而且三角褐指藻可以利用天然海水进行人工培养,不会竞争淡水资源,也不会占用耕地面积,是极佳的原料来源[10]。
对于岩藻黄质研究主要集中于提取、纯化、稳定性及生物功能的研究[11-14]。岩藻黄质的提取主要针对大型褐藻,如海带、羊栖菜、裙带菜、鼠尾藻和铜藻等[15-19]。利用三角褐指藻提取岩藻黄质的研究鲜有报道。
试验以三角褐指藻为原料,采用超声辅助有机溶剂浸提法从三角褐指藻中提取岩藻黄质,探究提取剂种类、超声时间、超声温度、料液比对岩藻黄质提取率的影响。在单因素基础上利用响应曲面法优化提取工艺,以提取率作为评价指标,得到最优提取工艺。初步对提取的岩藻黄质进行稳定性研究,探究温度、光照、氧化剂、抗氧化剂等因素对岩藻黄质稳定性的影响。
1 材料与方法
1.1 材料与试剂
三角褐指藻(威海长青海洋科技股份有限公司);岩藻黄质标准品(CAS号3351-86-8,美国sigma公司);无水乙醇、抗坏血酸、双氧水(均为分析纯,国药集团化学试剂有限公司);甲醇、乙腈(均为色谱纯,科密欧化学试剂有限公司)。
1.2 仪器与设备
天平(FA1004,上海精密科学仪器有限公司);真空冷冻干燥器(SCIENTZ-10N,宁波新芝科技股份有限公司);高效液相色谱仪(LC-20AT,岛津);超声波清洗仪(SB25-12DTD,宁波新芝科技股份有限公司)。
1.3 试验方法
1.3.1 三角褐指藻岩藻黄质提取工艺
取0.05 g三角褐指藻冻干粉加入95%乙醇,料液比1∶1 000(g/mL),在30 ℃条件下超声60 min(频率40 kHz、超声功率500 W),全程避光操作,过滤得到岩藻黄质提取液。
1.3.2 岩藻黄质测定方法
参照付志明[20]的高效液相色谱法检测。
1.3.3 超声辅助提取单因素试验
根据1.3.1的岩藻黄质提取工艺流程,探究提取溶剂(甲醇,无水乙醇(≥99.7%),95%乙醇,90%乙醇,丙酮,乙酸乙酯和三氯甲烷),超声温度(20,30,40,50和60 ℃),超声时间(0,15,30,45,60,90,120和150 min),料液比(1∶200,1∶500,1∶1 000,1∶2 000和1∶4 000(g/mL))等因素对三角褐指藻岩藻黄质提取率的影响。
盐藻黄质提取率=C×V/m×10-6×100% (1)式中:C为岩藻黄质提取液质量浓度,mg/L;V为提取液体积,mL;m为三角褐指藻冻干粉质量,g。
1.3.4 响应面分析法优化提取工艺
为综合考虑试验因素的影响,在单因素试验的基础上,选择超声温度(A)、超声时间(B)和料液比(C)3个因素作为自变量,岩藻黄质的提取率为响应值,进行三因素三水平Box-Behnken试验设计。三因素三水平编码见表1,基于Box-Behnken模型设计,三因素三水平共设计17组试验,每组试验重复3次,取平均值。
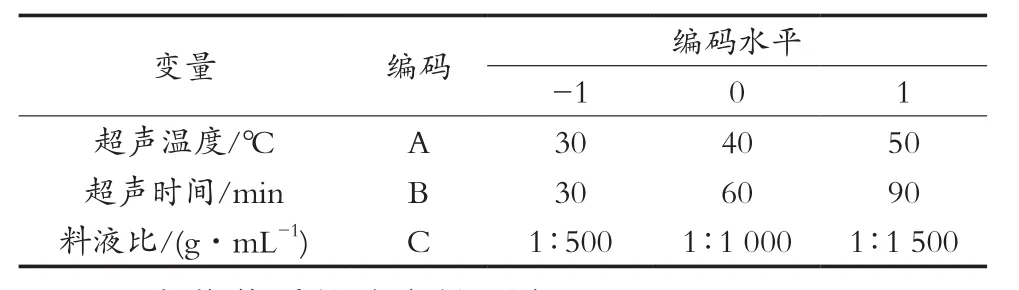
表1 Box-Behnken设计因素水平及编码
1.3.5 岩藻黄质的稳定性研究
试验探究光照(避光,室内自然光和室外强光),温度(4 ℃冰箱,25 ℃室温,40,50,60,70和80℃),氧化剂(3%和6%双氧水)和抗氧化剂(0.5%和1.0%抗坏血酸)对岩藻黄质稳定性的影响。
2 结果与分析
2.1 超声辅助提取
2.1.1 岩藻黄质HPLC色谱图
图1为岩藻黄质标准品和样品的色谱图,岩藻黄质标准品出峰时间为7 min,而样品在7 min也出现相同的峰。两者光谱特征峰曲线相同,可以判定两者为同一物质。结果表明样品在7 min出现的特征峰应为岩藻黄质的特征峰。
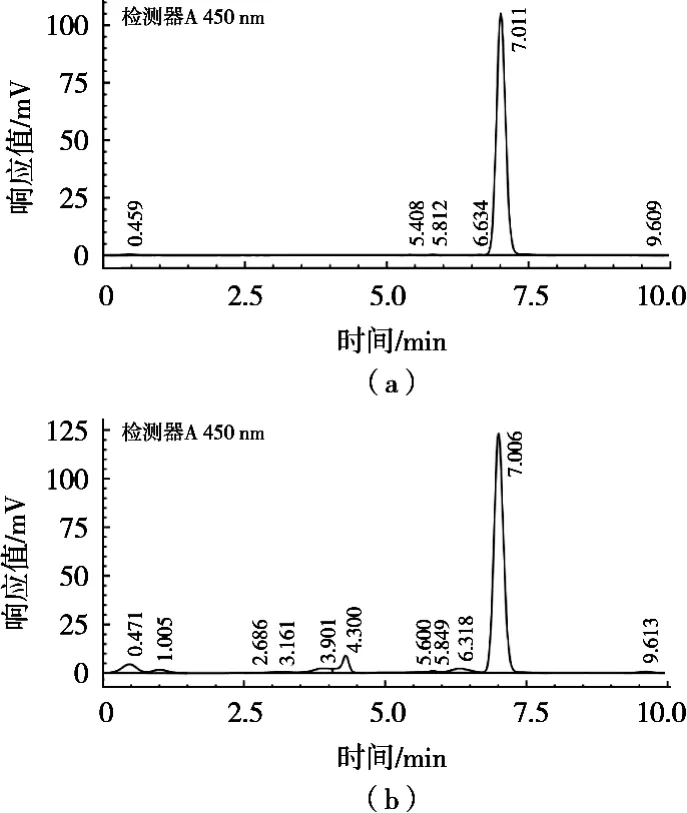
图1 岩藻黄质标准品(a)和样品的色谱图(b)
2.1.2 提取溶剂对岩藻黄质提取率的影响
取0.05 g冻干藻粉,加入不同的提取试剂,料液比1∶1 000(g/mL),30 ℃下超声提取60 min。图2为不同试剂做提取剂时岩藻黄质提取率的结果图,岩藻黄质为脂溶性色素,因此提取溶剂选择有机试剂。提取效果顺序由大到小依次为95%乙醇>90%乙醇>甲醇>无水乙醇(≥99.7%)>乙酸乙酯>丙酮>三氯甲烷。考虑到提取率及后期岩藻黄质实际生产中对试剂的要求,试验采用95%乙醇作为最终提取试剂。
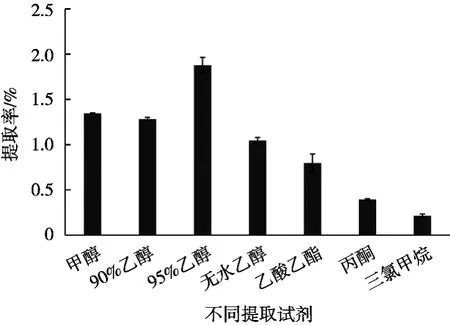
图2 不同提取溶剂对岩藻黄质提取率的影响
2.1.3 超声温度对岩藻黄质提取率的影响
取0.05 g冻干藻粉,加入95%乙醇,料液比1∶1 000(g/mL),在30,40,50和60 ℃条件下超声60 min,全程避光操作。从图3中可以看出,随着超声温度升高,岩藻黄质提取率呈现先上升后下降趋势,40℃时岩藻黄质提取率最高,为1.97%。结果表明,随着温度升高,三角褐指藻细胞壁越容易破裂,内溶物易流出,增加岩藻黄质与提取溶剂的接触面积,从而使提取率升高。由于岩藻黄质本身极不稳定,因此随着温度进一步提升,岩藻黄质易分解,导致提取率降低。

图3 超声温度对岩藻黄质提取率的影响
2.1.4 超声时间对岩藻黄质提取率的影响
取0.05 g冻干藻粉,加入95%乙醇,料液比1∶1 000(g/mL),在30 ℃条件下超声0,15,30,45,60,90,120和150 min,全程避光操作。从图4可以看出,随着时间延长,岩藻黄质提取率增加,在45 min时岩藻黄质提取率最高,为2.04%。时间延长可以增加岩藻黄质与提取溶剂的接触时间,提取更佳彻底。但是随着提取时间进一步延长,岩藻黄质提取率下降。这是由于随着提取时间延长,提取出的岩藻黄质长时间暴露在空气中,加速岩藻黄质的降解,且提取过程是持续加热状态,高温也进一步促进岩藻黄质的降解,因此提取率降低。
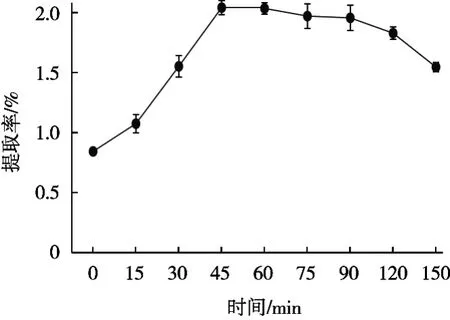
图4 超声时间对岩藻黄质提取率的影响
2.1.5 料液比对岩藻黄质提取率的影响
取0.05 g冻干藻粉,加入95%乙醇,料液比1∶200,1∶500,1∶1 000,1∶1 500和1∶2 000(g/mL),在30 ℃下超声60 min,全程避光操作。图5可以看出,随着料液比增加,岩藻黄质提取率呈现先增加后下降趋势。料液比1∶1 000(g/mL)时提取率最高,为2.15%。这是由于随着料液比增大,岩藻黄质在有机溶剂体系中的扩散范围增大,两者充分接触,提取率增加。料液比大于1∶1 000(g/mL)时,提取率开始下降,说明增加扩散范围所带来提取率的提升并非没有限度,扩散趋于平稳后,岩藻黄质提取率不再增加[21]。有机溶剂使用量增多,会造成生产成本增加。
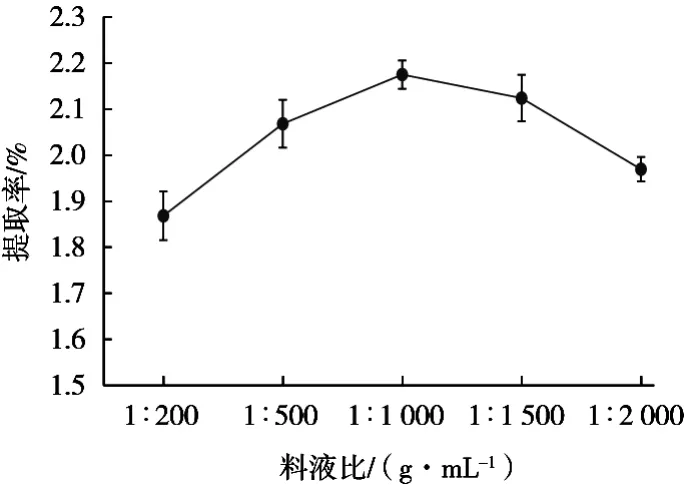
图5 料液比对岩藻黄质提取率的影响
2.2 响应面结果分析
2.2.1 模型及方差分析
Box-Behnken试验设计共17组试验,试验的实际值和预测值结果如表2所示。将表2得到的结果进行方差分析,结果如图3所示。该模型的F值为85.51,模型p值<0.000 1,结果表明该模型拟合显著[22]。失拟项F值为1.51,p值为0.341 2(p>0.05),说明失拟项不显著,模型是合适的[23]。模型的相关系数R2为0.991 0,说明岩藻黄质提取率的试验值和预测值相近,模型的调整相关系数R2为0.979 7,说明岩藻黄质提取率模型能在97.97%程度上解释试验结果,该二次多元方程拟合度较好。综合各参数表明运用响应曲面法得到的二次方程模型准确、合适,可用于分析关于岩藻黄质提取率的3个因素水平,并且可以预测最佳岩藻黄质提取率。
从表3可以看出:因素A、因素B一次项,二次项A2、B2、C2及相互作用AB对响应值岩藻黄质提取率的影响极显著(p<0.01),因素C及相互作用AC对岩藻黄质提取率的影响显著(p<0.05);BC相互作用对岩藻黄质影响效果不显著;运用Design Expert 8.0.5软件对表2的试验数据二次多元回归拟合,得到以岩藻黄质提取率为响应值(Y),因素A、B、C为自变量的二次多项式回归方程。Y=2.21-0.088A-0.091B+0.042C-0.110AB+0.051AC-0.032BC-0.39A2-0.079B2-0.27C2。Y,岩藻黄质提取率(%)。

表2 Box-Behnken设计试验结果
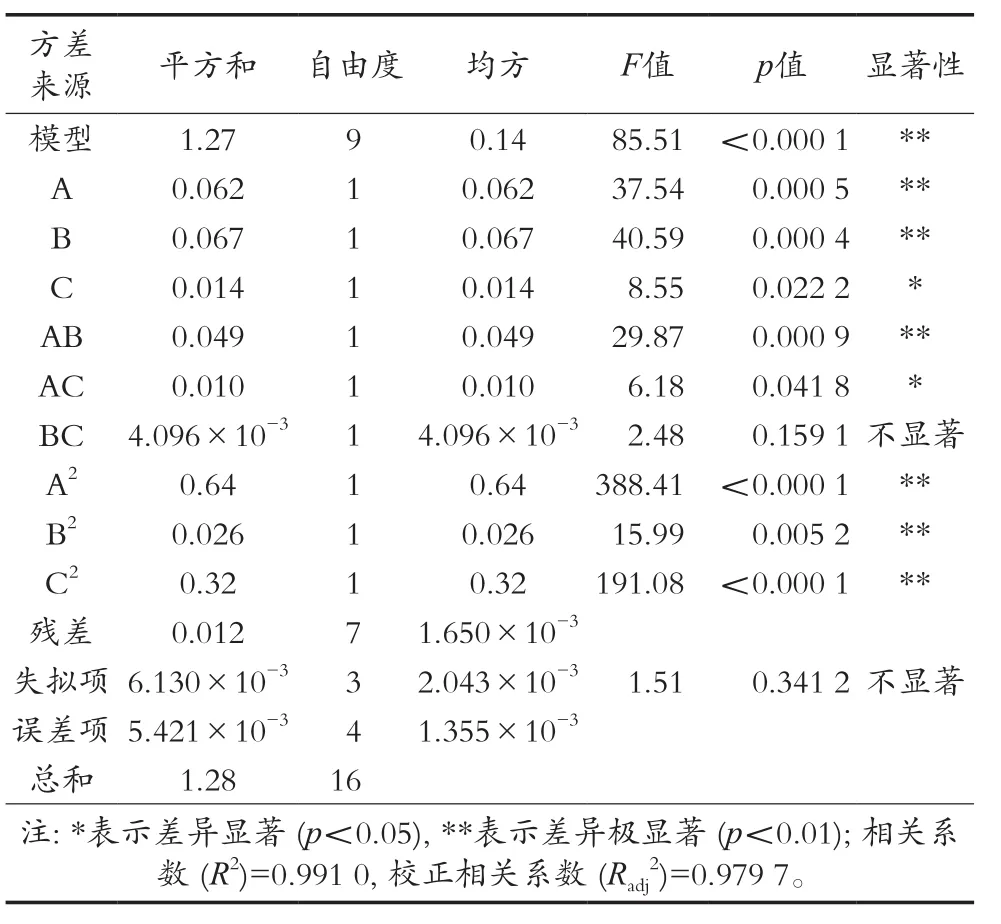
表3 方差分析
2.2.2 响应曲面分析及最佳提取工艺选择
图6为任意2个因素之间的相互作用对岩藻黄质提取率影响的三维图,每个因素对岩藻黄质的提取率都有一定影响。图6中的三维图开口均朝下,随着每个因素数值增大,岩藻黄质提取率先达到最高值后再下降。结果表明,3个因素取值达到最优条件时,可获得岩藻黄质最佳提取率。3个因素中超声时间对岩藻黄质提取率影响最大,超声温度次之,且超声温度与超声时间之间的相互作用对岩藻黄质提取率影响较大。

图6 响应曲面分析
根据Box-Behnken设计,优化选择最佳提取条件,得到最大岩藻黄质提取率。优化结果为超声温度39.77 ℃、超声时间42.48 min、料液比1∶1 054.1(g/mL),理论上提取率为2.24%。考虑到实际操作的可行性、方便性及节省能耗等问题,对参数条件进行优化。最佳提取条件为超声温度39.8 ℃、超声时间43 min、料液比1∶1 055(g/mL),对工艺优化后参数进行试验验证,试验结果表明岩藻黄提取率为2.18%,证明相应曲面分析法优化结果提取工艺参数具有稳定性和可行性。
2.3 岩藻黄质的稳定性研究
2.3.1 光照对岩藻黄质稳定性的影响
取同等体积的岩藻黄质提取液于比色管中,封住管口,分别放置在避光、室内自然光(1 500~3 000 lx)和室外强光(25 000~35 000 lx)的环境中,测定8 h内岩藻黄质含量变化。结果如图7所示,光照对岩藻黄质含量影响很大。随着时间延长,3种光照条件下,岩藻黄质的损失都在增加。避光条件对岩藻黄质含量影响较小,室内自然光和室外条件下可明显看出,岩藻黄质含量呈直线下降趋势。放置8 h时后,自然光条件下岩藻黄质损失55%左右。室外强光条件下,岩藻黄质分解迅速,4 h时测定时岩藻黄质含量为0,岩藻黄质完全分解。这主要是由于岩藻黄质中有含氧多稀结构[24],稳定性差,光照会促进其分解,导致岩藻黄质含量下降,因此在日常保存时应避免光照。

图7 光照对岩藻黄质稳定性的影响
2.3.2 温度对岩藻黄质稳定性的影响
取同等体积的岩藻黄质提取液于比色管中,封住管口,分别置于4 ℃冰箱,25 ℃室温,40,50,60,70和80 ℃水浴中,全程避光,测定24 h内岩藻黄质的含量变化。结果如图8所示,随着温度升高,岩藻黄质含量逐渐降低。50 ℃以下岩藻黄质损失相对较少,放置在4 ℃冰箱下,岩藻黄质损失最少,基本没有损失。25 ℃室温条件下岩藻黄质损失次之,损失近12%。温度达到60 ℃后岩藻黄质损失速率加快。60 ℃时岩藻黄质损失近60%,80 ℃放置24 h后,岩藻黄质基本完全降解。试验结果与刘丽平[25]的研究结果一致,说明高温下,岩藻黄质极不稳定。结果表明,高温会破坏岩藻黄质的化学结构,造成岩藻黄质的降解,因此在日常应选择低温保存,损失率会降低。

图8 温度对岩藻黄质稳定性的影响
2.3.3 氧化剂和抗氧化剂对岩藻黄质稳定性的影响
取同等体积的岩藻黄质提取液于比色管中,封住管口,在室温条件下(25 ℃)分别加入氧化剂(3%和6%双氧水)和抗氧化剂(0.5%和1.0%抗坏血酸),取1组不加氧化剂和抗氧化剂的提取液作为对照,全程避光操作,测定24 h内岩藻黄质的含量变化。从图9(a)可以看出,与对照相比,加入H2O2的试验组岩藻黄质损失量大,而且随着H2O2浓度增加,岩藻黄质损失量也在增加。结果表明,岩藻黄质在氧化剂存在的条件下不稳定,也表明岩藻黄质有抗氧化的作用。图9(b)为加入抗坏血酸后岩藻黄质剩余量随着时间的变化曲线图,加入抗氧化剂岩藻黄质的损失量减少,并且明显小于对照,而且添加1.0%抗坏血酸的试验组岩藻黄质基本没有损失。结果表明,样品中加入适量的抗氧化剂,可以减缓岩藻黄质氧化,样品存储更加稳定。
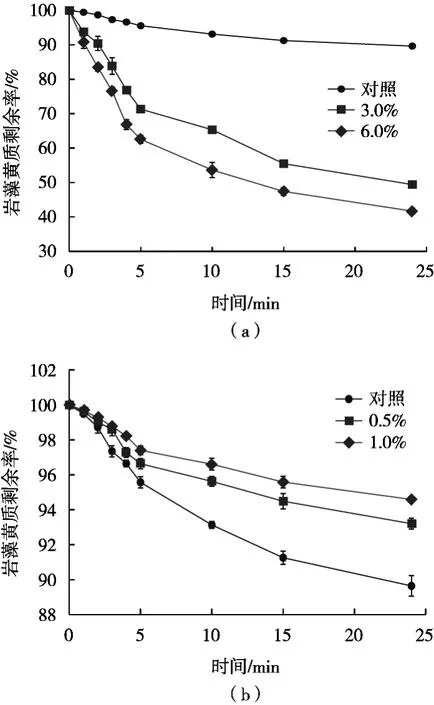
图9 氧化剂(a)和抗氧化剂(b)对岩藻黄质稳定性的影响
3 结论
三角褐指藻是一种岩藻黄质含量丰富的硅藻,通过超声辅助法从三角褐指藻冻干粉中提取岩藻黄质。探究单因素(溶剂种类、超声温度、超声时间和料液比)对岩藻黄质提取的影响。根据单因素试验进行响应面Box-Behnken试验设计,得出岩藻黄质提取的最优工艺,并根据实际情况适当进行调整。岩藻黄质本身性质不稳定,因此初步探究光照、温度、氧化剂和抗氧化剂对岩藻黄质稳定性的影响。结果表明,岩藻黄质最优提取工艺为:料液比1∶1 055(藻粉∶95%乙醇,g/mL),在39.8 ℃水浴下超声提取43 min。在此条件下,岩藻黄质提取率为2.18%。岩藻黄质在强光、高温氧化剂存在的条件下不稳定、易分解,容易造成岩藻黄质损失,因此平时储存时应低温避光保存,并与氧化剂分开;在抗氧化剂存在的条件下可以降低岩藻黄质的损失,因此在存储时可以考虑加入抗氧化剂。

