岩藻多糖降解酶的研究进展
魏 真,陈金玲,杨 杰
(1.江苏海洋大学 江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005;2.江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005;3.江苏省海洋资源开发研究院,江苏 连云港 222005)
岩藻多糖降解酶是一类特异性作用于岩藻多糖中糖苷键的水解酶,能够将大分子岩藻多糖水解为中、低分子质量的岩藻聚糖[1]。多种岩藻低聚糖具有免疫调节、抗肿瘤、抗氧化、美白等特殊的生物学功效[2-5],因而岩藻多糖降解酶成为生产岩藻低聚糖不可或缺的工具酶。除了制备岩藻低聚糖之外,岩藻多糖降解酶还可用于功能性食品研发、疾病诊断以及推断复杂岩藻多糖的化学结构等,因此岩藻多糖降解酶在食品、医药等领域有着较高的应用价值。近年来,随着功能性食品与保健品市场需求的扩大,岩藻多糖降解酶的特殊作用与水解产物的功效也逐渐被重视和研究。由于岩藻多糖的分子结构极为复杂,且不同功效的岩藻低聚糖与其分子质量、硫酸基的含量和分子组成密切相关[6-8],因此深入探讨不同来源和功能的岩藻多糖降解酶对于开发和研究多种生理活性的岩藻低聚糖具有十分重要的意义。本文总结近年来不同生物来源的岩藻多糖降解酶的研究进展,从岩藻多糖降解酶的分类、酶学性质、作用方式、结构功能及应用领域等方面展开论述,以期为后续岩藻多糖降解酶的理论研究及应用提供参考。
1 岩藻多糖降解酶的分类和来源
岩藻多糖降解酶归属于糖苷水解酶(glucoside hydrolase,GH)类,能够特异性作用于岩藻多糖中的糖苷键[1]。岩藻多糖是一种来源于海洋褐藻及海洋无脊椎动物的硫酸化多糖,其主链主要由L-岩藻糖组成,侧链分布着少量不同含量的甘露糖、木糖、半乳糖和葡萄糖醛酸等组分[9-10]。研究表明,岩藻多糖的分子结构极为复杂多样,从不同来源、不同生长季节褐藻中提取的岩藻多糖化学成分和结构均不相同[8],甘露糖、木糖等单糖组分被替换在L-岩藻糖基的随机位置,岩藻多糖的硫酸化位点可发生在L-岩藻糖基的C2、C3或C4等位置[11]。作为能够水解复杂岩藻多糖的重要酶,岩藻多糖降解酶具有多样性,不同分类和来源的岩藻多糖降解酶正被不断地挖掘和认识。
“岩藻多糖降解酶”一词最早出现在1959年发表于Nature上的一篇从海洋细菌Pseudomonasatlantica和Pseudomonascarrageenovora中分离的酶能够降解岩藻多糖的研究中,该酶被命名为“fucoidinase”[12]。直到1967年,有研究报道从鲍鱼肝胰腺分离的酶能够催化岩藻多糖降解[13],同时这种降解岩藻多糖的生物酶被更名为“fucoidanase”并沿用至今。随着研究者对岩藻多糖降解酶重要性的认识,该酶也在其他某些无脊椎动物的内脏和海洋微生物中被发现。目前岩藻多糖降解酶主要包含3 种酶:岩藻多糖酶(fucoidanase)、α-L-岩藻糖苷酶(fucosidase)和硫酸酯酶(sulfatase)。
1.1 岩藻多糖酶
岩藻多糖酶(EC 3.2.1.211,EC 3.2.1.212)是目前关于降解岩藻多糖研究最多的一种酶,它能够催化岩藻多糖中α-糖苷键的水解[14]。还有β-D-岩藻糖苷酶(EC 3.2.1.38),由于在岩藻多糖中并未发现D型岩藻糖,因而其不能作用于岩藻多糖。根据水解位置不同,岩藻多糖酶分为内切型和外切型。内切岩藻多糖酶可以切割岩藻多糖分子内的糖苷键,产生不同分子质量的岩藻低聚糖,而外切岩藻多糖酶能够将岩藻多糖的非还原端水解为非硫酸化或者硫酸化的岩藻糖分子[1]。岩藻多糖酶分布十分广泛,在一些海洋微生物及无脊椎动物中均可分离和鉴定到该酶的存在。目前已报道产岩藻多糖降解酶的细菌主要有依氏假交替单胞菌(Pseudoalteromonasissachenkoniisp.nov.)[15]、交替单胞菌属(Alteromonassp.)[16]、昆布海藻鼠尾菌(Muricaudaeckloniae)[17]、少动鞘氨醇单胞菌(SphingomonaspaucimobilisPF-1)[18]、鲍鱼美丽菌(Formosahaliotis)[19]、解岩藻聚糖庄文颖菌(Wenyingzhuangiafucanilytica)[20]、黄杆菌属(Flavobacteriumsp.)[21]和海绵科贝特氏菌(Cobetia amphilecti)[22]等。此外,从真菌和无脊椎动物的内脏也能够分离出岩藻多糖降解酶,例如真菌来源的镰刀菌属(Fusariumsp.LD8)[23]、砂生小树状霉(Dendryphiella arenariaTM94)[24]、谢瓦氏曲霉(Aspergilluschevalier)[25]等,以及无脊椎动物来源的鲍属[13]、虾夷盘扇贝[26]、光棘球海胆[27]和滨螺[28]等。
1.2 α-L-岩藻糖苷酶
α-L-岩藻糖苷酶(EC 3.2.1.51,EC 3.2.1.63,EC 3.2.1.111,EC 3.2.1.127)专一作用于岩藻多糖及岩藻低聚糖末端的α-L-岩藻糖基,由α-1,2、α-1,3、α-1,4或α-1,6连接的α-岩藻糖苷键[29]。α-L-岩藻糖苷酶绝大多数分离于海洋细菌,例如硫磺矿硫化叶菌(Sulfolobussolfataricus)[30]、解岩藻聚糖庄文颖菌(W.fucanilytica)[31]、类芽孢杆菌属(Paenibacillussp.)[32]、蜡样芽胞杆菌(Bacilluscereus)[33]和鼠李糖乳酪杆菌(LacticaseibacillusrhamnosusINIA P603)[34]等。少数岩藻糖苷酶来源于海洋无脊椎动物,例如海燕海星[35]等。
1.3 硫酸酯酶
硫酸酯酶(EC 3.1.6)以催化岩藻多糖中的氨基磺酸盐和硫酸酯的水解为主[36],对于岩藻多糖硫酸酯酶的研究还不多。目前发现能够催化岩藻多糖降解的硫酸酯酶主要来源于海洋细菌,例如解岩藻聚糖庄文颖菌(W.fucanilyticaCZ1127T)[37]、基里蒂玛蒂菌属(Kiritimatiellalessp.)[38]、假交替单胞菌属(Pseudoalteromonassp.)[39]等。
2 岩藻多糖降解酶的酶学性质
由于岩藻多糖降解酶的种类及来源十分广泛,其理化性质也存在着多样性,物种来源、酶的分子质量、环境温度、pH值及一些金属离子等均为影响该酶性质差异的重要因素。表1为部分物种来源岩藻多糖酶的基本酶学性质,其中研究者对分离于海洋细菌的岩藻多糖酶报道最多,且不同细菌来源岩藻多糖酶的分子质量差异巨大。例如来源于C.amphilecti的岩藻多糖酶分子质量为35 kDa[22],而从LuteolibacteralgaeH18分离得到的岩藻多糖酶分子质量可达112 kDa[40]。细菌岩藻多糖酶一般为常温酶,其最适作用温度大多分布在24~35 ℃之间,但来自Flavobacteriumsp.SW的岩藻多糖酶最适温度为45~50 ℃[21]。绝大多数细菌来源的岩藻多糖酶在pH值中性或弱碱性范围内均有较高的酶活性,其中分离于Flavobacteriumalgicola的岩藻多糖酶最适pH值为9.0,是目前发现耐受性最强的岩藻多糖酶[41]。与细菌来源的岩藻多糖酶相比,分离于无脊椎动物或海洋真菌的岩藻多糖酶在最适温度和最适pH值等方面存在较大差异。目前发现的来源于海洋真菌的岩藻多糖酶最适温度普遍高于无脊椎动物和海洋细菌,如分离于Fusariumsp.LD8的岩藻多糖酶具有耐热性,其最适温度达到了60 ℃[23]。不仅如此,分离于无脊椎动物和海洋真菌的岩藻多糖酶最适pH值均为酸性,其中来源于无脊椎动物光棘球海胆的岩藻多糖酶最适pH值仅为3.0,是典型的嗜酸酶[27]。此外,一些岩藻多糖酶的活性还受到金属离子和无机盐离子的影响,例如钙离子能够显著增加岩藻多糖酶Mef2的活力,而抑制岩藻多糖酶Fda1活力[16-17];岩藻多糖酶Fhf1对氯化钠溶液的最高耐受浓度为0.5 mol/L,岩藻多糖酶Fda1能够在1 mol/L氯化钠溶液中保持最佳酶活性[16]。
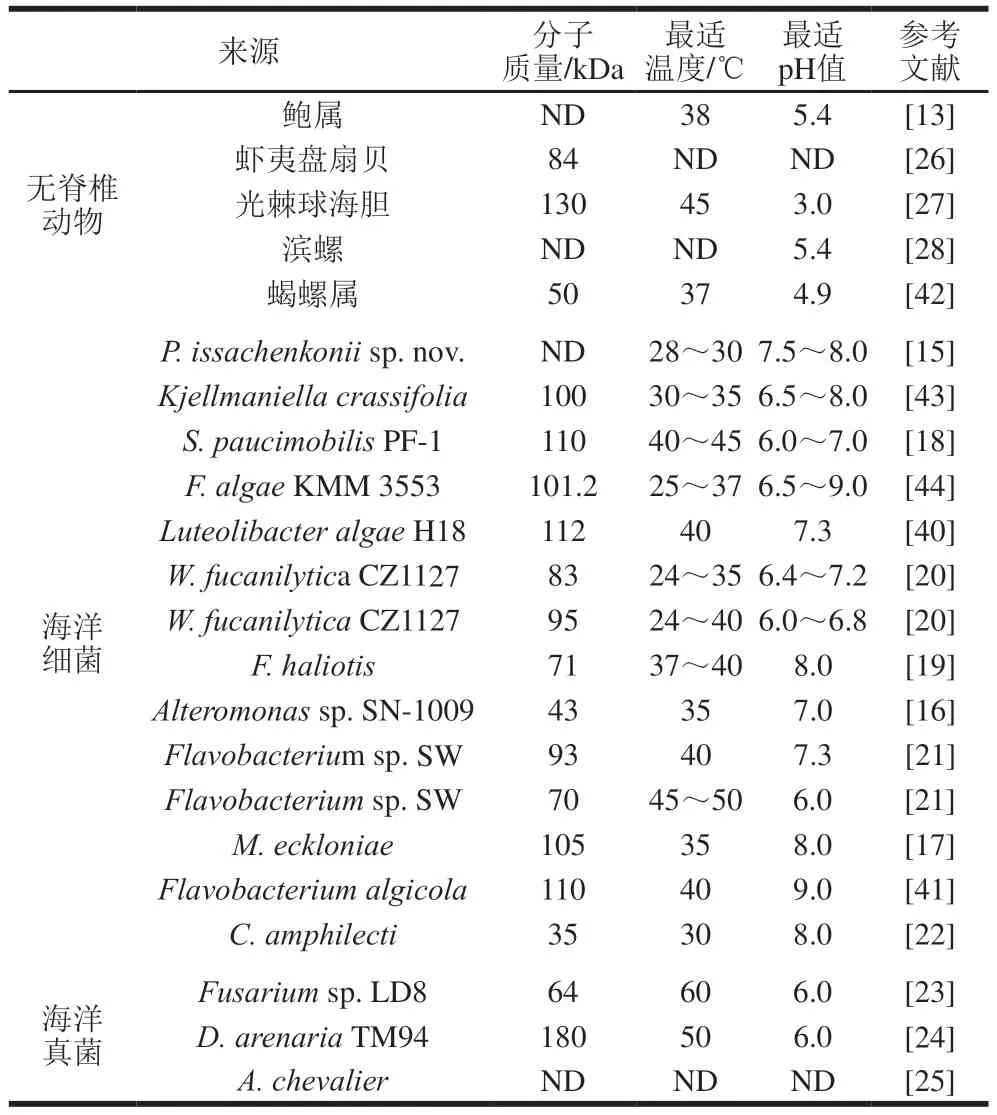
表1 不同来源岩藻多糖酶的酶学性质Table 1 Enzymatic properties of fucoidanases from different sources
岩藻糖苷酶一般分离于海洋细菌,且多数使用大肠杆菌等对其进行异源重组表达和后续性质研究。已有文献报道的重组岩藻糖苷酶分子质量差异较大,约在40~90 kDa之间。不同细菌来源的重组岩藻糖苷酶的最适温度也不尽相同:几种岩藻糖苷酶的最佳作用温度约为50 ℃,例如分离于Paenibacillussp.3179、B.cereus2-8和L.rhamnosusINIA P603的岩藻糖苷酶[32-34],而来自W.fucanilytica的岩藻糖苷酶最适温度仅为25~30 ℃[31]。绝大多数岩藻糖苷酶的最适pH值约在4.0~7.0之间,其能够很好地适应酸性环境。少数分离于无脊椎动物的岩藻糖苷酶某些酶学性质与细菌相比有较大区别,例如来源于海燕海星的岩藻糖苷酶最适温度高达70 ℃,这在细菌岩藻糖苷酶中鲜有报道[35]。
有关岩藻多糖硫酸酯酶的研究相对较少,目前已报道的几种硫酸酯酶在不同的温度、金属离子等环境中也表现出较大差异。例如Silchenko等[37]发现来源于菌株W.fucanilytica中的重组岩藻多糖硫酸酯酶SWF1和SWF4最适pH值均为7.8~8.4,最适温度分别为40~45 ℃和30~35 ℃,且硫酸酯酶SWF1是一种钙离子依赖性酶,而SWF4的活性不受钙离子的影响。分离于海参肠道细菌的硫酸酯酶PsFucS1也具有钙离子依赖性,其最适pH值为6.5,且具有高达68 ℃的最佳催化温度和较高的热稳定性[39]。
3 岩藻多糖降解酶的作用方式和水解产物
酶最重要的特性是其多样的作用位点、底物特异性与水解产物。岩藻多糖降解酶的作用底物主要为由L-岩藻糖组成的硫酸化多糖[9-10],L-岩藻糖的连接方式以α-1,3连接(图1a)或α-1,3、α-1,4交替连接(图1b)为主,此外还有少数α-1,2或α-1,6连接[9,45]。侧链基团复杂多样,主要由甘露糖、木糖、半乳糖和葡萄糖醛酸等组成[9]。图1显示了3 种岩藻多糖降解酶在部分岩藻多糖中的主要作用位点。由于岩藻多糖底物的复杂性与多样性,不同种类的岩藻多糖降解酶具有不同的作用位点与水解方式,其水解产物也存在着较大差异。

图1 岩藻多糖的结构模型及岩藻多糖降解酶的一般作用位点[45]Fig.1 Structural models of fucoidans and general action sites of fucoidan-degrading enzymes[45]
岩藻多糖酶分为内切型和外切型,两种作用方式的酶能够切割岩藻多糖中以α-1,3或α-1,4连接的岩藻糖苷键。大部分已发现的岩藻多糖酶为内切型,其水解产物多为不同分子质量的岩藻低聚糖,例如Zhu Chenlu等[16]使用高效液相色谱电喷雾离子化串联质谱对来自Alteromonassp.SN-1009的岩藻多糖酶tFda1B水解产物进行分析,结果表明该酶属于内切型α-1,3岩藻多糖酶,水解产物为多样的岩藻低聚糖,且证实部分来自厚叶解曼藻的岩藻多糖是由α-1,3糖苷键连接。Tran等[17]通过核磁共振、底物特异性和系统聚类分析等对来源于糖海带的岩藻多糖酶Mef2的水解产物进行研究,结果表明Mef2能够特异性内切α-1,3连接的糖苷键并释放出具有新分支连接的岩藻低聚糖,成为第一个来自糖海带能够降解极其复杂岩藻多糖的水解酶。然而,来源于Flavobacterium algicola的岩藻多糖酶OUC-FaFcn1仅具备内切α-1,4糖苷键的特异性,通过随机切割方式降解岩藻多糖中的α-1,4糖苷键,生成以双糖为主的产物[41]。同样地,来自F.haliotis的岩藻多糖酶Fhf2Δ484也有α-1,4位点的切割活性,能够释放出含有大量硫酸化2,4-岩藻糖残基的低聚糖,但其底物特异性较低,对来源于3 种海藻(墨角藻、莫氏马尾藻、匍枝马尾藻)的岩藻多糖具有不同程度的水解活性[14]。目前关于外切型岩藻多糖酶的研究比较少,例如Furukawa等[46]从Vibriosp.N-5中分离得到外切型的岩藻多糖酶,其水解产物主要为硫酸化的岩藻糖和岩藻二糖。
岩藻糖苷酶具有较为广泛的底物特异性,绝大多数岩藻糖苷酶为外切型,能够水解以α-1,2、α-1,3、α-1,4或α-1,6连接的岩藻糖苷键并生成多样的岩藻糖或岩藻聚糖等产物,其作用方式与岩藻糖苷酶的来源及GH家族分类密切相关。例如来源于W.fucanilytica的GH29家族岩藻糖苷酶Alf1_Wf能够水解α-1,4岩藻糖基连接的多糖,与合成底物4-硝基苯基-α-L-岩藻吡喃糖苷生成游离的岩藻糖和岩藻低聚糖[47],而来自Paenibacillusthiaminolyticus的GH151家族岩藻糖苷酶可以水解芳香基岩藻糖和以α-1,2、α-1,3、α-1,4、α-1,6糖苷键与乙酰葡糖胺相连接的双糖[48]。
岩藻多糖硫酸酯酶也具有内切或外切酶活性。Silchenko等[37]的研究发现,来源于菌株W.fucanilyticaCZ1127T的硫酸酯酶SWF5为内切型酶,可以去除由α-1,3和α-1,4糖苷键交替相连的L-岩藻多糖中的4O-硫酸化作用,但不能水解由α-1,3糖苷键连接成骨架的岩藻多糖[49]。此外,不同的硫酸酯酶对底物中硫酸基的存在位置和分支存在与否也具有特异性。硫酸酯酶SWF1和SWF4均为外切型酶,硫酸酯酶SWF1不能催化低聚糖4F2,3S(6S)、4F2,3,4S(7S)和6F2,3S(6S)脱硫,但能催化2O-硫酸化四糖4F2S(4S)脱硫,与此相反,硫酸酯酶SWF4可以催化低聚糖4F2,3S(6S)、4F2,3,4S(7S)和6F2,3S(6S)脱硫,但不能催化四糖4F2S(4S)脱硫[37]。
4 岩藻多糖降解酶的结构和催化机制
依据酶的分子结构和催化特征,不同类型的岩藻多糖降解酶被划分到GH29、GH95、GH107、GH139、GH141、GH151和GH168等多个GH家族中。除了GH139和GH168家族的岩藻多糖降解酶结构仍未被解析之外,其他家族岩藻多糖降解酶的三维结构已被报道。
GH29家族岩藻多糖降解酶为α-L-岩藻糖苷酶。根据序列同源性和底物特异性,该家族又被分为GH29-A和GH29-B两个亚家族:GH29-B仅作用于α-1,3和α-1,4连接的岩藻糖苷键,而GH29-A的底物特异性更为广泛[50-51]。此外,GH29-A对底物4-硝基苯基-α-L-岩藻吡喃糖苷或2-氯-4-硝基苯基-α-L-岩藻吡喃糖苷表现出一定的降解活性,但GH29-B不具有此特性[50]。Summers等[52]对GH29家族的岩藻糖苷酶GH29_0940进行结构解析,发现该酶由N端的一个催化结构域和C端的两个碳水化合物结构域(carbohydrate-binding domain,CBM)组成,其整体结构呈现出一个N端TIM桶状结构域、中心β-三明治结构域和C端β-三明治结构域。TIM桶状催化结构域为(β/α)8/7的排列,缺失的一个α-螺旋被一个长而曲折的loop所取代,其中Asp162和Glu220分别作为催化亲核试剂和质子供体[52]。
与GH29家族的酶不同,GH95家族的岩藻糖苷酶具有更加严格的底物特异性和更为简单的结构。例如岩藻糖苷酶AfcA是仅具有α-1,2位点切割活性的GH95家族水解酶,该酶的结构包括4 个区域:一个N端的β区域、一个螺旋连接区域、一个(α/α)6螺旋桶状区域和一个C端的β区域。在其催化结构域中,Glu566和Asn423分别作为催化酸和催化亲核试剂[53]。
GH107家族为内切α-1,4岩藻多糖水解酶。来源于Flavobacteriaceae的FcnA是GH107家族中第一个被发现的岩藻多糖酶,该酶由1 个N端结构域(400 个氨基酸组成)、3 个重复的类免疫球蛋白折叠结构域和1 个C端结构域(80 个氨基酸组成)组成[54]。Vickers等[55]对来源于Psychromonassp.SW5A的GH107家族岩藻糖苷酶P5AFcnA进行解析,发现P5AFcnA的N端存在一个包含(β/α)8的桶状结构域,但其中的1 个α-螺旋和1 个β-折叠并未形成规则的二级结构,而是分别形成无规卷曲。结合X射线晶体学和核磁共振的进一步分析表明,GH107家族酶与GH29家族的岩藻糖苷酶具有相同的结构和催化机制,但GH107家族岩藻糖苷酶的催化残基高度不保守,可能反映出GH107家族的酶对不同结构的岩藻多糖降解具有特殊性[55]。
来自BacteroidesthetaiotaomicronVPI-5482的α-2-O-甲基-L-岩藻糖苷酶是目前唯一被发现的GH139家族酶,但其分子结构和催化机制仍未被解析[56]。在GH141家族中,唯一被解析结构的是内切岩藻糖苷酶BT_1002,该酶也来源于BacteroidesthetaiotaomicronVPI-5482,其催化结构域折叠成1 个右旋平行β-螺旋,催化中心表面形成1 个延伸的催化口袋,或许有助于容纳木糖和岩藻糖组成的双糖,并且活性口袋中的D523和D564对该酶的催化起到重要作用[56]。对GH151家族酶的研究也比较少,来源于Paenibacillusthiaminolyticus的α-L-岩藻糖苷酶同工酶2也是唯一被解析结构的岩藻多糖降解酶。该酶包括3 个结构域:1 个由(β/α)8的TIM桶状结构构成的N端结构域、2 个较短的α-螺旋和3 个310螺旋,其中活性结构域位于TIM桶状结构的中心;中心结构域的结构类似于Rossmann折叠,由4 个α-螺旋和11 个β-折叠组成β桶状结构;C端结构域是β-三明治折叠类型,由1 个长loop和1 个包含2 个β-折叠的C端loop组成[48]。GH151家族的岩藻糖苷酶已被证实对芳基岩藻糖、由α-1,2键与半乳糖相连的岩藻糖、α-1,2(或α-1,3、α-1,4、α-1,6)键与乙酰葡糖胺相连的岩藻糖有活性,但对岩藻三糖或具有L-岩藻糖-α-1,2-D-Galp表位的六糖无活性[29]。此外,碳水化合物活性酶数据库(http://www.cazy.org/)中还注释了一种新型的GH168家族岩藻多糖降解酶,该家族酶首次报道于2020年,是一种来源于细菌W.fucanilytica的内切型α-1,3岩藻糖苷酶FunA[57]。超高性能排阻层析-质谱和核磁共振分析表明,FunA能够特异性切割2-O-硫酸化和非硫酸化岩藻糖残基相连的α-1,3糖苷链,定向突变结果表明D206和E264是发挥FunA功能的关键位点[57]。
部分岩藻多糖降解酶晶体结构信息汇总如表2所示。

表2 部分岩藻多糖降解酶的晶体结构信息Table 2 Crystal structural information of some fucoidan-degrading enzymes
5 岩藻多糖降解酶的应用
5.1 酶促合成具有特殊活性的岩藻低聚糖
岩藻多糖及岩藻低聚糖逐渐成为生物活性分子的重要来源,例如第一个阿尔茨海默病药物和两种能够抑制SARS-CoV-2的抗病毒候选药物原料均含有岩藻多糖[62]。由于岩藻多糖降解酶对岩藻多糖底物的水解功能,使其具备了酶促合成高附加值岩藻低聚糖的巨大潜力。生物来源的酶促反应具有条件温和、不污染环境和反应效率高等优点,水解法生产的低分子质量岩藻聚糖不仅保留了天然多糖的生物活性,而且作为功能性药品或食品成分更容易被人体消化吸收,因此酶法制备岩藻低聚糖具有非常好的应用前景。近年来,研究者对岩藻多糖降解酶及其在制备岩藻低聚糖中的应用进行了较多研究,发现利用岩藻多糖降解酶能够实现岩藻低聚糖的制备,并且产生了一些具有抗癌、抗血栓或功能性益生元等特殊生理活性的岩藻低聚糖。在功能性药物研发方面,Silchenko等[63]利用重组表达的岩藻多糖酶FFA1制备了岩藻低聚糖,并且证明该岩藻低聚糖具有一定的抗癌活性。此外,Silchenko等[64]利用来源于海洋细菌F.algae的重组岩藻多糖酶对天然岩藻多糖进行改性,获得分子质量为50.8 kDa的聚合物,并证实聚合物对结肠癌细胞具有抑制作用。Xu Zhigang等[65]使用岩藻多糖酶对海带多糖进行水解,制备了分子质量为25.8 kDa的海带低聚糖,动物实验表明海带低聚糖能够显著抑制血栓的形成。在功能性食品研发方面,使用岩藻糖苷酶能够生产岩藻糖基化的人乳寡糖,这种人乳寡糖具有益生元、免疫调节等生理活性,在婴儿大脑发育过程产生诸多有益影响[66]。因此,岩藻多糖降解酶在制备具有特殊生理活性岩藻低聚糖的过程中发挥了关键作用,这些低聚糖具有极高的应用价值,为未来功能性药物或食品的研发提供重要基础。
5.2 疾病诊断与治疗
人的血清N-聚糖能够作为一些癌症、幽门螺杆菌感染等疾病的免疫反应指标,而具有不同底物特异性的岩藻糖苷酶已被用作验证和监测这些聚糖生物标志物[29,67-68]。此外,岩藻多糖降解酶也可应用到某些疾病的治疗中,例如Manivasagan等[69]通过链霉菌生产新型岩藻多糖酶以绿色合成金纳米颗粒,生物合成的金纳米颗粒对HeLa细胞毒性呈剂量依赖性,这表明新型的岩藻糖苷酶能够应用于抗癌治疗。也有研究表明用岩藻多糖内切酶Fhf1水解岩藻多糖,其中获得的低分子质量岩藻聚糖会影响骨再生过程[70]。
5.3 推断岩藻多糖的分子结构
岩藻多糖是一种分子结构极为复杂的硫酸生物多糖。根据作用方式和底物特异性的不同,岩藻多糖降解酶对岩藻多糖的作用位点和水解产物存在一定的差异性,不同结构的岩藻低聚糖产物的生物活性也存在多样化。某些特定的岩藻多糖降解酶能够专一性地水解特殊类型的糖苷键,结合不同光谱分析、气相色谱-质谱分析及核磁共振等研究方法,能够有效地推断复杂岩藻多糖的分子结构。例如一些光谱分析方法可以用于阐明岩藻多糖硫酸基和糖苷键的位置或分子质量大小,而编码酶基因的宏基因组学分析可以揭示酶的作用位点和机制,该技术与光谱技术的结合能够针对性地研究岩藻多糖潜在的水解位点[9]。探究岩藻多糖酶的作用位点以及了解岩藻多糖的结构能够更好地改进生产岩藻低聚糖的技术,更加有效地制备具有特殊生物学活性和功效的低聚岩藻多糖。
6 结语
岩藻多糖为海洋特异性多糖,每种岩藻多糖的分子组成、结构及硫酸化程度均存在一定的差异。组成岩藻多糖的单糖包含木糖、甘露糖、半乳糖和其他一些稀有的单糖,并且单糖取代基的糖苷键类型也不尽相同。除此之外岩藻多糖中还存在大量的非碳水化合物取代基,因此岩藻多糖结构具有十分复杂的多样性,对岩藻多糖的结构研究也相当困难。尽管如此,不同分子质量的岩藻多糖因其具有抗癌、免疫刺激、抗氧化、抗感染等生物学活性和毒性低等特点而备受关注。
岩藻多糖降解酶是进一步挖掘岩藻聚糖资源的重要研究工具,同时岩藻多糖的多样性也为发现具有不同特异性的岩藻多糖降解酶提供了机会。目前,国内外关于岩藻多糖酶制剂制备的研究还较为缺乏,同时由于不同岩藻多糖降解酶的酶学性质、水解方式、家族分布和分子结构等差异较大,对该酶的认识也有待不断地增加和完善。不同特异性的岩藻多糖降解酶能够将岩藻多糖水解为特定分子质量的岩藻聚糖,并且有助于研究不同岩藻聚糖的特殊生物学活性,同时也为进一步阐明岩藻多糖的结构提供新的思路。因此,充分分析不同性质、结构和作用方式的岩藻多糖降解酶不仅对酶的功能多样性研究提供重要的理论支持,而且对于通过基因编辑和蛋白质工程实现酶的定向改造,研发催化性能更好的酶制剂,获得特殊功效的低分子质量岩藻多糖具有重要的应用意义。

