人参多糖部分酸水解物的HPLC-ESI-QTOF-MS分析
廖俊昭, 王远兴, 陈熠敏
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
人参(Panax Ginseng)为五加科植物人参(PanaxginsengC.A.Mey.)的干燥根,是第三纪孑遗植物,也是珍贵的中药材,在我国药用历史悠久[1]。而人参多糖是人参发挥其药理活性的主要成分[2]。现代药理学认为,人参多糖具有抗肿瘤[3,4]、免疫调节[5]、降血糖[6]、造血调控[7]等功能。
糖谱是指多糖通过化学或酶降解的方式获得多糖降解产物片段,利用一定的色谱及其联用手段分离鉴定,形成能够表征一类多糖降解产物结构特征的图谱,一种多糖只有一个特征糖谱,因此,糖谱可认为是具有一定识别功能的指纹图谱。质谱作为一种通用型检测器,使用范围广,检测灵敏度高,对于复杂样品中的未知成分可以提供精确的分子质量[8]。高效液相色谱-电喷雾电离高分辨飞行时间质谱(HPLC-ESI-QTOF-MS),使用离子束压缩技术和增强型离子反射镜技术,具有极高的质量精确度和分辨率;进行MS/MS分析时,可对选定的母离子施加多个裂解电压,其与色谱技术在线联用,可为分析物结构解析提供详尽的信息,已越来越多地应用于糖类物质的研究中。
本研究通过HPLC-ESI-QTOF-MS研究人参多糖部分酸水解产物,是研究人参糖谱及其他中草药糖谱的一种新的尝试;同时研究了不同糖苷键在MS/MS分析时的断裂规律,并确定了人参多糖中的糖苷键链接类型,扩展和丰富了质谱技术在糖类研究中的应用。
1 实验部分
1.1 仪器与试剂
Agilent1290超高效液相-380蒸发光散射检测器联用仪,Agilent1290超高效液相-6538高分辨率飞行时间质谱联用仪(美国,Agilent公司)。
乙腈(色谱纯级,德国Merk公司);甲酸(色谱纯,美国ROE公司);海藻糖、曲二糖、β-1,3-葡二糖、纤维二糖、蜜二糖(分析纯,美国Aladdin公司)。实验用水为Milli-Q超纯水。
人参(五加科植物人参PanaxginsengC.A.Mey.的干燥根),购自江西樟树药材市场,产地为东北长白山。
1.2 人参多糖的制备[9]
人参充分烘干,粉碎机粉碎。干粉用无水乙醇浸泡12 h,除去大部分醇溶物质后,加20倍体积水,于95 ℃提取三次,每次3 h。5 000 r/min离心15 min,合并上清液,减压旋蒸浓缩至适当体积后,浓缩液经5 000 r/min离心15 min后取上清,得含人参多糖浓缩液。浓缩液加乙醇至80%,于4 ℃下醇沉12 h,5 000 r/min离心15 min,取沉淀依次经乙醚、丙酮、无水乙醇洗涤,真空冷冻干燥后即得人参多糖。
1.3 人参多糖的部分酸水解
取25 mg人参多糖于安培管,加入0.4 mol/L H2SO45 mL,抽真空封管,于90 ℃下水解60 min后取出水解液,用过量BaCO3中和至中性,离心,取上清液定容至5 mL。上清液过0.22 μm滤膜,备用。
1.4 实验条件
1.4.1HPLC条件色谱柱:Grace Prevail ES糖分析柱(250×4.6 mm,5 μm);流动相:A为乙腈,B为0.1%甲酸水溶液;梯度程序:0~10 min,80%A;10~38 min,80~42%A;38~40 min,42%~80%A;40~45 min,80%A。进样量:20 μL;流速:0.8 mL/min。
1.4.2ESI-QTOF-MS及MS/MS条件离子模式:负离子模式;电离模式:电喷雾电离(ESI)。电离电压3 500 V,干燥器温度350 ℃,干燥器流速10 L/min,碰撞电压120 V,Skimmer电压65 V,质量范围(m/z):50~3200,采集频率1.02 s-1。MS/MS裂解电压:1~15 V。
1.5 五种标准二糖的HPLC-ESI-QTOF-MS及MS/MS分析
将五种标准单糖(葡萄糖)和二糖(海藻糖、曲二糖、β-1,3葡二糖、纤维二糖、蜜二糖)配成一定浓度的水溶液,过0.22 μm滤膜,进行HPLC-ESI-QTOF-MS和MS/MS分析。
1.6 人参多糖部分酸水解产物的HPLC-ESI-QTOF-MS及MS/MS分析
人参多糖按1.3步骤处理后,经HPLC-ESI-QTOF-MS分析,并对水解液中低聚合度寡糖进行MS/MS分析。
2 结果与讨论
2.1 五种标准二糖的HPLC-ESI-QTOF-MS及MS/MS分析
选择五种结构确定的二糖:海藻糖、曲二糖、β1,3-葡二糖、纤维二糖、蜜二糖,分别代表了五种糖苷键类型,其结构信息如图1所示:
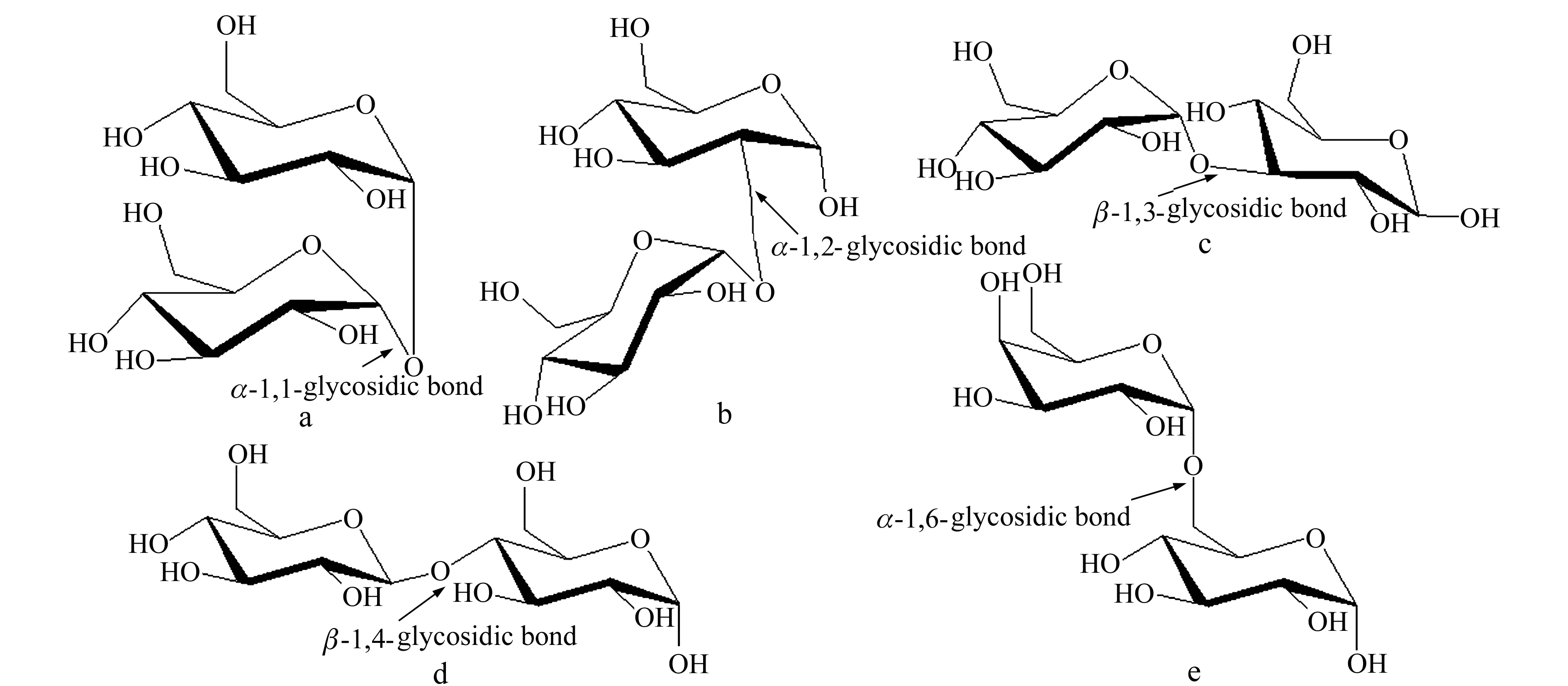
图1 五种二糖的结构式及糖苷键类型
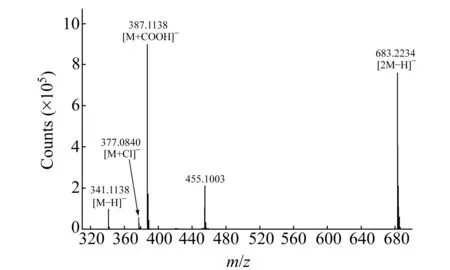
图2 二糖的一级质谱图
实验使用的五种标准二糖均为两个六碳糖脱水缩合而成,其中海藻糖、曲二糖、β1,3-葡二糖、纤维二糖的单糖组成均为两个葡萄糖,而蜜二糖的单糖组成为一个半乳糖和一个葡萄糖;五种二糖的相对分子量均为342.1162,故它们在MS分析时没有差异。图2所示为二糖的电喷雾电离高分辨飞行时间质谱的负离子模式分析结果。其中,m/z341.1138[M-H]-、m/z377.0840[M+Cl]-、m/z387.1138[M+COOH]-、m/z683.2234[2M-H]-为负离子模式下糖类常见的加合方式,而m/z455.1003的加合质量约为112.98,其加合的物质不明确,但因为基于本方法分析的所有的单糖和低聚糖时均出现了该质量加成,故在图2上依旧标明该质荷比。
MS/MS分析时,对目标物施加额外的裂解电压,可将目标物打碎并呈现一定的断裂规律。对于不同糖苷键链接的低聚糖乃至多糖,具有不同的断裂规律,及质量丢失不同。实验选择的五种二糖,其糖苷键链接位点分别不同(图2),故在MS/MS分析中反映出不同的裂解规律。图3为五种二糖的MS/MS图。
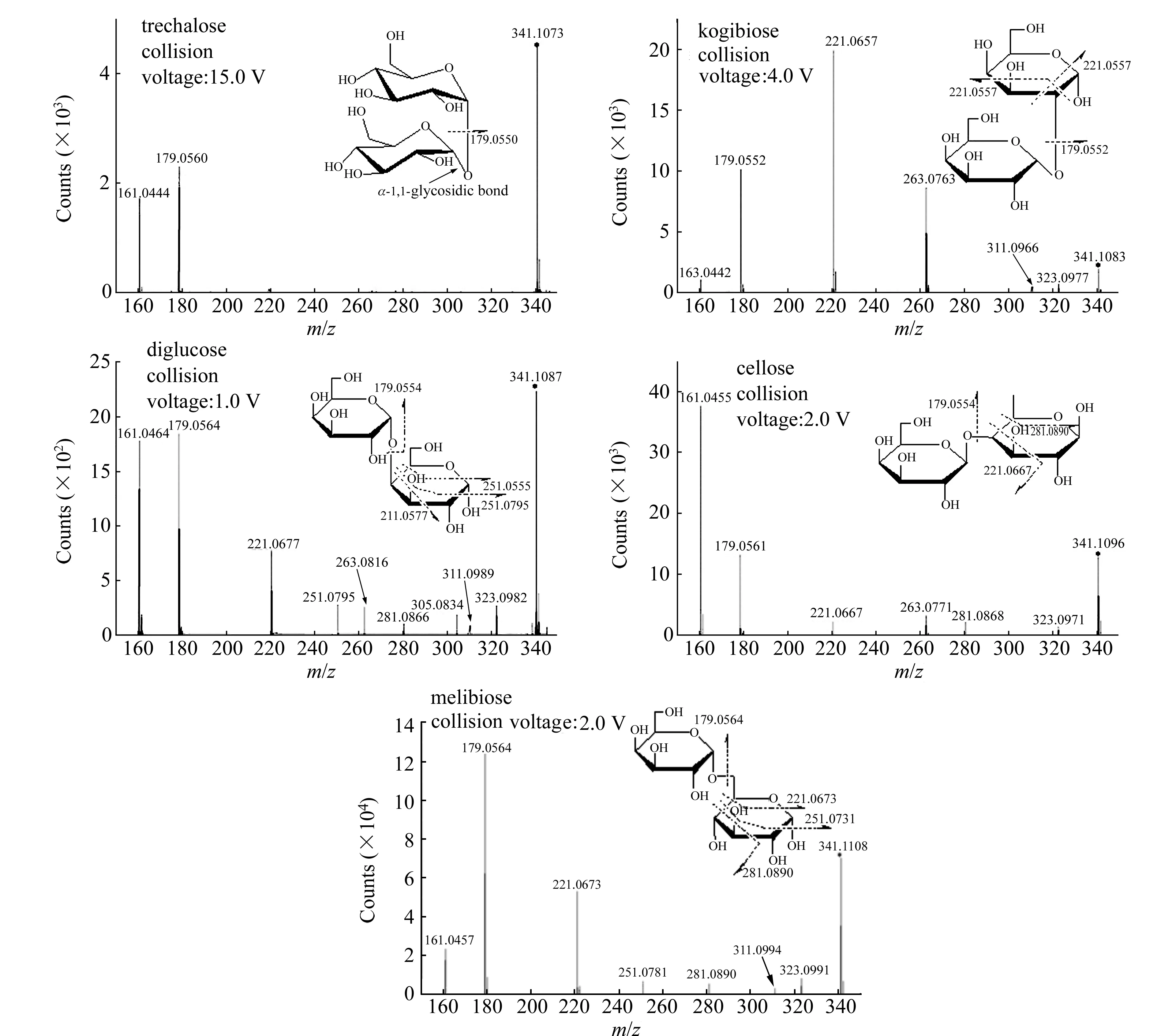
图3 二糖的二级质谱图及断裂位置
如图3:1,1-糖苷键的二糖(海藻糖)在MS/MS中只出现m/z161、179的碎片质谱峰,分别为母离子341丢失180和162形成的碎片,其中162为一个糖残基(C6H10O5)丢失,180(C6H12O6)为丢失162后再丢失一分子H2O。其他糖苷键类型二糖的MS/MS中除m/z162、180的质量丢失外,还有其他分子量更小的质量丢失,丢失规律表现有:所有糖苷键类型都存在120.04(C4H8O)的质量丢失;除1,6-糖苷键(蜜二糖)外,其余三种糖苷键类型都存在60(C2H4O2);1,2-糖苷键(曲二糖)和1,4-糖苷键(纤维二糖)不存在90(C3H6O3)的质量丢失,且1,2-糖苷键同时不存在60的质量丢失;1,3-糖苷键(β-1,3-葡二糖)和1,6-糖苷键(蜜二糖)存在90(C3H6O3)的质量丢失,且1,3-糖苷键存在78(C2H603)的质量丢失,该质量丢失为母离子丢失60后再丢失一分子H2O。
综合五种二糖在负离子模式下的电喷雾电离高分辨飞行时间质谱的MS/MS分析结果发现:(1)不同的糖苷键链接位点的不同可导致质量丢失不同(表1);(2)除直接从结构上断裂导致的质量丢失(30、60、90、120、162),还存在脱水导致的质量丢失(18、78、180);(3)糖残基能完整断裂,糖残基断裂的位置一定是非1C位的糖苷键位点(图3结构式中糖残基完整断裂时的位点选择)。表1归纳了五种糖苷键类型在MS/MS中的断裂规律。

表1 不同糖苷键链接类型的双糖其在电喷雾电离高分辨飞行时间二级质谱中的断裂规律
2.2 人参多糖部分酸水解产物的HPLC-ESI-QTOF-MS分析
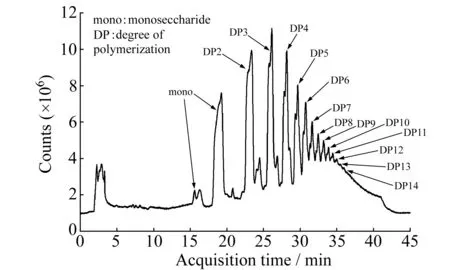
图4 人参多糖部分酸水解样在负离子模式下的总离子流色谱图
按照1.4的色谱和质谱条件,对人参多糖的部分酸水解产物(主为单糖和低聚糖)进行质谱分析,其总离子流色谱图(TIC)见图4,从中可观察到从单糖到聚合度14的人参低聚糖。结合质谱数据可知,单糖在15~20 min出现,低聚糖在22~40 min按聚合度由低到高依次出现,且在质谱图中可观察到DP34的聚糖。
人参粗多糖部分酸水解产物在负离子模式下的MS信息见表2。人参多糖部分酸水解产物中,单糖离子峰的m/z179.0555为己糖,未发现含戊糖、脱氧戊糖、脱氧己糖、糖醛酸等其他单糖类型的离子峰。人参低聚糖的单电荷离子峰以大约162 Da递增,双电荷离子峰以大约81 Da递增,三电荷离子峰以大约54 Da递增,符合己糖规律。表明本研究提取的人参粗多糖为己糖及其残基组成的多糖。
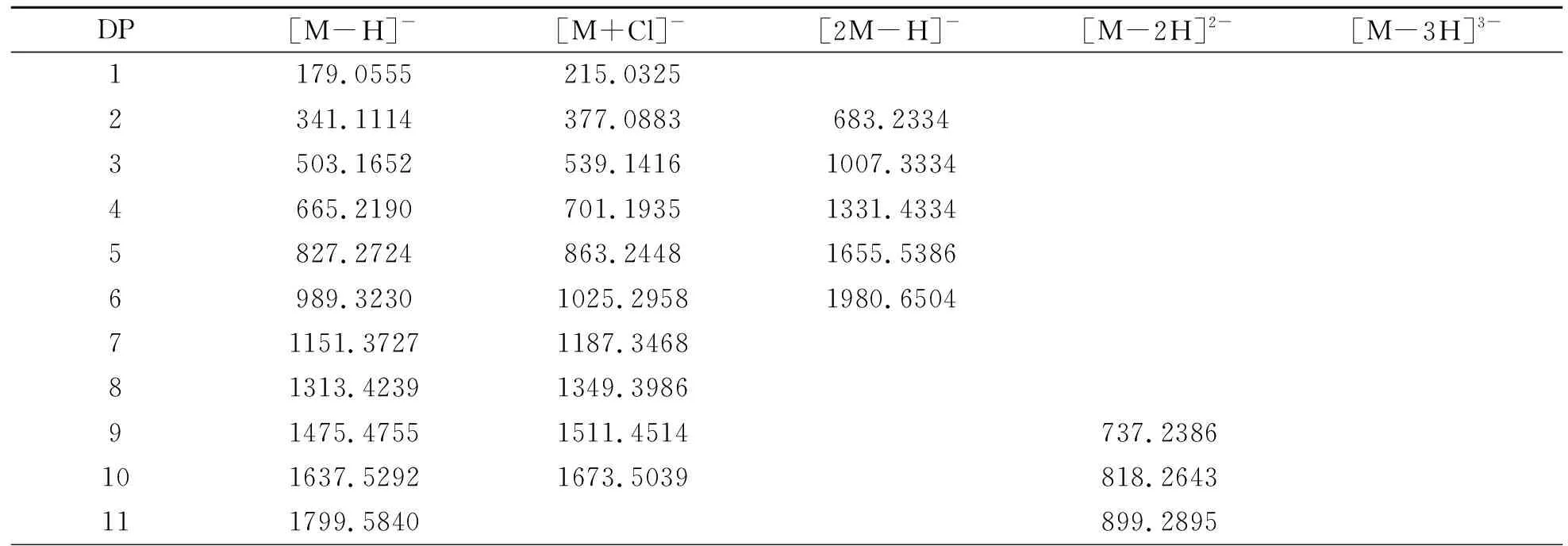
表2 人参多糖部分酸水解样中单糖和低聚糖在负离子模式下的质谱数据
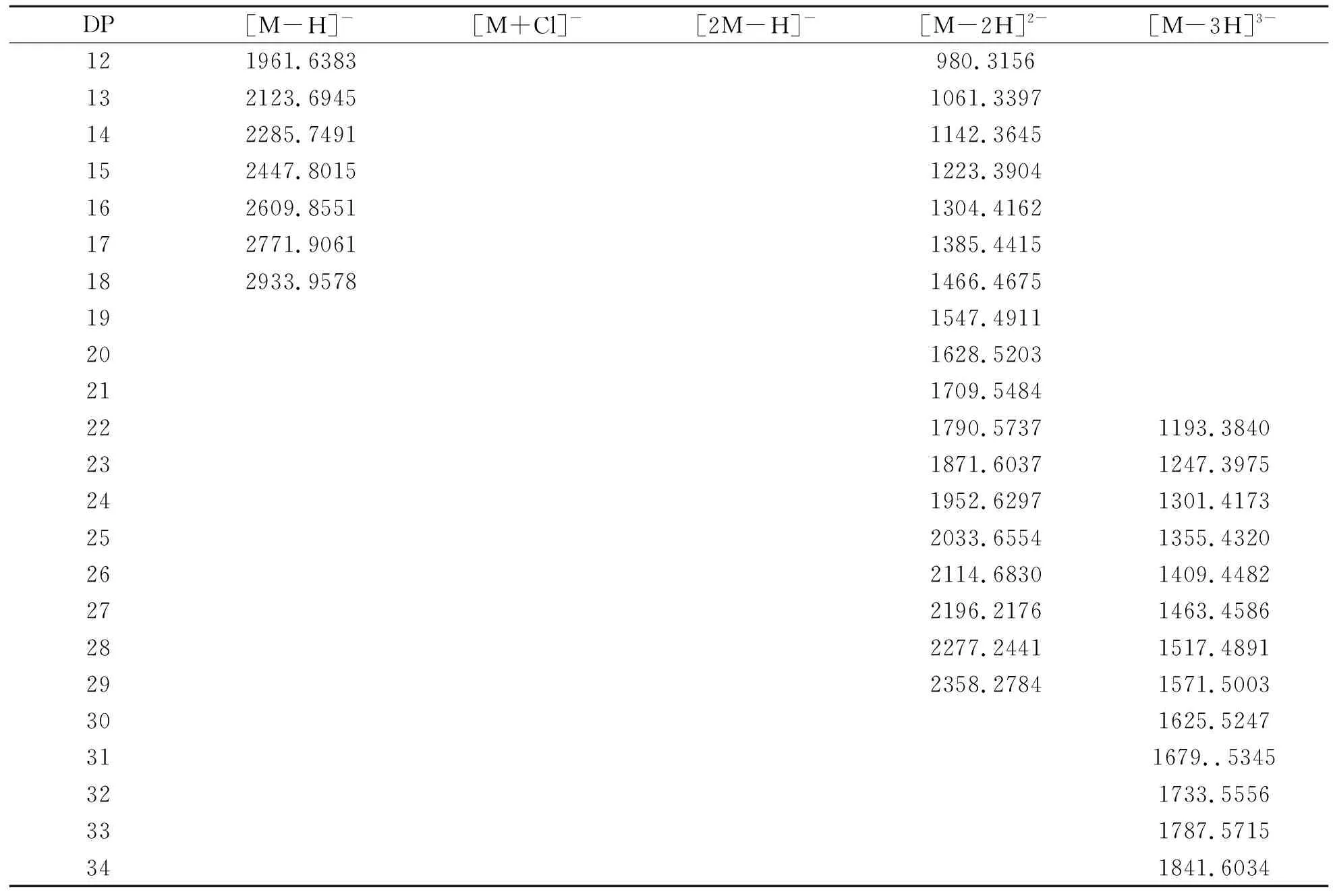
(续表2)
2.3 人参多糖部分酸水解物的HPLC-ESI-QTOF-MS/MS分析
对人参多糖部分酸水解产物中聚合度为2、3、4的低聚糖进行MS/MS分析,参照2.1中不同糖苷键的低聚糖在MS/MS分析时的断裂规律,判断人参低聚糖乃至人参多糖的糖苷键类型。
图5为人参二糖的MS/MS图,在人参二糖二级质谱峰内,发现两种了断裂规律(质量丢失不同)。人参二糖1的MS/MS图中出现了m/z323、281、263、221、179和161的碎片离子质谱峰,质量丢失分别为18、60、78、120、162和180,其断裂规律符合1,4糖苷键;人参二糖的MS/MS图中出现m/z323、281、263、251、221、179和161的碎片离子质谱峰,质量丢失分别为18、60、78、90、120、162和180,其断裂规律符合1,3糖苷键。故人参二糖的MS/MS分析结果显示:人参二糖中含以1,3糖苷键链接的和以1,4糖苷键链接的两种二糖。
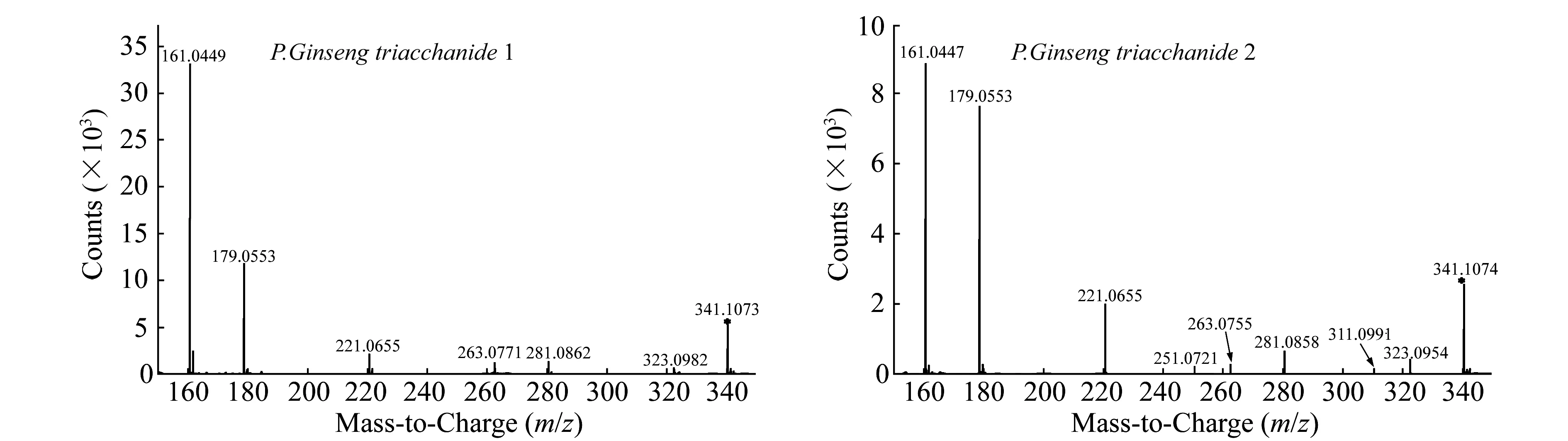
图5 人参二糖的二级质谱图
人参三糖和人参四糖的MS/MS分析结果与人参二糖类似(图略),同时出现符合1,4糖苷键和1,3糖苷键裂解规律的碎片离子。人参低聚糖的MS/MS结果表明人参粗多糖中含有1,3糖苷键和1,4糖苷键,与采用传统方法研究人参多糖结构的相关文献报道[10,11]一致。
3 结论
本研究采用高效液相色谱-高分辨飞行时间质谱研究人参指纹性糖谱的方法,研究不同糖苷键在二级质谱分析时的断裂规律,建立基于飞行时间质谱分析确定糖类物质中糖苷键链接位点的方法。发现了不同糖苷键在二级质谱分析时的断裂规律,建立依靠质谱分析快速确定糖类糖苷键类型的方法。结果表明人参多糖是由己糖及其残基通过1,3糖苷键和1,4糖苷键链接构成。
研究的不足之处在于:糖类物质由于单位结构和组成的特殊性,其同分异构现象十分普遍,仅仅依靠质谱检测很难对糖类物质的进行定性分析,只能确定糖类物质的化学式(如低聚糖的聚合度),无法确定其具体结构;限于酸水解方法的局限性,无法确定糖苷键在多糖链的具体位置。之后的研究将对人参多糖基于特异性1,3糖苷键和1,4糖苷键水解酶作用下酶解产物的MS及MS/MS分析。

