PCR-DGGE法分析海参花酶解物对小鼠肠道菌群的影响
白雅婷,,, ,,,
(1.集美大学水产学院,福建 厦门 361021;2.集美大学生物工程学院,福建 厦门 361021;3.漳浦县海洋与渔业局,福建 漳浦 363200)
0 引言
海参是录属于海参纲(Holothuroidea)的海洋棘皮动物,其体内含有许多具有重要生物学活性的物质,如海参多糖、海参阜苷、多肽、胶原蛋白等[1]。海参活性物质具有抗氧化、延缓衰老、增强免疫力、抗肿瘤、抗凝血、抗血栓、降血脂及促进细胞生长等作用[2],有“海中人参”之称[3]。“海参花”是海参生殖腺组织(即海参的肠和卵)的俗称。现代药理研究结果表明,海参花不仅含有与海参体壁相似的胶原蛋白成分[4],其赖氨酸[5](人体必须的氨基酸)的含量甚至高于体壁。此外,有资料显示海参肠卵对前列腺炎、糖尿病、缺铁性贫血、再生障碍性贫血、胃和十二指肠溃疡等疾病的防治也有明显的作用[6]。目前,在福建省的海参加工过程中,绝大多数的海参花被直接丢弃,不仅浪费当地海参资源,还对当地的生态环境造成严重的污染。为了增加海参资源利用率,提高经济附加值,国内外已经开展海参花再利用方面的研究。
海参花经蛋白酶水解,再通过离心、过滤、浓缩、冻干等一系列的处理后,所得的酶解产物在保留海参花原有营养物质的基础上,得到了以海参多糖、多肽为主要成份的活性物质[7-9],具有代谢能耗低、更容易吸收的特点[10]。目前,对海参花酶解物中的活性物质的功效评价研究多集中在对实验动物的体外抗氧化活性和免疫指标的检测上。研究表明,海参多糖能够增强免疫力、抑制肿瘤[11],海参多肽具有降血压、抗氧化[12-13]等生理功能。
肠道微生物是宿主的重要组成部分,对宿主的生长、发育、健康和生理代谢有着重要的作用,有“被遗忘的器官”之称[14]。正常情况下,肠道内的菌群之间维持着动态平衡的关系,一旦这种平衡关系被打破,肠道菌群失调,就会引起宿主疾病。研究表明,宿主摄入一些益生菌、益生元和活性物质,有助于维持肠道菌群平衡,改善和调节肠道微生物之间的关系。例如,黄芪多糖和低聚异麦芽糖具有促进肠道有益菌增殖的作用[15];高剂量的菊糖和大蒜多糖可促进失调的小鼠肠道菌群的恢复[16];大蒜多糖在连续喂食的情况下可改善小鼠的肠道微生态环境[17]。目前,海参花酶解物对实验动物肠道微生物影响方面的研究还未见报道。
本研究从灌喂海参花酶解物的小鼠粪便中提取微生物总DNA,运用PCR-DGGE技术来分析小鼠肠道菌群的动态变化,从肠道微生物的角度来研究海参花酶解物中的生物活性物质对宿主的影响,为海洋生物活性物质的功效评价及开发利用提供新的思路。同时,在提升海参内脏的附加值,促进废物利用,减少环境污染等方面也具有重要意义。
1 材料与方法
1.1 实验设计
将海参花湿物料进行冷冻干燥,粉碎并过40目筛,在50 ℃、pH=7.0的条件下,加木瓜蛋白酶(料液比1∶50)3000 U/g,酶解6 h。将得到的酶解液置于95~100 ℃加热,15 min钝化灭酶并以4000 r/min离心15 min。取上层清液过膜浓缩,冻干得到海参花酶解物[18]。
试验选取50只4~6周龄,体重18~22 g,SPF级的昆明种小鼠。先将小鼠在SPF动物房暂养一周,之后随机分为5个实验组,每组10只。5组具体为:灌喂生理盐水的空白组(control group,以下简写为C)、灌喂海参花酶解物低剂量组(low dose group,以下简写为L)、灌喂海参花酶解物中剂量组(medium dose group,以下简写为M)、灌喂海参花酶解物高剂量组(high dose group,以下简写为H),以及灌喂抗坏血酸组(Vc group,以下简写为V),各组灌喂剂量分别为:C组 10 mg/kg、L组0.3 g/kg、M组0.6 g/kg、H组1.2 g/kg、V组10 mg/kg。小鼠在分组后用三硝基苯酚标记。所有试验小鼠每天定时给药1次,每次0.3 mL,连续灌喂4周。
1.2 小鼠粪便样品总DNA的提取
分别在灌喂小鼠的第0、7、14、21、28天取小鼠粪便样本,每实验组取3个平行样品,每个平行样品取3只小鼠的粪便。所取样品使用天根生化科技有限公司的粪便基因组DNA提取试剂盒进行总DNA的提取。提取的总DNA于-80 ℃冰箱保存备用。
1.3 PCR-DGGE、图谱分析及条带回收测序
PCR扩增:使用细菌16S rRNA基因通用引物27F和1492R进行第一轮PCR扩增,扩增产物稀释10倍后作为模板,以GM5F和518R为引物进行巢氏PCR扩增。总反应体系为50 μL:Ex Taq酶25 μL、GM5F 1.5 μL(10 μmol/L)、518R 1.5 μL(10 μmol/L)、模板 1 μL、去离子水21 μL。反应条件:预变性94 ℃ 5 min;94 ℃ 1 min,60 ℃复性1 min,72 ℃延伸2 min,进行25 个循环;72 ℃延伸10 min。扩增产物用于后续DGGE分析。
DGGE及图谱分析:在变性剂梯度为40%~60%,电压60 V,温度60 ℃的条件下电泳14 h。电泳结束后用GV-Ⅱ核酸染料染色30 min,之后用蒸馏水泡洗10 min,然后在凝胶成像仪下拍照。用Quantity One软件进行DGGE图谱聚类分析。计算每个样品中微生物的多样性指数:丰富度(S),香农指数(H)和均匀度(E)。其中S为丰富度,即每一条泳道的条带数目[19],H和E的计算公式为:H=∑PilnPi,Pi=Ni/N,Ni表示样品上第i个条带的吸收峰面积,N表示样品中所有条带吸收峰的总面积。E=H/lnS。
从DGGE凝胶中选取优势条带进行割胶回收。扩增纯化后送往上海美吉生物医药科技有限公司进行测序。
1.4 序列分析及系统进化树的构建
测得的序列与NCBI数据库进行比对,用Clustal 1.83对序列进行排比分析,运用MEGA 5.0软件采用邻接法(neighbor-joining method)构建系统发育树。
2 结果与分析
2.1 灌喂海参花酶解物对小鼠体重的影响
在4周的饲养时间内,各组小鼠均正常取食、活泼好动、精神状态良好、被毛光滑且色泽油亮,无褪毛、停止进食、精神萎靡的状况发生。说明灌喂物质对小鼠的生长、觅食、消化及其物质代谢无显著影响。表1是小鼠在灌喂4周后体重增长情况,其中灌喂海参花酶解物的低剂量组与其他组相比体重增长较大,但各组间的差异均未达显著水平(P>0.05)。

表1 海参花酶解物对小鼠体重的影响
说明:*表示与抗坏血酸组比较差异显著,P<0.05。
Notes:* Indicates significant difference compared with Vc group,P<0.05.
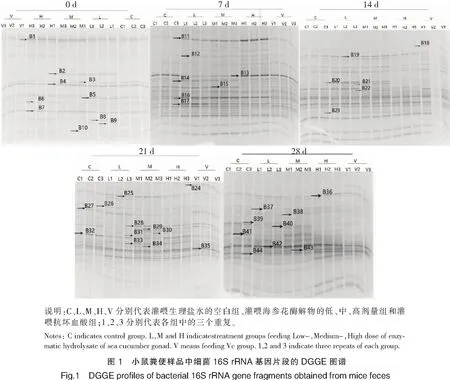
2.2 DGGE图谱分析
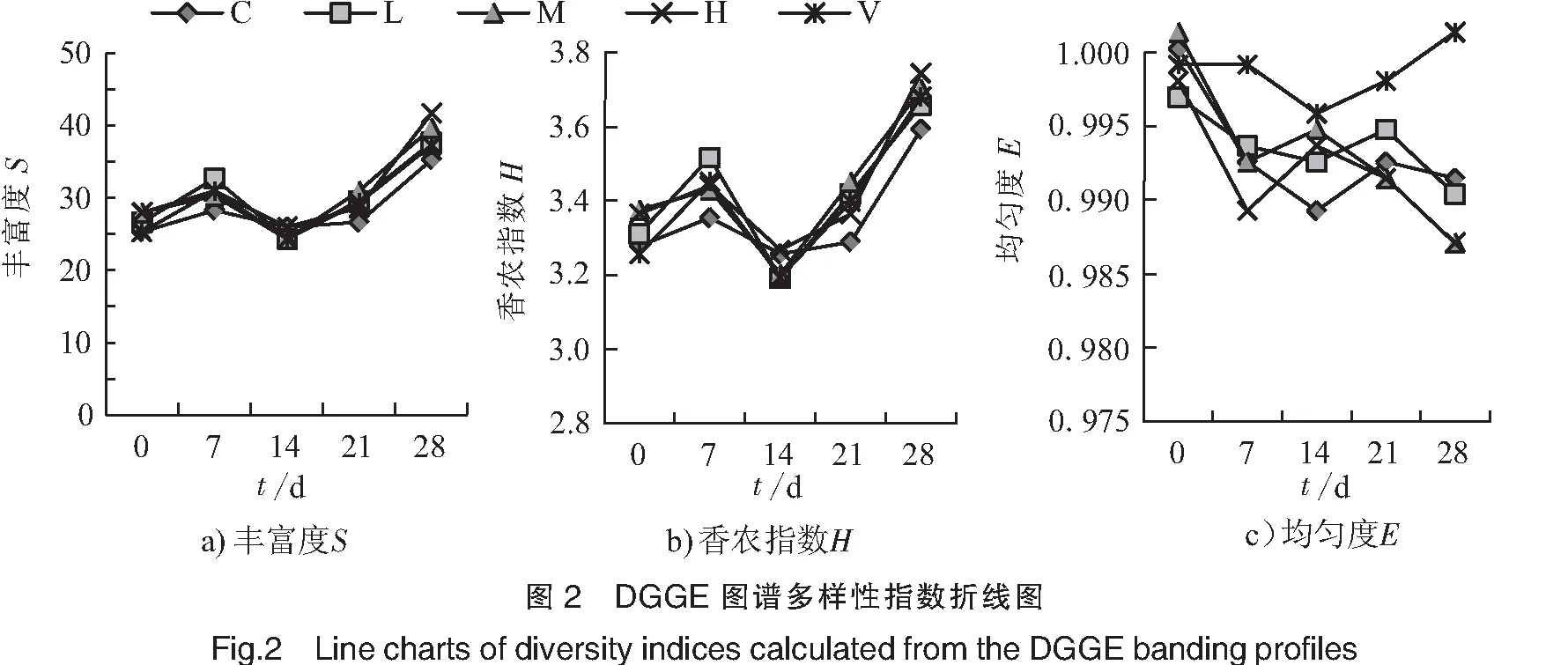
图1是灌喂海参花酶解物第0、7、14、21、28天后小鼠粪便样品DNA的PCR-DGGE电泳图。计算得到的各样品多样性指数见图2。从整体来看,小鼠肠道中微生物多样性随着实验进程呈现一个先升高后降低再升高的过程,且各组样品均表现出相似的趋势。同一采样时间下,第21、28天的中剂量组比同时期空白组的S值显著提高(p<0.05);第14、28天的中剂量组比同时期空白组的H值显著提高(p<0.05),其他处理组与同时期空白组之间虽有差异,但均未达显著水平。各不同处理组相比,第7天的中剂量组与同时期低剂量组的S、H值相比显著提高(p<0.05),第21天的中剂量组与同时期高剂量组的S、H值相比显著提高(p<0.05)。抗坏血酸组与同时期空白组、海参花酶解物处理组相比虽有差异,但均未达到显著水平。上述结果说明:灌喂适宜浓度(中剂量)的海参花酶解物可对小鼠肠道微生物多样性产生影响。
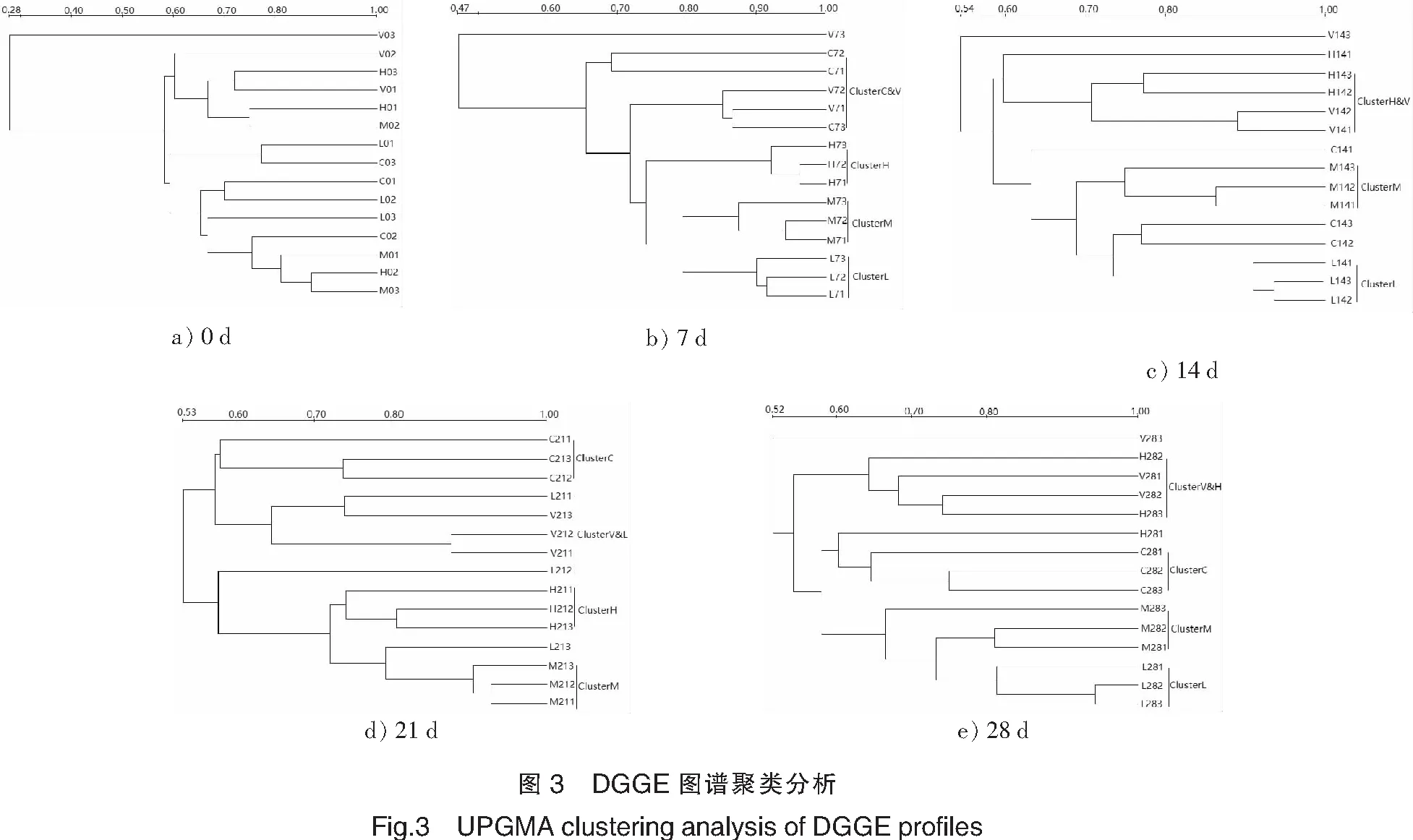
运用UPGAMA Tree对DGGE图谱进行聚类分析,结果见图3。从整体上来看,各时间段样品大致分为3~5个分枝。0天样品聚类结果显示,未灌喂任何物质的各小鼠之间存在个体差异,样品聚类较为随机。灌喂小鼠后第7天,灌喂海参花酶解物的小鼠粪便样品与其他样品分开,它们彼此聚为一大类,说明灌喂海参花酶解物的小鼠肠道中微生物发生了明显变化。进一步分析发现,灌喂海参花酶解物浓度不同对小鼠肠道微生物群落影响不同,灌喂高、中、低浓度的小鼠粪便样品分别聚类为Cluster H、Cluster M和Cluster L,而其他样品(灌喂抗坏血酸组样品和空白组样品)未完全分开。灌喂后第14天,海参花低剂量和中剂量组仍然分别聚类,并与其他样品分开;高剂量组与抗坏血酸组样品聚在一起;空白组样品较松散地与Cluster L和Cluster M聚在一起。灌喂后第21天,空白组样品单独聚类,与其他样品差异较大;灌喂海参花中、高剂量组(Cluster M和H)分别聚类;低剂量组较为分散;抗坏血酸组样品基本聚类在一起,但与低剂量组未完全分开。实验进行到第28天时,低剂量组和中剂量组分别聚类,并与空白组分开;高剂量组虽较为分散,但也与空白组分开,基本与抗坏血酸组聚在一起。上述结果说明:与灌喂生理盐水的空白组相比,在各采样时间点,灌喂海参花酶解物均对小鼠肠道微生物产生了较明显的影响。在实验初期(第7天),灌喂抗坏血酸的样品与空白组样品之间差异不明显,但随着灌喂时间的延长,灌喂抗坏血酸组对小鼠肠道微生物的影响逐渐显现,它们与空白组样品分开,而与灌喂海参花的一些高剂量组样品聚在一起。
2.3 系统发育分析
将DGGE图谱上所标识的条带切胶回收,共得到44条序列,序列在NCBI上通过BLAST比对,并运用Clustal1.83和MEGA5.0软件构建系统进化树(见图4)。系统进化分析结果表明,小鼠粪便样品中微生物群落大致可分为5类:拟杆菌门(Bacteroidetes)、变形菌门(Probeobecteria)、厚壁菌门(Firmicutes)、脱铁杆菌门(Deferribacteres)以及未鉴定的细菌克隆子。其中:未鉴定的细菌克隆子所占比例较大,约占所测序列数量的68%,拟杆菌门约占15%,变形菌门约占11%,其余占6%。

结合DGGE图谱分析,条带B1(B28、B40、B3、B13)、B7、B8(B35、B42、B43)、B9(B44)、B19(B36)、B11(B24)、B12(B18)、B15、B25、B26(B37)、B32(B41)分别在第0天、7天、14天、21天、28天的各组样品中频繁出现,且条带较亮,说明这些细菌可能是小鼠肠道菌群中普遍存在的优势类群。测序结果表明,B1(B28、B40、B3、B13)与变形菌门螺杆菌属的Helicobactersp.MIT10-5753相似性最高;B7与厚壁菌门乳酸杆菌属Lactobacillussp.最相似,B1(B28、B40、B3、B13)、B7条带序列的相似性均达到100%。B8(B35、B42、B43)、B19(B36)、B9(B44)均与未鉴定的细菌克隆子最相似,相似性100%,且B8(B35)随着实验时间延长丰度增加。B11(B24)、B12(B18)分别与拟杆菌属Bacteroidesacidifaciens和Bacteroidessp.相似,且相似性达到100%。虽然B11、B12在7天的各组样品中均有出现,但灌喂海参花的三个剂量组中的丰度值明显高于其他两组。B15与脱铁杆菌门Mucispirillum属的Mucispirillumsp.相似。B16、B17、B32(B41)属未鉴定的克隆子(相似性100%),其中B16、B17在灌喂海参花三个处理组中丰度值明显高于空白组和抗坏血酸组。B26(B37)则相似于拟杆菌属Parabacteroidesdistasonis(100%)。B14、B20(B39)、B21只出现在第28天灌喂海参花的低、中剂量组中。B22、B30、B33(B5)、B34则只在灌喂海参花的中、高剂量组中出现。B31也只出现在灌喂海参花的中剂量组中。其余条带B2(B29)、B4、B6、B9、B10、B23、B27(B38)虽不是优势条带,但多在海参花处理组中出现,这些条带也均与未鉴定的细菌克隆子最相似。
3 讨论
海参花作为海参加工过程中产生的废弃物,被大量丢弃,既浪费资源又污染环境。本研究采用PCR-DGGE 技术,通过将海参花酶解产物灌喂小鼠,研究小鼠肠道菌群的变化。PCR-DGGE技术操作简单,重复性好,研究周期短,一次可运行多达32个环境样品。特别是DGGE图谱可以较直观地显示不同样品中微生物的群落结构,在研究多个样品微生物群落结构的差异及其时空动态变化方面具有一定的优势。但,该技术只能检测到环境样品中1%或稍多的细菌类群。新一代高通量测序技术的发展为进一步深入认识环境样品中的微生物提供了重要契机。与以往的分子生物学技术相比,深度测序技术可获得海量数据,偏耗性低,单位运行成本低,并且理论上可检测出环境中所有的微生物[20-21]。后续结合新一代高通量测序技术,将能更为全面地研究海参花活性物质对小鼠肠道菌群的影响。
本研究在小鼠粪便中检测到拟杆菌门(Bacteroidetes)、变形菌门(Probeobecteria)、厚壁菌门(Firmicutes)、脱铁杆菌门(Deferribacteres)等细菌,还检测到大量未鉴定的细菌克隆子。Ley等[22]研究结果显示在小鼠和人类肠道中的优势菌群主要是拟杆菌门和厚壁菌门,在本实验所得结果中,拟杆菌门为优势菌群,变形菌门为次优势菌群,而厚壁菌门在测序结果中所占的比例较小,可能是与DGGE测序条带较少有关。本研究中,拟杆菌属为拟杆菌门的优势菌属,这与王亚君等[23]的研究结果一致。
通过UPGAMA Tree对各不同采样时间采集样品的DGGE图谱进行聚类分析,结果表明,在各不同采样时间采集样品的DGGE图谱分别聚类在一起,但在同一采样时间内,各实验组与空白组样品的DGGE图谱分别聚类,差异明显。说明海参花酶解物对小鼠肠道菌群结构产生了一定程度的影响。测序及系统进化分析结果表明,幽门螺旋杆菌属Helicobactersp.是小鼠肠道中普遍存在的优势菌群,该类菌与慢性胃炎关系密切,是慢性活动性胃炎的一个主要致病菌[24],但在海参花低、中剂量组中该菌丰度较低。有研究表明多糖类益生元在合适的剂量下可以降低和调节肠道内致病菌的数量[25],海参花酶解物是否有此功效尚须进一步验证。厚壁菌门乳酸杆菌属Lactobacillussp.是一类益生菌,普遍存在各样品中,且随着实验时间的延长,该菌在灌喂海参花的处理组中其DGGE条带的灰度值增大。有研究表明,该属中多种菌可降低革兰氏阴性和分枝杆菌的细菌感染[26]。该结果与山茱萸多糖可起到促进小鼠肠道乳酸菌等有益菌的增殖、调节肠道菌群作用的研究结果类似[27]。Bacteroidesacidifaciens普遍存在于各样品中,有文献报道该菌是负责促进大肠中维持肠道稳态的免疫球蛋白IgA产生的主要细菌之一[28]。拟杆菌属中的吉氏副拟杆菌(Parabacteroidesdistasonis)也在各样品中均有出现,该菌是机体内的一种厌氧病原菌[29-30],具有耐药性[31-32]。本研究中,灌喂海参花组中虽有一些特有的菌群,但大都属于未鉴定的细菌克隆子。后续研究将结合高通量测序技术,进一步鉴定这些未知的细菌类群,分离培养差异的微生物类群,并对其功能进行研究,从而进一步阐明海参花酶解物对肠道微生物及宿主的影响,为海洋生物活性物质的功效评价提供新思路。
[1]宋迪,吉爱国,梁浩,等.刺参生物活性物质的研究进展[J].中国生化药物志,2006,27(5):316-319.
[2]崔凤霞.海参胶原蛋白生化性质及胶原肽活性研究[D].中国海洋大学,2007:160.
[3]樊绘曾.海参:海中人参——关于海参及其成分保健医疗功能的研究与开发[J].中国海洋药物,2001,20(4):37-44.
[4]WEN J,HU C,FAN S.Chemical composition and nutritional quality of sea cucumbers[J].Science of Food and Agriculture,2010,90(14):2469-2474.DOI:10.1002/jsfa.4108.
[5]SU X R,LOU Y J,CHANG Y Q,et al.Study on the nutritional components and the antineoplastic activity of polysaccharides of sea cucumber[J].Acta Nutrimenta Sinica,2003,25(2):991-998.DOI:10.3321/j.issn:0512-7955.2003.02.025.
[6]孙伟红,冷凯良,林洪,等.刺参不同部位中主要营养成分分析与评价[J].动物营养学报,2010,22(1):212-220.DOI:j.issn.1006-267x.2010.01.033.
[7]向怡卉,苏秀榕,董明敏,等.复合蛋白酶水解海参生殖腺工艺的研究[J].食品工业科技,2007,28(3):143-146.
[8]曹荣,刘淇,殷邦忠.响应面法优化海参性腺酶解工艺的研究[J].食品科学,2012,33(2):29-33.
[9]王共明,张健,王茂剑,等.仿刺参卵酶解工艺条件优化[J].食品科学,2012,33(23):193-198.
[10]CABRERA A,GARCIA J E.RGD-containing peptides inhibit intestinal regeneration in the sea cucumberHolothuriaglaberrima[J].Developmental Dynamics,2004,231(1):171-178.DOI:10.1002/dvdy.20112.
[11]王志远,李霞,王斌,等.仿刺参肠多糖对免疫功能的影响及抗肿瘤研究[J].农业生物技术学报,2012,20(5):560-567.DOI:10.3969/j.issn.16747968.2012.05.013.
[12]ZHONG Y,KHAN M A,SHAHIDI F.Compositional characteristics and antioxidant properties of fresh and processed sea cucumber(Cucumariafrondosa)[J].Journal of Agricultural and Food Chemistry,2007,55(4):1188-1192.DOI:10.1021/jf063085h.
[13]WANG J F,WANG Y M,TANG Q J,et al.Antioxidantion activities of low-molecular-weight gelatin hydrolysate isolated from the sea cucumberStichopusjaponicus[J].Journal of Ocean University of China,2010,9(1):94-98.DOI:10.1007/s11802-010-0094-9.
[14]ANN M,FERGUS S.The gut flora as a forgotten organ[J].EMBO Reports,2006,7(7):688- 693.DOI:10.1038/sj.embor.7400731.
[15]李树鹏,赵献军.黄芪多糖及益生菌合生元对雏鸡肠道微生态区系的影响[J].家畜生态学报,2005,26(3):21-25.
[16]易安妮,张慧晔,刘宾,等.益生元对抗生素引起的肠道菌群失调的作用[J].中国微生态学杂志,2012,24(4):318-320,323.
[17]张浩琪,魏华琳,刘宾,等.大蒜多糖对小鼠肠道微生态的益生元功能研究[J].中国微生态学杂志,2012,24(2):134-138.
[18]吴国宏.海参花酶解物抗氧化和增强免疫活性研究[D].厦门:集美大学,2016.
[19]AHN J,DAIDOU T,TSUNEDA S,et al.Characterization of denitrifying phosphate-accumulating organisms cultivated under different electron acceptor conditions using polymerase chain reaction denaturing gradient gel electrophoresis assay[J].Water Research,2002,36(2):403-412.
[20]王兴春,杨致荣,王敏,等.高通量测序技术及其应用[J].中国生物工程杂志,2012,32(1):109-114.
[21]冯霞,殷幼平,王中康.现代分子生物学技术在动物肠道微生物多样性研究中的应用[J].应用与环境生物学报,2005,11(3):381-387.
[22]LEY R E,BCKHED F,äTUMBAUGH P,et al.Obesity alters gut microbial ecology[J].Proc Natl Acad Sci USA,2005,102(31):11070-11075.DOI:10.1073/pnas.0504978102.
[23]王亚君,陶聪,李奎,等.无铜饲料对小鼠肠道菌群的影响[J].中国畜牧兽医,2017,44(10):2886-2896.DOI:10.16431/j.cnki.1671-7236.2017.10.009.
[24]吕农华.规范慢性胃炎的诊断与治疗[J].中华消化杂志,2005,25(2):65-66.
[25]周正,马婷,冯澜,等.马齿苋多糖对溃疡性结肠炎小鼠肠道菌群及血内毒素的影响[J].中国微生态学杂志,2014,26(6):646-648.DOI:10.13381/j.cnki.cjm. 201406006.
[26]MARIANO P A,SANDRA M R,SANDRA M C,et al.S-layer proteins fromLactobacillussp. inhibit bacterial infection by blockage of DC-SIGN cell receptor[J].International Journal of Biological Macromolecules,2016(92):998-1005.DOI:10.1016/j.ijbiomac.2016.07.096.
[27]王艳,杨静,沈媛珍.山茱萸多糖调节小鼠肠道菌群失调的作用[J].华西药学杂志,2014,29(4):390-392.DOI:10. 13375/j.cnki.Wcjps. 2014. 04.011.
[28]TSUTOM UY,AKIRA A,AKIHITO A,et al.IgA production in the large intestine is modulated by a different mechanism than in the small intestine:bacteroides acidifaciens promotes IgA production in the large intestine by inducing germinal center formation and increasing the number of IgA+B cells[J].Immunobiology,2013(218):645-651.DOI:10.1016/j.imbio.2012.07.033.
[29]AWADEL-K,ARIEM FM,PATEL P,et al.First report ofParabacteroidesgoldsteiniibacteraemia in a patient with complicated intra-abdominal infection[J].Anaerobe,2010,16(3):223-325.DOI:10.1016/j.anaerobe.2010.01.001.
[30]SONG Y,LIU C,LEE J,et al.“Bacteroides goldsteinii sp.nov.” isolated from clinical specimens of human intestinal origin[J].Clin Microbiol,2005,43(9):4522-4527.DOI:10.1128/JCM.43.9.4522-4527.2005.
[31]BOENTE R F,FERREIRA LQ,FALCAO L S,et al.Detection of resistance genes and susceptibility patterns inBacteroidesandParabacteroidesstrains[J].Anaerobe,2010,16(3):190-194.DOI:10.1016/j.anaerobe.2010.02.003.
[32]BOYANOVA L,KOLAROV R,MITOV I.Recent evolution of antibiotic resistance in the anaerobes as compared to previous decades[J].Anaerobe,2015,31(1):4-10.DOI:10.1016/j.anaerobe.2014.05.004.
[33]袁坤山,郑艺,刘梅.酶解糙刺参内脏团蛋白制备抗氧化肽的工艺研究[J].海洋科学,2014(11):47-55.DOI:10.11759/hykx20131206002.
[34]赵鸿霞,周大勇,秦磊,等.响应面法优化海参卵酶解工艺[J].食品与机械,2010,26(5):114-117.DOI:10.3969/j.issn1003-5788.2010.05.033.

