白细胞介素-1β基因(rs16944)单核苷酸多态性与骨髓增生异常综合征易感性及临床特征的相关性研究
徐 娟,贲海祥,丁琳琳,蔡亚云,陈 婷,姜 铭
(如皋市人民医院 a.血液科;b.检验科,江苏如皋 226500)
骨髓增生异常综合征[1-2](myelodysplastic syndromes,MDS)是一组起源于骨髓造血干细胞系统的恶性血液肿瘤,特征为髓系细胞分化以及发育异常,临床表现为无效造血、难治性血细胞减少、造血功能衰竭,向急性髓系白血病(acute myelogenous leukemia,AML)转化风险高。MDS 的发病机制和易感性可能与基因突变、染色体异常等因素相关,是一种较为复杂的过程[3]。基因多态性其形成机制为基因突变,包括DNA 位点以及片段长度多态性。在DNA 位点多态性中,单核苷酸多态性(single nucleotide polymorphism,SNP)为其中一种,是指在某群体或个体基因组内,单个碱基发生突变,引起群体-群体间或个体-个体间存在差异[4]。不同类型的SNP 会存在不同的易感性,致使MDS发展以及患者预后有明显的个体性差异,因此成为MDS 研究的热点话题。目前,通过免疫方法对MDS 患者进行治疗已获得一定的临床疗效[5];IL-1β 多态性改变被证实与多种肿瘤有关,如胃癌、肝癌、肺癌等[6-7]。但关于IL-1β(rs16944)基因多态性与MDS 易感性及临床特征的关系尚缺乏相关研究。因此,本研究拟分析IL-1β(rs16944)基因多态性与MDS 易感性及临床特征的相关性,现报道如下。
1 材料与方法
1.1 研究对象 本研究为回顾性分析,选择2017年9 月~2020 年1 月如皋市人民医院收治的MDS患者162 例为研究对象,其中男性88 例,女性74 例,年龄20~85(53.54±9.01)岁;同期于本院体检健康且与患者无血缘关系者162 例为正常对照组,其中男性86 例,女性76 例,年龄21~87(54.71±9.53)岁。两组受试者性别、年龄均无显著差异,具有可比性。本研究经我院医学伦理委员会审核批准,患者及家属均签署知情同意书。
诊断分型符合WHO MDS(2016)诊断标准[8],其中难治性细胞减少单系增生异常(refractory cytopenia with unilineage dysplasia,RCUD)者24 例、环形铁粒幼细胞性贫血(Refractory anemia with ringed side,RARS)者13 例、难治性血细胞减少多系增生异常(Refractory cytopenia with multilineage dysplasia,RCMD)者73 例、难治性贫血伴原始细胞增多1 型(Refractory anemia with excess blasts-1,RAEB-1)者11 例、难治性贫血伴原始细胞增多2型(RAEB-2)者29 例、MDS 未确定型(MDS unclassified,MDS-U)者9 例和单纯5q-综合征者3 例。
国际预后积分系统(International Prognostic Scoring System,IPSS)危险分组[9]:低危(0 分)、中危-I(0.5~1 分)、中危-II(1.5~2 分)、高危(≥2.5分);修订版IPSS-R 危险分组[10]:极低危(≤1.5分)、低危(>1.5~3 分)、中危(>3~4.5 分)、高危(>4.5~6 分)、极高危(>6 分)。
1.2 仪器与试剂 实验主要仪器设备 TaqMan 荧光探针(美国Therom Fisher Scientific 公司),ABI Prism 7500 型荧光定量PCR 仪(美国ABI 公司),BC-5800 全自动血液细胞分析仪(迈瑞,深圳)。血液基因组DNA 提取试剂盒(美国Axygen 公司)。
1.3 方法
1.3.1 SNP 基因分型检测:取受试者骨髓或外周血液2 ml 置于EDTA 抗凝管中,常规分离单个核细胞,严格按血液基因组DNA 提取试剂盒说明书提取基因组DNA。通过TaqMan 荧光探针以及荧光定量PCR 仪,严格按说明书进行IL-1β(rs16944)SNP 的测定。IL-1β(rs16944)基因PCR 扩增所需引物及探针由Thermo Fisher公司提供,引物序列:上游5’-TACCTTGGGTGCTGTTCTCTGCCTC-3’,下游5’-GGAGCTCTCTGTCAATTGCAGGAGC-3’。PCR 扩增及基因分析步骤:①制备PCR 反应液(其中2×PCR Master Mix∶40×探针∶双蒸水为125∶6∶69),震荡混匀;②将PCR 板置于冰上,用微量移液器吸取PCR 反应液4 μl,每孔中加入样本DNA 1 μl;③加样完成后,贴光学盖膜;④将PCR 板置于已降湿至4℃的离心机上,2 000 r/min离心1 min;⑤设置反应条件:预变性95 ℃ 10 min;变性95℃ 30 s,退火65℃ 1 min,延伸72℃10 min,循环45 次。
1.3.2 染色体核型分析:24~48h 培养后,收集患者骨髓细胞并常规制片,G 或R 显带,染色体核型根据《细胞遗传学国际命名体制(ISCN 2009)》[11]标准确定,并根据MDS IPSS 细胞遗传学预后分组标准进行分组[12]。
1.3.3 外周血血细胞检测:取空腹静脉血3~4 ml置于EDTA 抗凝管中,8h 内完成检测,通过全自动血液细胞分析仪(仪器定期校准)检测中性粒细胞绝对计数(absolute neutrophil count,ANC)、血红蛋白(haemoglobin,HGB)以及血小板(platelet,PLT),严格按照标准操作流程,取三次平均值。
1.3.4 随访:通过电话或病历查访形式进行随访,随访时间截止2022 年1 月,总生存期(overall survival,OS)被定义为从诊断到死亡或最后一次随访时间。预后不良:转化为AML 或死亡。
1.4 统计学分析 应用SPSS 23.0 软件对数据进行统计学分析,正态分布的连续变量用均数±标准差(±s)表示,组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验;计数资料用频数(%)表示,组间比较采用χ2检验。采用条件Logistic 回归分析不同基因型与MDS 易感性的关系,并以二元Logistic 回归分析结果进行相乘及多因子降维法(multiplication and dimensionality reduction,MDR)的交互作用分析。采用Kaplan-Meier 绘制生存曲线。P<0.05 为差异具有统计学意义。
2 结果
2.1 IL-1β(rs16944)SNP 分析 见图1。经DNA 测序验证,IL-1β(rs16944)基因一致性为100%。

图1 IL-1β(rs16944)基因DNA 测序结果
2.2 两组患者IL-1β(rs16944)位点基因型分布情况 见表1。本研究纳入者的IL-1β(rs16944)检出率为100%。在正常组中,各基因型的分布符合Hardy-Weinberg 定律,且不同年龄段(21~40 岁、40~60岁、>60岁)的差异无统计学意义(χ2=2.434,P>0.05)。MDS 组GG,AG 基因频率以及G 等位基因频率均显著高于正常组(χ2=17.848,13.149,均P<0.05),提示含等位基因G 者MDS 的发生风险较高。

表1 两组患者IL-1β(rs16944)位点基因型分布情况[n(%)]
2.3 IL-1β(rs16944)SNP 与MDS 易感性关系 见表2。加性模型下,与AA 型基因携带者比较,GG,AG 型基因携带者发生MDS 的风险分别为1.689(1.08~2.64)和1.291(1.00~1.66)。显性模型下,G 等位基因携带者(GG+AG)比未携带者(AA)MDS 的发生风险增加34.80%[OR(95%CI):1.348(1.06~1.72)]。调整性别、年龄、BMI 后,AG 型基因携带者与MDS 的发生关联性并不显著,而GG 型基因携带者MDS 的发生风险是未携带者的1.75 倍。

表2 IL-1β(rs16944)SNP 与MDS 易感性关系
2.4 不同等位基因型MDS 患者的临床特征比较 见表3。GG 型基因患者与AG 型基因患者的染色体核型、IPSS 危险分组和IPSS-R 危险分组、ANC,HGB 以及PLT 水平的差异均具有统计学意义(t/χ2=8.867,11.245,9.976,10.489,2.124,3.168,均P<0.05)。两组患者年龄、性别、MDS 分型的差异均无统计学意义(t/χ2=0.789,0.061,3.751,均P>0.05)。
表3 不同等位基因型MDS 患者的临床特征比较[±s,n(%)]
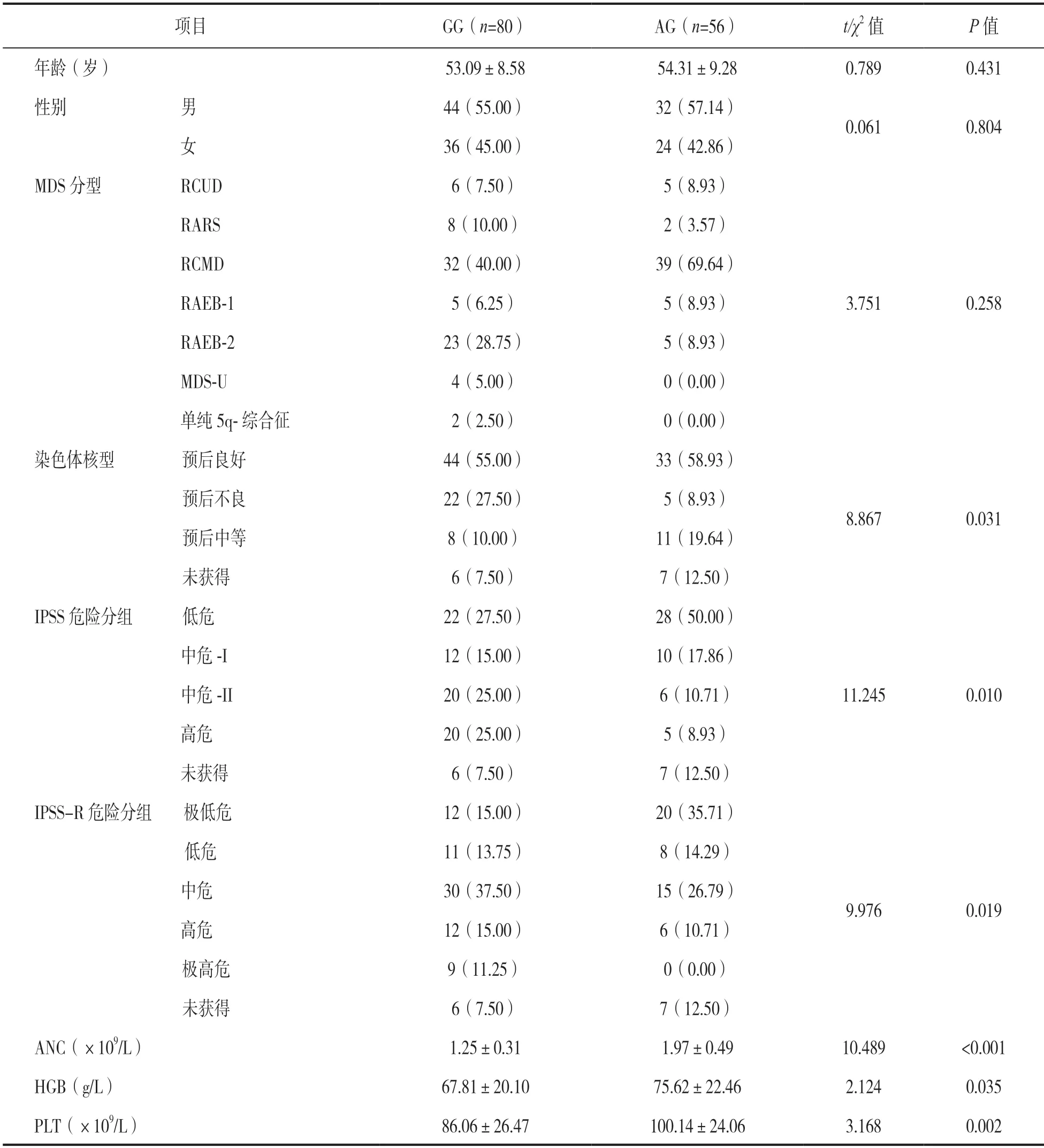
表3 不同等位基因型MDS 患者的临床特征比较[±s,n(%)]
项目GG(n=80)AG(n=56)t/χ2 值P 值年龄(岁)53.09±8.5854.31±9.280.7890.431性别 男44(55.00)32(57.14)0.0610.804女36(45.00)24(42.86)MDS 分型 RCUD6(7.50)5(8.93)RARS8(10.00)2(3.57)RCMD32(40.00)39(69.64)RAEB-15(6.25)5(8.93)3.7510.258 RAEB-223(28.75)5(8.93)MDS-U4(5.00)0(0.00)单纯5q-综合征2(2.50)0(0.00)染色体核型 预后良好44(55.00)33(58.93)预后不良22(27.50)5(8.93)预后中等8(10.00)11(19.64)8.8670.031未获得6(7.50)7(12.50)IPSS 危险分组 低危22(27.50)28(50.00)中危-I12(15.00)10(17.86)中危-II20(25.00)6(10.71)11.2450.010高危20(25.00)5(8.93)未获得6(7.50)7(12.50)IPSS-R 危险分组 极低危12(15.00)20(35.71)低危11(13.75)8(14.29)中危30(37.50)15(26.79)高危12(15.00)6(10.71)9.9760.019极高危9(11.25)0(0.00)未获得6(7.50)7(12.50)ANC(×109/L)1.25±0.311.97±0.4910.489<0.001 HGB(g/L)67.81±20.1075.62±22.462.1240.035 PLT(×109/L)86.06±26.47100.14±24.063.1680.002
2.5 MDS 患者预后不良的多因素COX 回归分析见表4,5。以MDS 患者预后情况为因变量,将表3 中两组差异有统计学意义的指标作为自变量,纳入多因素COX 回归分析。结果显示,GG 型基因、染色体核型预后不良、IPSS 危险分组中危-II 及以上、IPSS-R 危险分组高危及以上、ANC<1.6×109/L,HGB<71.7 g/L,PLT<93.0×109/L 均为MDS患者预后不良的危险因素(均P<0.05)。

表4 变量赋值表

表5 多因素COX 回归分析
2.6 ANC,HGB 以及PLT 与MDS 的关系
2.6.1 二元Logistic 回归分析:见表6。采用Logistic 回归分析IL-1β(rs16944)SNP 与ANC,HGB 以及PLT 的交互作用对MDS 易感性的影响。分别以ANC ≥1.6×109/L 和AA 基因型组合、HGB ≥71.7 g/L 和AA 基因型组合、PLT ≥93.0×109/L 和AA 基因型组合为参照,结果显示,ANC,HGB 以及PLT 均与IL-1β(rs16944)SNP存在交互作用。

表6 交互关系分析
2.6.2 MDR 法:见表7,8 和图2。校正年龄和性别后,分析ANC,HGB 以及PLT 与IL-1β(rs16944)多态性的交互作用。变量赋值情况:X1=ANC,X2=HGB,X3=PLT,X4=IL-1β(rs16944)。四因子模型检验样本准确度为69.19%,交叉验证一致性为100%,模型交互效应显著性检验结果显示差异显著(P<0.05)。可见,具有ANC,HGB 以及PLT 水平异常和IL-1β(rs16944)基因多态性交互组合人群是非上述组合人群MDS 发生风险的2.70倍,差异具有统计学意义(P<0.05)。
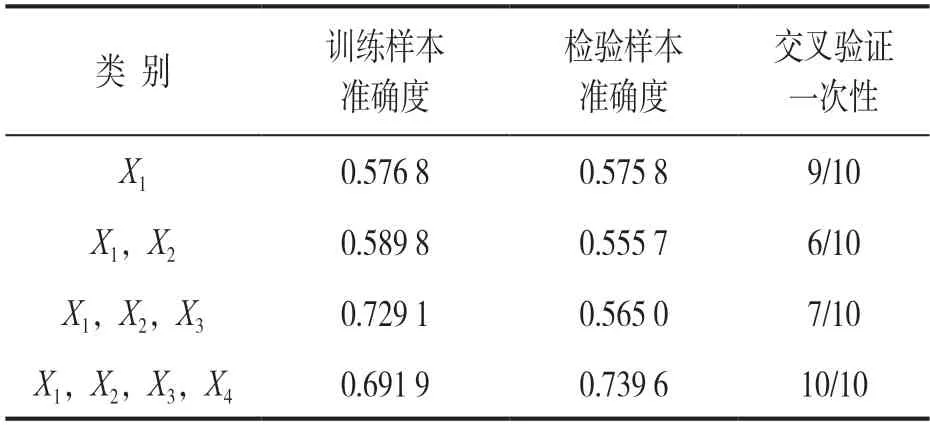
表7 多因子降维法交互模型
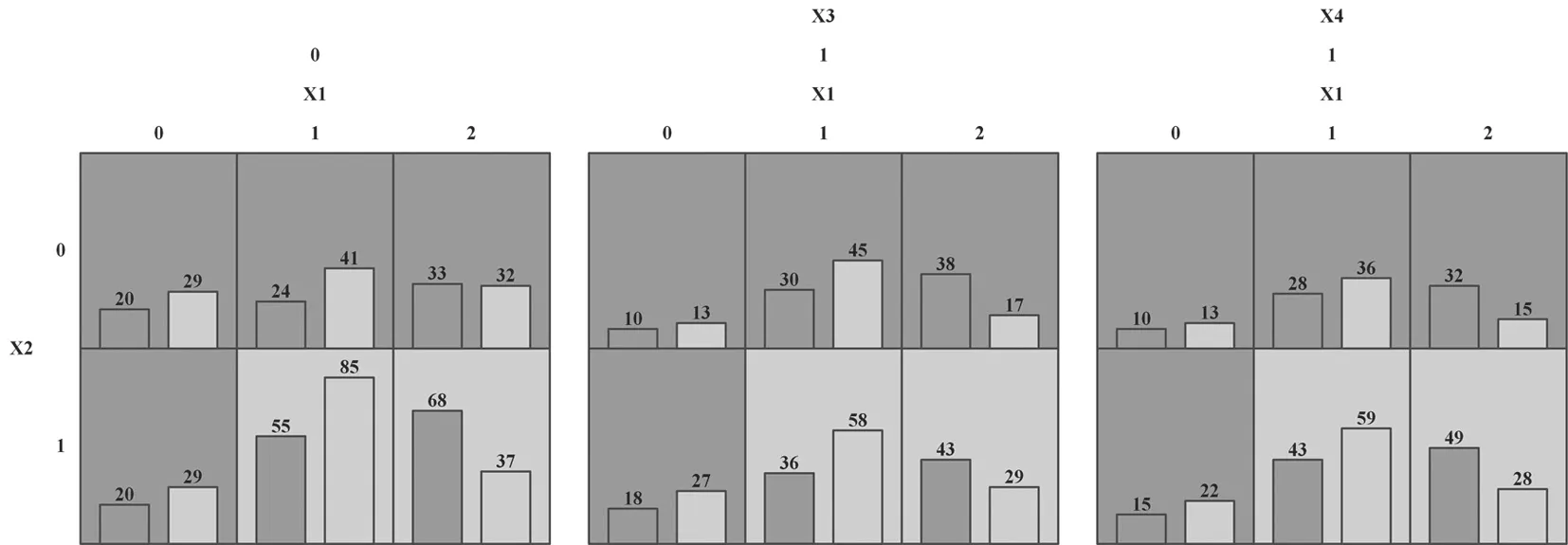
图2 多因子降维交互作用
2.7 IL-1β(rs16944)不同基因型MDS 患者向AML 转化情况比较 162 例MDS 患者共有29 例进展为AML。IL-1β(rs16944) 基因GG 型向AML 转化概率(22 例,27.50%,22/80)显著高于AG 型(5 例,8.93%,5/56)和AA 型(2 例,7.69%,2/26),差异有统计学意义(χ2=7.140,4.396,P=0.008,0.036)。
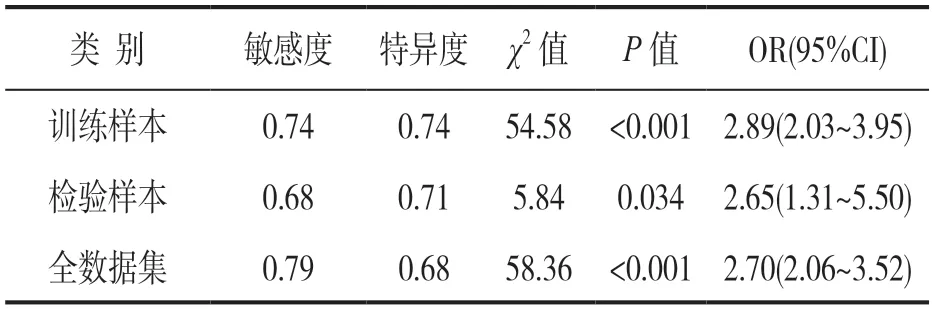
表8 模型交互效应
2.8 生存分析 见图3。采用Kaplan-Meier对IL-1β(rs16944)不同基因型MDS 患者的总生存期(overall survival,OS)率进行单因素分析,结果显示,IL-1β(rs16944)基因GG 型(56.25%,45/80)患者OS 率显著低于AG 型(73.21%,41/56)和AA型(80.77%,21/26),差异有统计学意义(χ2=4.078,5.021,P=0.043,0.025)。

图3 IL-1β(rs16944)不同基因型MDS 患者的生存情况
3 讨论
IL-1 主要由巨噬细胞产生,其和血细胞生长因子同属细胞因子,两者相互协调、相互作用,共同完成造血和免疫调节功能[12-13]。白细胞介素在传递信息、激活与调节免疫细胞、介导T,B 细胞活化、增殖与分化以及在炎症反应中均发挥着重要的作用[14]。IL-1β 是IL-1 的一种分子形式,其参与造血系统、神经内分泌系统、炎症反应以及一些抗肿瘤过程,若其持续地在局部组织内异常合成,可导致发热、炎症反应以及病理改变,为肿瘤细胞提供合适的生长环境,易造成组织损伤以及肿瘤的发展[15-16]。IL-1β 基因多态性可导致其表达量甚至功能发生改变,导致各种疾病的发生。研究表明,IL-1β 基因多态性改变与肿瘤相关,如胃癌、肝癌、肺癌等[17]。因此,对于肿瘤的诊断和临床治疗,IL-1β 基因多态性可为其提供新思路。
本研究选择MDS 患者(n=162)为研究对象,与体检健康者进行对比分析,结果显示,对于MDS 诊断和分型,IL-1β(rs16944)基因多态性可作为一种新指标。其中含等位基因G 者的MDS发生风险较高。G 等位基因携带者[(GG+AG)/AA]比未携带者[GG/(AG+AA)]的MDS 发生风险增加34.80%,而GG 型基因携带者的MDS 发生风险是未携带者的1.75 倍。提示GG 型是MDS 发生的危险因素,IL-1β(rs16944)基因GG 型多态性与MDS 易感性相关。相关研究表明[18],ANC,HGB以及PLT 水平异常均与MDS 密切相关,造血功能异常是MDS 诊断的核心部分。临床上,ANC 是用来衡量患者抵抗力及感染风险的重要指标,此外还可用于辅助诊断血液系统疾病,其主要功能是负责消灭入侵机体的细菌,参与机体炎症反应;HGB是红细胞内运输氧的特殊蛋白质,是使血液呈红色的蛋白,由珠蛋白和血红素组成;血小板是从骨髓成熟的巨核细胞胞浆裂解脱落下来的小块胞质,具有止血功能。本研究中,GG 型与AG 型基因患者的染色体核型、IPSS 危险分组、IPSS-R 危险分组、ANC,HGB 以及PLT 水平的差异均有统计学意义。多因素COX 回归分析结果显示,IL-1β(rs16944)基因GG 型、染色体核型预后不良、IPSS 危险分组中危-II 及以上、IPSS-R 危险分组高危及以上、
ANC<1.6×109/L,HGB<71.7 g/L,PLT<93.0×109/L 均为MDS 患者预后不良的危险因素。提示MDS患者血细胞明显减少,存在造血功能障碍。相关研究表明,MDS 患者中PLT 水平下降者相较水平正常者预后更差[19]。陈纬凤等[20]人的研究表明,HGB 水平降低代表患者高危骨髓增生异常。YIN等[21]人的研究表明,在rs16944 位点的多态性可导致IL-1β 分泌量异常增加,IL-1β(rs16944-G/A)基因的纯合多态性是判断MDS 易感性的遗传学标记,且IL-1β(rs16944-GG)多态性于MDS 后不良类型中较常见,这与患者的血红蛋白水平相关。本研究中Logistic 回归分析结果显示,ANC,HGB以及PLT 均与IL-1β(rs16944)SNP 存在交互作用。MDR 法结果显示,具有ANC,HGB 以及PLT水平异常和IL-1β(rs16944)基因多态性交互组合人群是非上述组合人群MDS 发生风险的2.70 倍。IL-1β(rs16944)基因多态性是通过何种机制影响HGB 水平有待进一步研究。IL-1β(rs16944)基因GG 型向AML 转化概率(27.50%)显著高于AG 型(8.93%) 和AA 型(7.69%);IL-1β(rs16944)基因GG 型(56.25%)患者OS 率显著低于AG 型(73.21%)和AA 型(80.77%)。A 型等位基因可能参与了延缓MDS 患者向AML 转化的过程,有待进一步研究。
综上所述,在MDS 患者中,IL-1β(rs16944)基因GG 型较常见且与其易感性以及患者临床特征密切相关。GG 型患者大多染色体核型预后不良、属于IPSS 高危、ANC,HGB 以及PLT 水平异常且向AML 转化概率高、OS 率低。因此,可通过IL-1β(rs16944)基因检测预测个体MDS 发生风险以及评估预后。

