慢病毒载体介导的circ_0091581通过靶向miR-1256调控肝癌细胞增殖、凋亡和侵袭迁移的机制*
温松奇, 肖 定, 游 建
武汉市第四医院,华中科技大学同济医学院附属普爱医院肝胆胰疝外科,武汉 430033
肝癌是导致死亡的第二大癌症,其中肝细胞癌是原发性肝癌的最主要类型,靶向治疗为不适合手术的肝癌患者带来新的希望[1-2]。研究表明circRNA通过调节各种生物学过程在肝癌进程中发挥作用,可作为诊断、预后生物标志物以及肝癌治疗靶标[3]。研究报道circ_0091581高表达可增强肝癌细胞的活力,抑制其凋亡[4]。circ_0091581表达与肝癌患者的肿瘤大小、无病生存率和总体生存率相关;circ_0091581通过阻止miR-526b降解c-MYC mRNA来促进肝癌细胞的增殖[5]。研究报道miR-1256过表达通过调节结构蛋白家族1(TCTN1)抑制非小细胞肺癌的增殖和迁移[6]。miR-1256通过靶向5-羟色胺3A(HTR3A)抑制甲状腺乳头状癌细胞的增殖和细胞周期进程[7]。circ-DCAF6通过降低miR-1231和miR-1256的水平促进胃癌细胞生长和侵袭[8]。然而miR-1256对肝癌细胞增殖、凋亡和侵袭迁移的影响,及circ_0091581是否通过调控miR-1256影响肝癌进展尚不清楚。因此,本实验旨在研究circ_0091581是否通过调控miR-1256影响肝癌进展。
1 材料与方法
1.1 组织材料
选取武汉市第四医院20例肝癌患者的癌组织及癌旁组织,所有患者均具有完整临床病理资料,术前未进行过放化疗,所有患者均知情且同意。
1.2 细胞与主要试剂
肝癌细胞株Huh7购自深圳市豪地华拓生物科技有限公司;RPMI-1640培养液购自美国Gibco公司;Trizol试剂购自武汉纯度生物科技有限公司;荧光定量试剂盒购自上海研卉生物科技有限公司;四甲基偶氮唑盐比色法(MTT)试剂盒购自上海歌凡生物科技有限公司;Transwell小室、Matrigel购自美国BD公司;凋亡检测试剂盒、蛋白提取试剂盒、双荧光素酶报告基因检测试剂盒购自北京百奥莱博科技有限公司。
1.3 细胞处理与分组
肝癌细胞株Huh7用RPMI-1640培养液培养,将干扰circ_0091581的慢病毒载体和阴性对照转染至Huh7细胞中,分记为si-circ_0091581组、si-NC组;将miR-NC、miR-1256转染至Huh7细胞中,记为miR-NC组、miR-1256组;将干扰circ_0091581的慢病毒载体分别与anti-miR-NC、anti-miR-1256转染至Huh7细胞中,记为si-circ_0091581+anti-miR-NC组、si-circ_0091581+anti-miR-1256组。
1.4 实时荧光定量PCR(RT-qPCR)检测circ_0091581和miR-1256的表达水平
提取组织及细胞总RNA,反转录成cDNA,按试剂盒说明进行PCR,循环条件为95℃ 3 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,共40个循环;相对表达量用2-ΔΔCt法计算。circ_0091581和miR-1256分别以GAPDH和U6为内参,circ_0091581上游引物序列:5′-GGGCTAGACTTACAGATTGGCA-3′,下游引物序列:5′-GTTCCCTTCTTCGGCTGGAT-3′;GAPDH上游引物序列:5′-GATTGCCGTTCATCCATCTT-3′,下游引物序列:5′-AACAGCAAAGGGGTCACATC-3′;miR-1256上游引物序列:5′-GGCGCGATTTTAGTTTATC-3′,下游引物序列:5′-TTTAATTACCAACCGAATACG-3′;U6上游引物序列:5′-CGCTTCGGCAGCACATATACTA-3′,下游引物序列:5′-CGCTTCA-CGAATTTGCGTGTCA-3′。
1.5 MTT检测细胞增殖活性
细胞培养48 h,每孔加入MTT溶液20 μL,孵育4 h后加入二甲基亚砜(DMSO)150 μL,振荡反应10 min使沉淀溶解,用酶标仪于波长450 nm处检测吸光度(A)值。
1.6 Transwell检测细胞迁移和侵袭
各组细胞无血清培养,取200 μL接种于Transwell小室上层,培养24 h,吸去培养液,用棉签轻轻擦去上层细胞,磷酸盐缓冲液(PBS)洗涤,4%多聚甲醛固定30 min,用0.1%结晶紫染色10 min,显微镜下随机选取5个视野进行拍照并计数。细胞侵袭实验在Transwell小室上层加入50 μL基质胶Matrigel,凝固后接种细胞,其余同迁移实验操作。
1.7 流式细胞术检测细胞凋亡
细胞培养48 h,用预冷的PBS漂洗2次,与500 μL的结合缓冲液混匀;先加入10 μL的膜联蛋白Ⅴ-异硫氰酸荧光素(Annexin Ⅴ-FITC),再加入5 μL的碘化丙啶(PI),混匀后避光孵育10 min;用流式细胞仪检测细胞凋亡率。
1.8 蛋白质印迹(Western blot)法检测蛋白表达
提取细胞总蛋白,取50 μL蛋白样品于10%的十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)中进行电泳,转至聚偏二氟乙烯(PVDF)膜,用5 %的牛血清蛋白封闭1 h;加入一抗4℃过夜,加入二抗室温培养1 h,加入化学发光试剂显影,成像后用Image J软件分析各蛋白条带的灰度,蛋白表达水平以目的条带和GAPDH条带的比值表示。
1.9 双荧光素酶报告实验
构建circ_0091581的野生型和突变型荧光素酶载体WT-circ_0091581和MUT-circ_0091581,将其分别与miR-NC和miR-1256共转染至Huh7细胞中,按照说明书检测荧光素酶活性。
将pcDNA、pcDNA-circ_0091581、si-NC、si-circ_0091581转染至Huh7细胞中,按1.4中方法检测miR-1256表达水平。
1.10 统计学方法
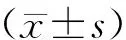
2 结果
2.1 circ_0091581和miR-1256在肝癌组织中的表达
与癌旁组织比较,肝癌组织中circ_0091581表达水平升高(3.22±0.07vs.0.99±0.01),miR-1256表达水平降低(0.37±0.01vs.1.00±0.01),均P<0.05。
2.2 抑制circ_0091581表达对肝癌Huh7细胞增殖的影响
与si-NC组比较,si-circ_0091581组circ_0091581表达水平降低,细胞增殖活性降低,Ki-67表达水平降低,P21表达水平升高(均P<0.05)(图1,表1)。
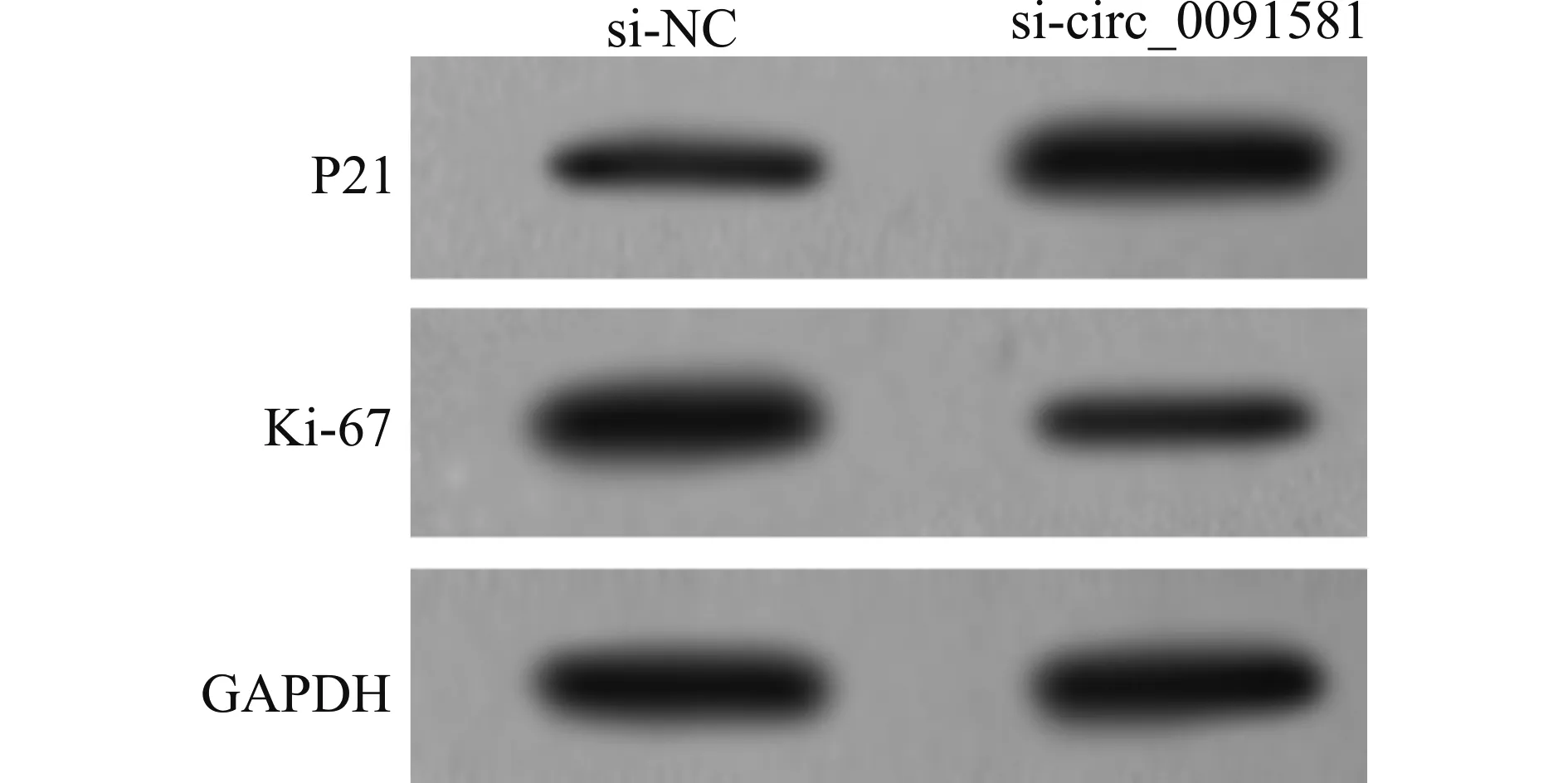
图1 增殖相关蛋白表达
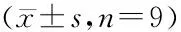
表1 抑制circ_0091581表达对肝癌Huh7细胞增殖的影响
2.3 抑制circ_0091581表达对肝癌Huh7细胞迁移侵袭的影响
与si-NC组比较,si-circ_0091581组迁移、侵袭细胞数减少,MMP-2、MMP-9表达水平降低(均P<0.05)(图2,表2)。
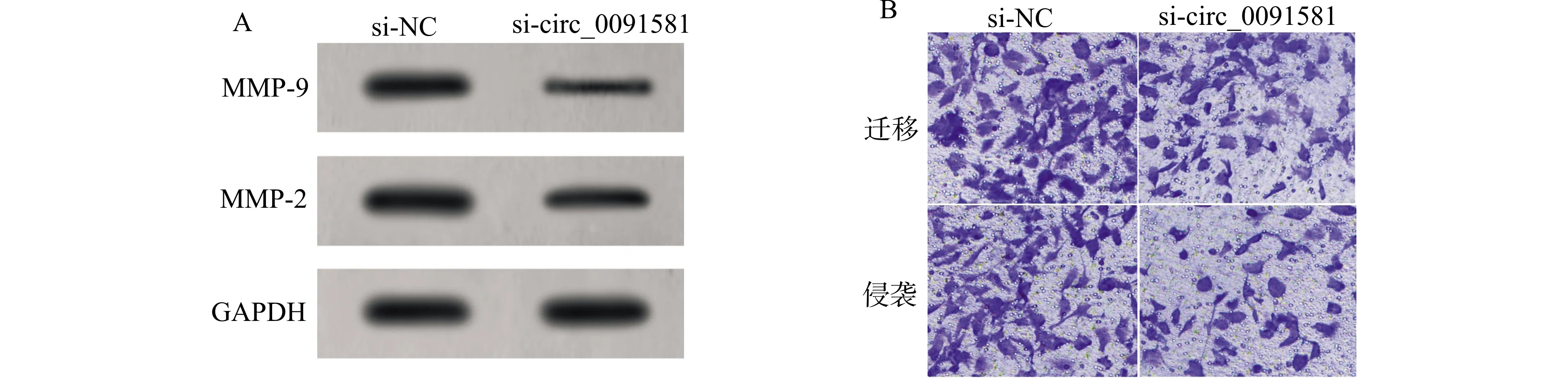
A:迁移侵袭相关蛋白表达;B:肝癌Huh7细胞的迁移侵袭
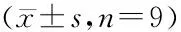
表2 抑制circ_0091581表达对肝癌Huh7细胞迁移侵袭的影响
2.4 抑制circ_0091581表达对肝癌Huh7细胞凋亡的影响
与si-NC组比较,si-circ_0091581组细胞凋亡率升高[(23.89±1.05)%vs.(7.24±0.30)%],Bcl-2表达水平降低,Bax表达水平升高(均P<0.05)(图3)。
A:凋亡相关蛋白表达;B:细胞凋亡流式图
2.5 circ_0091581靶向调控miR-1256的表达
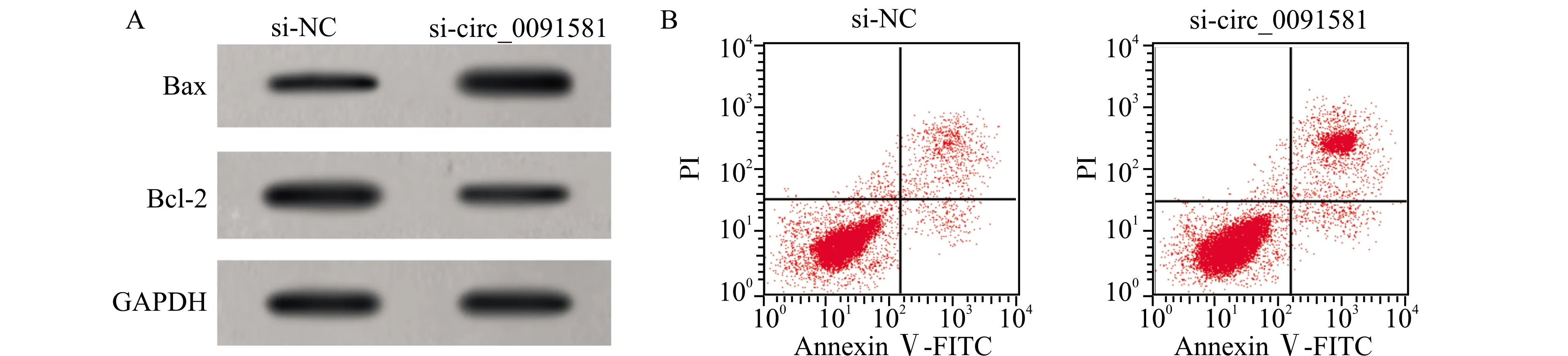
Circinteractome预测显示circ_0091581的序列中含有与miR-1256互补的核苷酸序列(图4);WT-circ_0091581与miR-1256共转染的细胞荧光素酶活性降低(0.37±0.02vs.0.98±0.03,P<0.05),MUT-circ_0091581与miR-1256共转染的细胞荧光素酶活性无显著差别(1.00±0.02vs.1.02±0.01,P>0.05)。与pcDNA组比较,pcDNA-circ_0091581组circ_0091581表达水平升高(3.30±0.19vs.0.99±0.02),miR-1256表达水平降低(0.46±0.01vs.1.02±0.01)(均P<0.05);与si-NC组比较,si-circ_0091581组circ_0091581表达水平降低(0.39±0.02vs.1.01±0.02),miR-1256表达水平升高(2.86±0.15vs.1.01±0.02)(均P<0.05)。
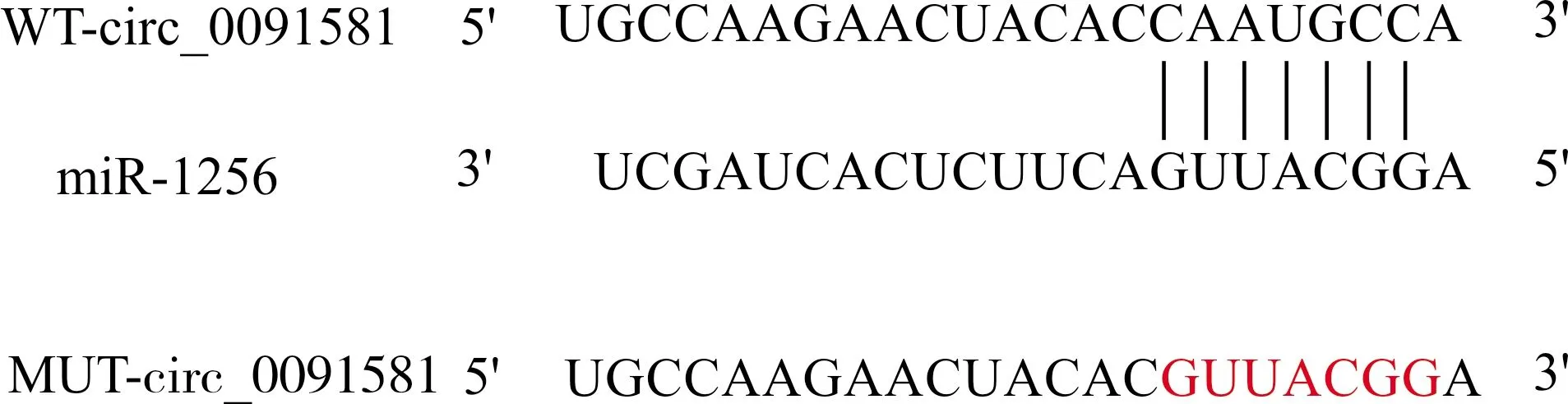
图4 circ_0091581的序列中含有与miR-1256互补的核苷酸序列
2.6 miR-1256过表达对肝癌Huh7细胞增殖、迁移侵袭和凋亡的影响
与miR-NC组比较,miR-1256组miR-1256表达水平升高,细胞活性降低,迁移侵袭细胞数减少,细胞凋亡率升高(均P<0.05);Ki-67、MMP-2、MMP-9、Bcl-2表达水平降低(均P<0.05);P21、Bax表达水平升高(均P<0.05)(图5,表3,表4)。
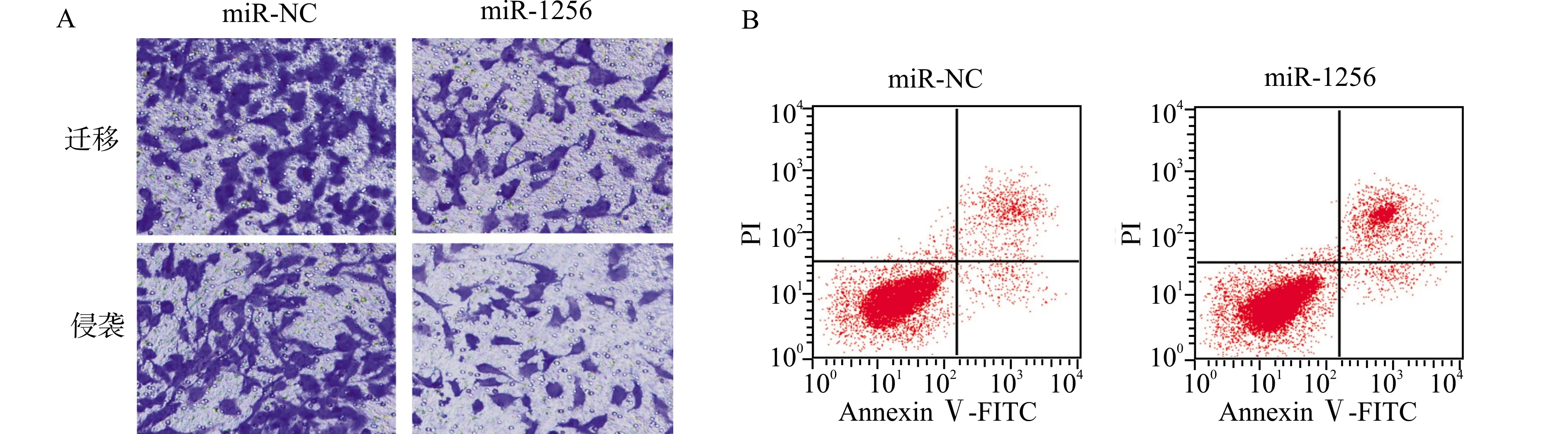
A:肝癌Huh7细胞的迁移侵袭;B:细胞凋亡流式图
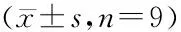
表3 miR-1256过表达对肝癌Huh7细胞增殖、迁移侵袭和凋亡的影响
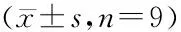
表4 miR-1256过表达对肝癌Huh7细胞增殖、迁移侵袭和凋亡相关蛋白表达的影响
2.7 下调miR-1256表达逆转了抑制circ_0091581表达对肝癌Huh7细胞增殖、迁移侵袭和凋亡的作用
与si-circ_0091581+anti-miR-NC组比较,si-circ_0091581+anti-miR-1256组miR-1256表达水平降低,细胞活性升高,迁移侵袭细胞数增加,细胞凋亡率降低;Ki-67、MMP-2、MMP-9、Bcl-2表达水平升高(均P<0.05);P21、Bax表达水平降低(均P<0.05)(图6,表5,表6)。
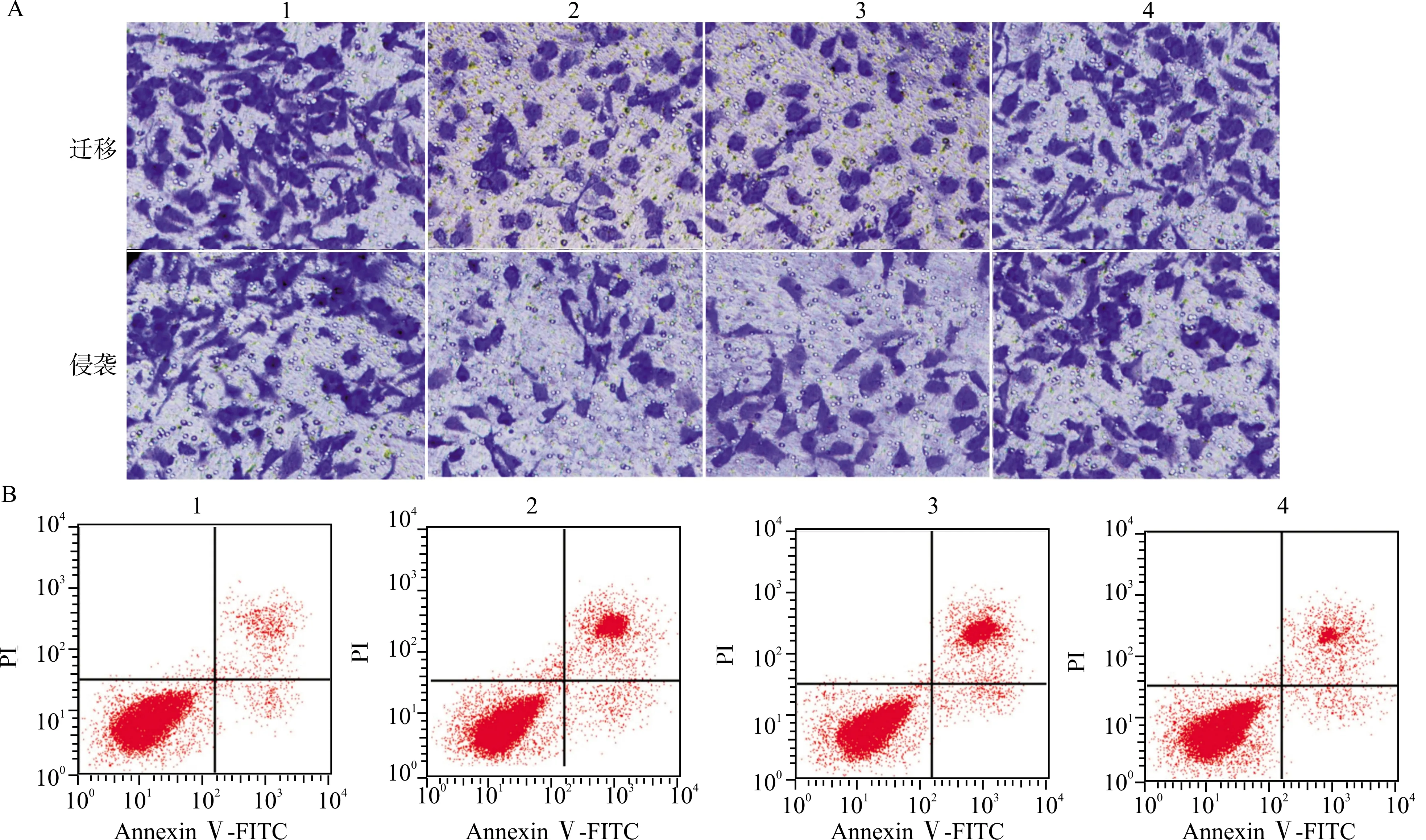
1:si-NC组;2:si-circ_0091581组;3:si-circ_0091581+anti-miR-NC组;4:si-circ_0091581+anti-miR-1256组;A:肝癌Huh7细胞的迁移侵袭;B:细胞凋亡流式图
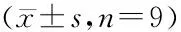
表5 下调miR-1256表达逆转了抑制circ_0091581表达对肝癌Huh7细胞增殖、迁移侵袭和凋亡的作用
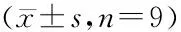
表6 下调miR-1256表达逆转了抑制circ_0091581表达对肝癌Huh7细胞增殖、迁移侵袭和凋亡相关蛋白表达的作用
3 讨论
肝癌是全球最常见的癌症之一,已有分子靶向药物用于肝癌治疗,但因一些靶向药物的局限性,需要开发更有效的新型分子靶向药物[9-10]。研究表明circRNA参与调控肝癌的进展,如circRNA cSMARCA5抑制肝细胞癌的生长和转移[11]。circ_0000105过表达促进肝癌细胞增殖并抑制细胞凋亡[12]。已有研究报道circ_0091581影响肝癌进展,circ_0091581在肝细胞癌组织样品和细胞株中高表达;circ_0091581高表达可促进肝癌细胞增殖,抑制其凋亡[4]。本实验首先检测了肝癌组织中circ_0091581的表达,结果显示,肝癌组织中circ_0091581表达水平高于癌旁组织,提示circ_0091581可能在肝癌中起促癌作用,与前人研究结果一致。本实验进一步抑制circ_0091581表达后,Huh7细胞活性降低,迁移侵袭细胞数减少,细胞凋亡率升高;表明抑制circ_0091581表达可抑制肝癌细胞增殖、迁移侵袭,并促进细胞凋亡,与前人研究结果一致。
为进一步研究circ_0091581影响肝癌进展的更多分子机制,本实验通过生物学软件预测circ_0091581下游可能靶向结合的miRNA,结果发现circ_0091581与miR-1256有结合位点。
研究报道结直肠癌组织中的miR-1256低表达,与TNM分期、淋巴结转移和患者生存期有关;是结直肠癌患者预后不良的独立预测参数[13]。miR-1256上调可抑制前列腺癌细胞的生长和侵袭[14]。以上研究表明miR-1256可影响多种肿瘤的进展,但其对肝癌的影响尚未明确。本实验首先检测了肝癌组织中miR-1256的表达水平,结果显示肝癌组织中miR-1256表达水平低于癌旁组织,提示miR-1256可能在肝癌中起抑癌作用。本实验进一步过表达miR-1256后,Huh7细胞活性降低,迁移侵袭细胞数减少,细胞凋亡率升高;表明过表达miR-1256可抑制肝癌细胞增殖、迁移侵袭,并促进细胞凋亡,揭示了miR-1256在肝癌中的作用,可作为肝癌治疗的分子靶标。
研究报道circ_0026134通过海绵化miR-1256和miR-1287调节非小细胞肺癌细胞的增殖和侵袭[15]。circHECTD1通过靶向miR-1256和激活β-catenin/c-Myc信号传导来促进谷氨酰胺分解以促进胃癌的增殖,迁移和侵袭[16]。以上研究表明circRNA可通过调控miR-1256影响肿瘤进展。本实验发现circ_0091581与miR-1256有结合位点,且进一步的双荧光素酶报告实验证实circ_0091581可靶向调控miR-1256;此外,下调miR-1256表达逆转了抑制circ_0091581表达对肝癌Huh7细胞增殖、迁移侵袭和凋亡的作用。
综上所述,抑制circ_0091581表达可能通过上调miR-1256抑制肝癌细胞增殖、侵袭迁移,促进凋亡。

