4种SARS-Cov-2核酸检测试剂盒测定结果分析
陈建波, 杨 勇, 李慧源, 任婵君, 杜 娟, 李根石, 陶 然, 陈敬贤, 张 玲, 李 淼
(1.武汉金域医学检验所,湖北 武汉 430100;2.甘肃金域医学检验暨病理诊断所,甘肃 兰州 730070;3.长沙金域医学检验所,湖南 长沙 410006;4.广州金域医学检验中心,广东 广州 510005;5.国家呼吸系统疾病临床医学研究中心病毒诊断研究中心,广东 广州 510005)
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARSCoV-2)核酸检测是诊断新型冠状病毒肺炎(corona virus disease 2019,COVID-19)的重要检测指标之一[1]。SARS-CoV-2核酸检测结果对疑似患者的筛查及鉴别诊断、确诊患者治疗后的出院评估等有重要作用。但是,有研究结果显示,SARS-CoV-2核酸检测的阳性率不到60%[2],这与SARS-CoV-2核酸检测试剂盒的性能差异有关,由此导致的检验结果差异无疑会直接影响临床诊疗,若发生漏检,更会造成较为严重的后果。疫情初期,我国国家药品监督管理局(the National Medical Products Administration,NMPA)紧急批准的试剂盒的性能评估还需要更多的临床应用数据支撑。由于疫情分布差异,部分地区临床实验室缺乏足够的阳性标本,在验证和评估试剂盒性能时相对困难。本研究所用标本来自湖北省内各级疾病预防控制中心、武汉雷神山医院以及武汉2家方舱医院等,部分批次标本阳性结果相对较高。因此,本研究对收集的咽拭子标本同时用4种SARS-CoV-2核酸检测试剂盒进行检测,以观察和比较4种试剂盒检测结果的一致性,为临床试剂盒选择提供参考。
1 材料和方法
1.1 研究对象
收集湖北省内各级疾病预防控制中心、武汉雷神山医院、武汉国博方舱医院、武汉客厅方舱医院等单位送检的咽拭子标本,将检测中发现的N基因阳性或疑似阳性和/或ORF1ab基因阳性或疑似阳性标本作为比对实验阳性标本。另随机选取核酸检测阴性的咽拭子标本作为比对实验阴性标本,尽可能使初步筛选出的阴性和阳性标本占同等比例。共收集了318例标本用于比对实验。
1.2 仪器和试剂
所有的标本均采用DP-1000自动化核酸提取仪及配套试剂(上海科华公司)进行核酸提取。SARS-CoV-2核酸均采用实时荧光逆转录聚合酶链反应(polymerase chain reaction,PCR)检测,4种试剂盒分别购自湖南圣湘生物科技有限公司(批号:2020012)、中山大学达安基因股份有限公司(批号:2020020)、江苏硕世生物科技股份有限公司(批号:20200205)、苏州天隆生物科技有限公司(批号:P732200119)。基因扩增采用Applied Biosystems 7500型定量PCR仪(美国赛默飞世尔科技公司)。将4种试剂盒随机编号为试剂盒A、试剂盒B、试剂盒C、试剂盒D。
1.3 方法
所有咽拭子标本先在干浴箱中进行65 ℃、30 min灭活,静置10 min至室温(避免气溶胶),然后按照核酸提取试剂说明书进行操作。标本经裂解液裂解后,加入磁珠与核酸结合,并利用磁性分离器将结合了核酸的磁珠与液体分离,通过洗涤、洗脱后得到纯化的核酸,分别根据各个试剂盒说明书要求设置相应的参数和反应程序进行扩增和检测。4种试剂盒说明书标注的最低检测限分别为200拷贝/mL(湖南圣湘生物科技有限公司)、500拷贝/mL(中山大学达安基因股份有限公司)、500拷贝/mL(苏州天隆生物科技有限公司)、1 000拷贝/mL(江苏硕世生物科技股份有限公司)。按照各试剂盒的说明书要求进行结果判定。苏州天隆生物科技有限公司试剂盒说明中对单阳结果(仅N基因或ORF1ab基因阳性)判读为可疑,需要用其他方法,如测序法进行鉴定。本研究对所有方法检测的N或ORF1ab其中1个基因阳性(单阳)或N和ORF1ab2个基因均阳性(双阳)结果均判读为阳性。
1.4 质量控制
每批检测均设立1个弱阳性质控和3个阴性质控(0.9%氯化钠溶液),其中3份阴性质控随机置于临床标本中。聚合酶链反应(polymerase chain reaction,PCR)反应体系中设置有内标,用以判断本次实验是否有效。
1.5 统计学方法
采用SPSS 25.0软件对所有数据进行统计分析。采用Kappa一致性分析评价不同试剂盒检测结果。采用χ2检验评估试剂盒检测阳性率及诊断效能。以P<0.05为差异有统计学意义。
2 结果
2.1 4种SARS-CoV-2核酸检测试剂盒检测结果比较
将4种试剂盒检测结果进行两两比较,并进行Kappa一致性分析,相应的Kappa值分别为:0.741(试剂盒A与B比较)、0.653(试剂盒A与C比较)、0.510(试剂盒A与D比较)、0.669(试剂盒B与C比较)、0.633(试剂盒B与D比较)、0.565(试剂盒C与D比较)(P<0.01)。试剂盒A和试剂盒B的结果一致性最高。见表1。
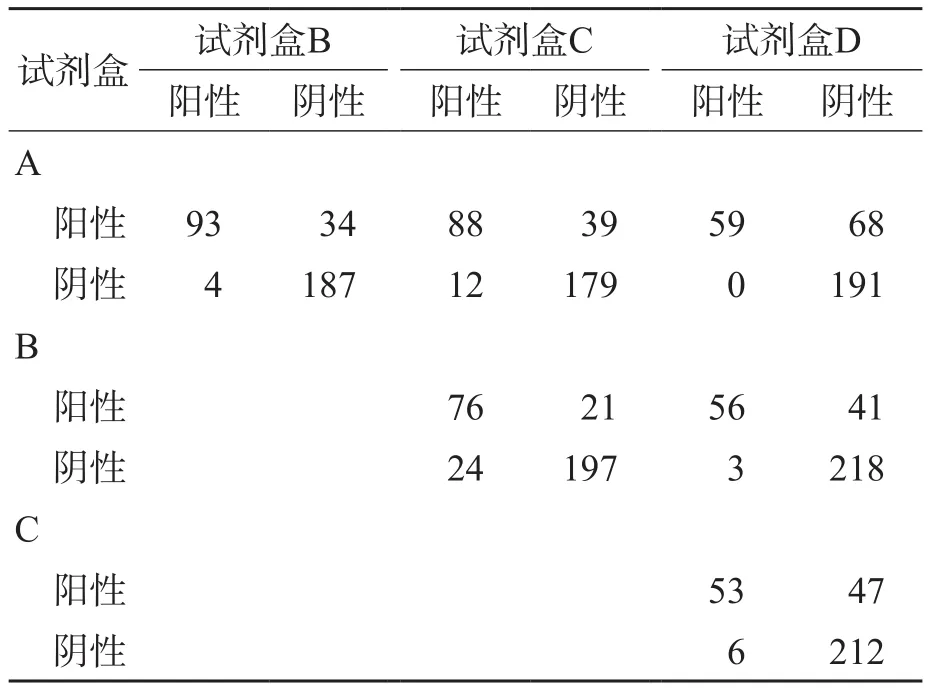
表1 4种SARS-CoV-2核酸检测试剂盒检测结果比较 例
2.2 N基因和ORF1ab基因阳性率结果比较
试剂盒A、B、C和D SARS-CoV-2核酸检测试剂盒的N基因和ORF1ab基因检测的阳性率分别为39.94%、30.5%、31.45%和18.55%。通过χ2检验发现,除了试剂盒B和试剂盒C的阳性率之间的差异无统计学意义(P=0.797)外,其他试剂盒间阳性率的差异均有统计学意义(P<0.05)。见表2。
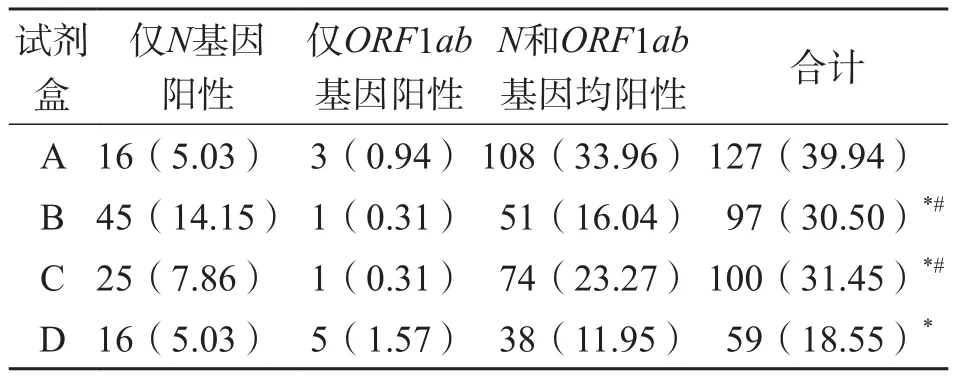
表2 N基因和ORF1ab基因阳性率比较 例(%)
2.3 诊断效能评价
由于没能通过其他方法(测序、临床综合诊断等)对检测结果进行最终确认,本研究通过结果趋同的方法相对确定最终的参考标准结果。若3个及以上品牌试剂盒阴性或阳性检测结果一致,则判定为参考标准结果。按此规则,有292例标本可直接产生参考标准结果。余下的26例标本检测结果中,由于试剂盒D结果均为阴性(阳性率显著低于其他3种试剂盒),则以试剂盒A、B和C中的2种的一致性结果作为参考标准结果(2种试剂盒结果阳性则判断为阳性、2种试剂盒结果阴性则判断为阴性)。χ2统计分析结果表明,试剂盒D与其他3种试剂盒的总符合率的差异均有统计意义(P<0.05),试剂盒B与试剂盒C的总符合率差异也有统计意义(P<0.05)。见表3。

表3 4种试剂盒诊断效能评价 %
3 讨论
试剂盒检测性能的差异是造成SARS-CoV-2核酸检测结果差异的重要因素[3-5]。4种SARSCoV-2核酸检测试剂盒阳性和阴性结果相互比较后可知,试剂盒A和试剂盒B的结果一致性最高,试剂盒D与其他3种试剂盒的结果一致性相对较差。不同品牌试剂盒检测结果不一致的原因主要为引物设计、试剂盒检测的灵敏度、抗干扰能力的差异等[6]。本研究采用的不是SARSCoV-2核酸检测试剂盒生产者指定或配套的核酸提取方法与试剂,有可能对试剂盒的PCR反应体系产生干扰。但另一方面也确实表明,部分品牌试剂盒质量存在明显差异,需要相应试剂盒品牌不断探讨和分析原因,改进试剂盒检测性能,确保满足COVID-19疫情防控的需求。
从检测的靶标N基因和ORF1ab基因情况来看,无论是单阳还是双阳,不同品牌试剂盒的检测结果有一定差异,试剂盒A的总阳性率明显高于其他3种试剂盒,试剂盒D的总阳性率明显低于其他3种试剂盒。这些差异主要与各品牌试剂盒设计的引物不同、PCR反应体系竞争、荧光信号干扰、加入反应体系里的核酸量、对实验影响因素的把控等有关。另外,大部分检测结果为N基因和ORF1ab基因同时阳性,单独ORF1ab基因阳性的情况比较少见(阳性率0.31%~1.57%),但单独N基因阳性比例相对较高(阳性率5.03%~14.15%)。这可能是因为病毒是在细胞内复制的,N基因的转录量高于ORF1ab基因,使得针对N基因区域的阳性检出率高于ORF1ab基因区域,尤其是在SARS-CoV-2载量较低的情况下,单独N基因阳性的情况更为突出[7]。SARS-CoV-2为单链RNA病毒,容易发生突变,因此,包含N基因的多靶标试剂检测方案,有助于降低因基因突变及低病毒载量而导致的漏检风险。
在实际工作中,对于单独N或ORF1ab基因阳性结果,原标本复查后也有部分结果变为双阳,甚至变为阴性结果,这与检测人员实验操作差异、试剂的性能有关。因此,对于出现的单阳结果,除了按试剂盒说明书及相应技术指南的要求进行复检或重新采样检测外[1,8],还需要检测人员有娴熟的实验操作技能。建议实验室采用不同品牌SARS-CoV-2检测试剂盒,对可疑检测结果进行复测,以确认结果的可靠性。
SARS-CoV-2核酸检测用于COVID-19的筛查,对检测试剂盒的敏感性及准确度要求较高。试剂盒A敏感性达到98.2%,总符合率也达到93.1%,是比较理想的COVID-19筛查与诊治检测试剂盒。试剂盒B敏感性次之,总符合率最高,也可作为COVID-19的检测试剂。试剂盒D的敏感性较低,如果被应用到COVID-19的筛查与诊治中,会带来较大的漏诊风险。由于本研究采用的是结果趋同的方法来相对确定最终的参考标准结果,故以上结论存在一定的局限性。
SARS-CoV-2核酸检测虽是诊断COVID-19的重要标准之一,但临床诊疗上也出现了一些棘手的COVID-19患者咽拭子核酸持续阴性的情况。随着COVID-19疫情防控工作的推进,新的检测与诊断指标也开始出现。血清学检测指标SARS-CoV-2免疫球蛋白(immunoglobulin,Ig)M和IgG抗体也被纳入到COVID-19诊疗方案里[9]。而且已有的研究结果也表明,这些特异性抗体检测有较好的敏感性和特异性,有助于弥补SARS-CoV-2核酸检测的不足[10-11]。
总而言之,本研究中4种SARS-CoV-2核酸检测试剂盒性能参差不齐,试剂盒A与试剂盒B结果一致性最高,试剂盒A敏感性最高,准确度较好,是比较理想的可用于COVID-19筛查和诊治的试剂盒。试剂盒D敏感性较低,若用于SARS-CoV-2核酸检测则存在漏诊风险。实验室在使用SARS-CoV-2核酸检测试剂盒前应进行充分的性能验证。

