自噬促进结直肠癌细胞对5-氟尿嘧啶及顺铂的化疗耐药*
周川人, 姚 菲, 黄晓颖, 周艳玲, 王 强, 龙 辉, 吴清明,△
1武汉科技大学医学院,感染免疫与肿瘤微环境研究所,职业危害识别与控制湖北省重点实验室,武汉 430081 2武汉科技大学附属天佑医院消化内科,武汉 430064
结直肠癌(colorectal cancer,CRC)是一种常见的消化道恶性肿瘤,现已成为世界范围内癌症相关性死亡的第2大病因。世界卫生组织发布的最新全球癌症数据显示,2020年结直肠癌发病率和死亡率约为24.8/10万和12.0/10万。随着人们生活水平的快速提高和饮食结构的改变,我国结直肠癌的发病率和死亡率也呈现逐年上升的趋势[1]。化疗是中晚期结直肠癌术后最常用的辅助治疗方法之一[2],5-氟尿嘧啶(5-FU)和铂类目前被广泛用作结直肠癌一线化疗方案的经典和基础药物。但随着治疗的推进,对5-FU和铂类等化疗药物产生多药耐药亦是结直肠癌治疗失败的重要原因[3-4]。
近年来大量研究表明自噬(autophagy)在肿瘤的发生发展过程中扮演着重要角色[5-6]。细胞自噬是一种由溶酶体介导的细胞内衰老、错误蛋白或损伤细胞器被降解的过程。前期有研究证实,自噬可通过抑制肿瘤细胞凋亡诱发放化疗抵抗[7]。然而,自噬是否与结直肠癌对5-FU及铂类的化疗耐药有关,以及抑制自噬是否可能逆转化疗耐药,目前尚不肯定。本研究以人结肠癌细胞系及其耐药株为研究对象,检测结直肠癌细胞在获得耐药性后自噬活性的变化,并引入经典的自噬抑制剂氯喹(Chloroquine,CQ),探讨自噬水平的改变对结肠癌细胞化疗敏感性的影响,从而明确自噬与结直肠癌细胞对5-FU及顺铂(DDP)化疗耐药的关系,为临床提高化疗疗效提供更多的方案及依据。
1 材料与方法
1.1 细胞及主要试剂
人结直肠癌亲本株HCT8购于中国典型培养物保藏中心(中国武汉);结直肠癌化疗耐药株(HCT8/5-FU与HCT8/DDP)购于湖南丰晖生物科技有限公司(中国长沙);5-FU、DDP及氯喹二磷酸盐购于美国Sigma-Aldrich公司;RPMI-1640培养液、0.25%胰蛋白酶、青霉素-链霉素双抗均购自美国Gibco公司;胎牛血清(优级)购于杭州四季青生物工程材料有限公司;细胞培养级DMSO购于北京索莱宝生物公司;RIPA裂解液及Western blot用制胶试剂购于兰杰柯科技有限公司;LC3Ⅱ(货号3868)、P62(货号ab56416)、β-actin抗体分别购于CST、Abcam及Abclone官网;兔抗小鼠辣根过氧化物酶标记二抗、山羊抗兔辣根过氧化物酶标记二抗均购于Abcam公司(美国)。
1.2 实验方法
1.2.1 细胞培养 HCT8细胞用含10%胎牛血清的RPMI-1640培养液培养,2种耐药株(HCT8/5-FU和HCT8/DDP)在含有10%胎牛血清以及5 μg/mL 5-FU或1 μg/mL DDP的RPMI-1640培养液中培养以维持耐药性,细胞置于37℃、5% CO2恒温培养箱中培养。待细胞达到80%的生长面积时,用0.25%胰酶消化后传代或冻存,2 d更换1次培养液。另设氯喹预处理组,取处于对数生长期的耐药株细胞,加入30 μmol/L的氯喹预处理24 h(前期的预实验显示该作用条件下耐药株细胞的自噬水平可明显被抑制,且不会引起细胞增殖率明显的改变),余培养同耐药株。
1.2.2 MTT比色法检测细胞活力 收集处于对数生长期的各组细胞,接种于96孔板,密度约1×104/孔,依照MTT试剂操作方法,用酶标仪检测490 nm波长处吸光度值(A值),实验重复3次。计算细胞存活率及半数抑制浓度(IC50),并绘制曲线。
1.2.3 细胞透射电镜检测 ①取材及前固定:待检细胞用2.5%戊二醛4℃固定1~2 h,用细胞刮刮取收集,3000 r/min离心10 min后4℃固定4 h以上(固定液保留)。②锇酸固定:0.1 mol/L磷酸缓冲液(pH7.4)漂洗3次,每次15 min,再用4℃预冷的1%锇酸20℃固定2~3 h,然后用0.1 mol/L磷酸缓冲液(pH7.4)漂洗3次,每次15 min。③脱水:样品经梯度乙醇(30%、50%、70%、80%、85%、90%、95%、100%)脱水2次,每次15~20 min。④渗透:渗透剂依次为丙酮∶环氧树脂(2∶1)、丙酮∶环氧树脂(1∶1)、环氧树脂,样品放入37℃烘箱,每次渗透8~12 h。⑤包埋:将渗透过的样品放入胶囊或包埋板中,加入包埋剂环氧树脂,在60℃温箱聚合48 h。⑥超薄切片:用德国Leica EM UC7超薄切片机切片,切片厚度一般为80~100 nm。⑦双染色:2%醋酸铀饱和水溶液和枸橼酸铅室温染色15 min后干燥过夜,最后用美国Fei Tecnai G2 F20 TWIN(200 kV)透射电子显微镜观察拍片。
1.2.4 Western blot检测自噬标志性蛋白的表达采用现配的含1% PMSF的RIPA裂解液裂解收集到的各组细胞,冰浴条件下用超声细胞破碎仪持续超声裂解蛋白约5 min,冰上静置30 min,离心后取上清液。BCA法进行蛋白定量,取变性好的蛋白质30 μg/孔进行电泳,将电泳分离后的蛋白质电转移至PVDF膜上,用脱脂奶粉封闭1~3 h,加入LC3Ⅱ、P62及β-actin单克隆抗体(体积稀释比例分别为1∶1000、1∶2000、1∶10000),4℃孵育过夜,TBST漂洗3次,每次10 min,然后室温下孵育二抗2 h(兔抗及鼠抗以1∶5000稀释),TBST漂洗3次,每次10 min。ECL化学发光法显影,用Image J读取条带灰度值,以目的蛋白与β-actin的比值反映目的蛋白的表达情况,实验重复3次。
1.3 统计学方法
采用SPSS 23.0软件和Origin 6.1统计软件进行统计分析。实验数据用均数±标准差表示,两组间均数的比较采用独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 结直肠癌耐药株HCT8/5-FU及HCT8/DDP的耐药性验证
参考前期预实验结果,确定抗癌药物的作用浓度及作用时间。MTT结果显示,将结直肠癌细胞暴露于递增剂量的5-FU(0、5、10、20、40、80 μg/mL)或DDP(0、3.75、7.5、11.25、22.5μg/mL)中72 h时,HCT8、HCT8/5-FU及HCT8/DDP的细胞活力呈剂量依赖性下降(图1A、1B)。且与亲本株HCT8细胞相比,HCT8/5-FU和HCT8/DDP的IC50更高,分别为(32.42±8.86)μg/mLvs.(6.34±0.49)μg/mL和(13.08±0.69)μg/mLvs.(6.56±0.34)μg/mL,差异均有统计学意义(均P<0.01,图1C、1D),表明HCT8/5-FU和HCT8/DDP细胞分别对5-FU或顺铂有更强的耐受力,从而验证了本研究所用的结直肠癌耐药细胞株的耐药性。

A、C:MTT法测定HCT8和HCT8/5-FU的细胞存活率和5-FU的IC50值;B、D:MTT法测定HCT8和HCT8/DDP的细胞存活率和DDP的IC50值;与亲本株细胞HCT8比较,**P<0.01
2.2 透射电镜下观察结直肠癌耐药株HCT8/5-FU和HCT8/DDP的自噬水平
透射电镜下观察可见,与结直肠癌亲本株细胞相比,耐药株细胞的自噬更活跃,见图2。HCT8/5-FU和HCT8/DDP细胞中可观察到更多的自噬泡,而在HCT8细胞中几乎观察不到。高倍镜下可见耐药株细胞内新月状或杯状的双层或多层膜空泡样结构。

A、D:HCT8细胞;B、E:HCT8/5-FU细胞;C、F:HCT8/DDP细胞;箭头所指为典型的自噬体结构
2.3 结直肠癌细胞及其耐药株自噬标志性蛋白的表达水平
Western blot检测结直肠癌亲本株HCT8及耐药株HCT8/5-FU、HCT8/DDP中自噬标志性蛋白LC3Ⅱ、P62的表达水平,结果见图3。与HCT8细胞相比,HCT8/5-FU及HCT8/DDP细胞中LC3Ⅱ表达水平显著上调(均P<0.05),而P62的表达水平显著下降(P<0.05,P<0.01),证实耐药株HCT8/5-FU及HCT8/DDP的自噬水平上调。

A、B:HCT8和HCT8/5-FU的自噬标志性蛋白的表达;C、D:HCT8和HCT8/DDP的自噬标志性蛋白的表达;*P<0.05 **P<0.01
2.4 抑制自噬可增强HCT8/5-FU和HCT8/DDP细胞对5-FU或DDP的敏感性
Western blot的结果显示,经自噬抑制剂氯喹(30 μmol/L)预处理24 h后,HCT8/5-FU及HCT8/DDP细胞的自噬标志性蛋白LC3Ⅱ表达下调,但P62的降解减少(图4),证实氯喹成功抑制了耐药株HCT8/5-FU及HCT8/DDP的自噬活性。
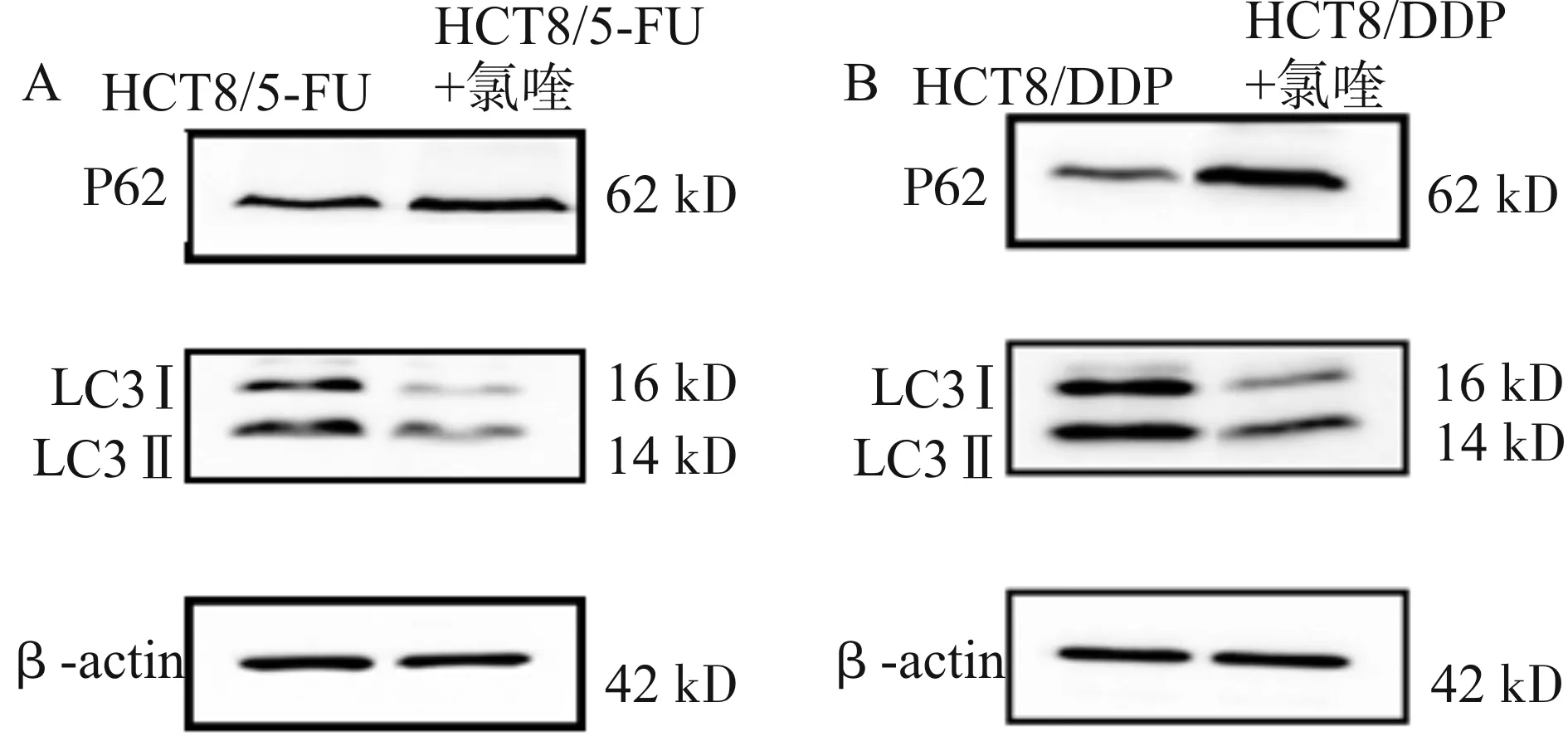
A:氯喹处理前后HCT8/5-FU自噬标志性蛋白的表达;B:氯喹处理前后HCT8/DDP自噬标志性蛋白的表达
MTT比色法分析结果显示(图5),HCT8/5-FU及HCT8/DDP仅加入氯喹时细胞存活率分别为(85.39±7.51)%和(93.07±2.12)%,表明氯喹本身对结直肠癌耐药株细胞仅有较弱的抑制作用。5-FU和DDP的作用浓度分别为25 μg/mL和5 μg/mL时,对耐药株细胞可产生明显的杀伤作用。当联合运用氯喹与抗癌药5-FU(25 μg/mL)或DDP(5 μg/mL)时,其细胞存活率分别为(16.02±2.35)%和(43.17±1.64)%,较单独用抗癌药5-FU[(57.77±2.65)%]或DDP[(67.92±0.84)%]时显著降低(均P<0.01)。

A:氯喹处理后HCT8/5-FU对5-FU的敏感性增加;B:氯喹处理后HCT8/DDP对顺铂敏感性增加;+:使用了该种药物;-:未使用该种药物;**P<0.01
3 讨论
化疗可以有效减少肿瘤的复发、延长患者生存期,在肿瘤的综合治疗中占据着举足轻重的地位。然而,肿瘤细胞在化疗过程中逐渐产生耐药性常常导致治疗失败,不仅影响患者的生存质量,还造成了一定程度的医疗资源浪费[8]。据报道,肿瘤的化疗耐药可能涉及到多种复杂因素,包括MicroRNA对靶基因的异常调控[9]、肿瘤干细胞、外泌体[10]、肿瘤细胞膜转运蛋白过表达[11]、DNA甲基化[12]及上皮-间质转化[13]等等。自噬是真核细胞内重要的物质分解代谢过程,尤其是当细胞处于应激状态时,例如饥饿、缺氧、蛋白质错误折叠、病原体感染等,自噬可以维持细胞内环境稳定并确保细胞在压力条件下的能量供应与代谢平衡。近年来,有研究发现自噬在肿瘤化疗耐药的形成过程中也发挥着重要作用[7]。因此,深入分析自噬与肿瘤化疗耐药的关系,对提高结直肠癌患者生存率和改善预后意义重大。
在肿瘤的发生发展中,自噬会根据环境的变化,在不同阶段发挥截然不同的生物学效应。在肿瘤早期,自噬可以抑制癌细胞的生长;而在饥饿、低氧等应激条件下,自噬能够提高肿瘤细胞的适应能力,促进其存活与增殖。目前,关于自噬在肿瘤化疗耐药中的作用仍然存在着众多争议。有文献报道,三氧化二砷可以诱导肿瘤细胞的自噬,与依维莫司联用后能加强依维莫司对卵巢癌细胞的毒性,抑制肿瘤生长[14]。苏游等[15]发现,在卵巢癌中,过表达自噬促进基因Beclin-1可逆转SKOV3/TXA细胞对紫杉醇的耐药性,并同时抑制卵巢癌细胞的增殖。冯云等[7]的研究显示,成纤维细胞生长因子受体抑制剂AZD4547可显著增强索拉非尼耐药肝癌细胞的自噬及免疫应答水平,促进耐药肝癌细胞发生自噬依赖性死亡,从而增加化疗敏感性。然而,也有研究证实自噬是多种肿瘤产生化疗耐药的关键原因,例如在非小细胞肺癌化疗的过程中,顺铂可诱导细胞的保护性自噬而导致肺癌细胞产生化疗耐药,增强肿瘤细胞的自噬水平可以加重这种耐药性[16]。电压门控氯通道3(voltage-gated chloride channel 3,CLC-3)基因广泛分布于心、脑、肝、肠等组织,下调CLC-3可以抑制细胞的自噬活性,从而增强肿瘤细胞对奥沙利铂化疗的敏感性[17]。陈有科等[18]通过上调miR-200c的表达增强了肝癌耐药细胞HepG2/ADM对化疗药物的敏感性,同时发现HepG2/ADM的自噬水平降低。
为了探究结直肠癌细胞的化疗耐药性是否与自噬有关,我们在体外培养稳定的对5-FU和DDP耐药的结直肠癌细胞株并验证了其耐药性。随后的研究发现,透射电镜下耐药株细胞中可以观察到数量更多的自噬泡,而亲本株细胞中几乎看不到,这在一定程度上说明了耐药株细胞的自噬更为活跃。另外,与亲本株相比,耐药株细胞的自噬标志性蛋白LC3Ⅱ的表达相对上调,相反P62的表达水平降低,结合形态学观察结果,我们的研究提示结直肠癌细胞对5-FU及顺铂产生耐药性的同时伴随着自噬水平的上调。
有越来越多的研究证实,通过抑制肿瘤细胞自噬,可提升患者对抗肿瘤药物治疗的敏感性。Piya等[19]发现自噬抑制剂3-MA可在一定程度上逆转白血病细胞对化疗药物的抵抗。Fukuda等[20]的研究表明,抗疟疾药物氯喹可通过阻断自噬抑制子宫内膜癌细胞的增殖并增加其对顺铂化疗的敏感性。氯喹是经典的抗疟疾药物,能够靶向细胞溶酶体,抑制晚期自噬。本研究结果显示,经过氯喹预处理的耐药株细胞对5-FU或顺铂的作用更敏感,其细胞存活率分别为(16.02±2.35)%和(43.17±1.64)%,相比单独用抗癌药时明显降低,而氯喹本身对结直肠癌耐药株细胞仅有较弱的抑制作用,这说明通过抑制自噬,可以增加结直肠癌细胞对5-FU或顺铂的敏感性。
综上所述,我们的研究表明,自噬参与并促进了结直肠癌细胞对5-FU及顺铂的化疗耐药性,而抑制结直肠癌耐药株的自噬水平则部分逆转了这种耐药性,充分说明自噬与结直肠癌的化疗耐药密切相关,为今后临床改善化疗方案提供了一定的思路和基础研究依据。然而自噬所涉及的分子通路非常复杂,且常与其他生理活动共同发挥作用,其中的具体机制还有待我们进一步研究。

