PAFAH1B3介导上皮间质转化促进大细胞肺癌的转移*
汤素萍, 倪松石
南通大学附属医院呼吸与危重症医学科,南通 226001
2018年全球癌症发病率和死亡率的统计显示,肺癌是最常见的肿瘤,占所有癌症病例的11.6%,也是癌症死亡的主要原因,占所有癌症死亡病例的18.4%[1]。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌病例的85%,是肺癌最常见的病理类型。近年来NSCLC的筛查、诊断和治疗方面取得了很大的进展,但NSCLC患者的5年总生存率仍然很低(Ⅳ期患者5年生存率小于10%)[2]。大细胞肺癌(large cell lung cancer,LCLC)是NSCLC中一种较少见的亚型,具有侵袭性,占所有肺癌的9%[3]。肿瘤的快速生长和早期转移是导致LCLC患者预后不良的主要原因[4]。因此,深入地探索LCLC转移的分子机制,寻找新的治疗靶标对LCLC患者至关重要。
血小板活化因子乙酰水解酶(platelet activating factor acetylhydrolases,PAF-AHs)是一组结构可变的同工酶,分为血浆PAF-AH、细胞内PAF-AH(Ⅰ)和细胞内PAF-AH(Ⅱ)三种类型,血小板活化因子乙酰水解酶1b催化亚基3(platelet activating factor acetylhydrolase 1b catalytic subunit 3,PAFAH1B3)是一个编码PAF-AH(Ⅰ)的α1催化亚基的蛋白编码基因[5]。PAFAH1B3参与了神经发育和精子发生的过程,近年来越来越多的证据表明PAFAH1B3也是致癌调控的关键驱动因素[6],但PAFAH1B3在LCLC中的功能和作用机制尚未可知。
本研究旨在检测PAFAH1B3在LCLC细胞中的表达,揭示PAFAH1B3对LCLC细胞增殖、侵袭和细胞周期方面的影响,并探讨PAFAH1B3对LCLC细胞侵袭的可能调控机制。
1 材料和方法
1.1 细胞培养
肺腺癌细胞系A549、H1299和H1650,LCLC细胞系H460以及人支气管上皮细胞16HBE均来自中国科学院细胞库。肺癌细胞系和16HBE分别置于含有10%胎牛血清(Biological Industries,Israel)、100 U/mL青霉素和0.1 mg/mL链霉素(碧云天,中国)的RPMI-1640(Biological Industries,Israel)和DMEM(Biological Industries,Israel)培养液中培养,所有细胞均于含有5% CO2的37℃加湿培养箱中培养。
1.2 蛋白免疫印迹(Western blot)检测
简单来说,从细胞中提取总蛋白,用BCA试剂盒(碧云天,中国)检测总蛋白浓度,将20 μg等量的总蛋白经SDS-PAGE分离,然后转移至0.4 μm的PVDF膜(Millipore,USA)上。膜经过5%脱脂奶粉封闭2 h后,与一抗4 ℃孵育过夜。次日TBST洗膜3次,每次10 min,二抗室温孵育2 h后再次洗膜,最后ECL发光试剂盒(Biosharp,中国)检测目的蛋白条带,GAPDH为内参蛋白。主要抗体为:PAFAH1B3兔单克隆抗体(1∶1000,ab166906,Abcam),E-cadherin兔单克隆抗体(1∶10000,ab40772,Abcam),N-cadherin兔单克隆抗体(1∶5000,ab76011,Abcam),GAPDH小鼠单克隆抗体(1∶100000,60004-1-Ig,Proteintech),抗兔二抗(HRP)(Abways Technology,中国),抗鼠二抗(HRP)(Abways Technology,中国)。
1.3 慢病毒转染及稳转株的建立
以每孔8×104个细胞的密度将H460接种于6孔板中,培养16~24 h。当细胞融合度达到20%~30%时,根据MOI=10加入PAFAH1B3 shRNA病毒(吉凯基因,中国),并加入Hitrans G P感染增强液,72 h后,继续给予含有嘌呤霉素的RPMI-1640培养液培养细胞,筛选得到稳定沉默PAFAH1B3的H460细胞株,沉默效率经Western blot验证。慢病毒介导的PAFAH1B3 shRNA序列为:shRNA1,5′-GATGGCACCATCAGCCATCAT-3′;shRNA2,5′-CGACAGGTGAACGAGCTGGTA-3′;shRNA3,5′-GCAGGTGACTGGTGGC-ATCAA-3′;shControl,5′-TTCTCCGAACGTGTCACGT-3′。
1.4 CCK8实验
将细胞接种于24孔板中(2000个/孔),分别于24、48、72和96 h加入CCK8(碧云天,中国),培养箱中继续培养2 h,以酶标仪在450 nm处测定吸光度。
1.5 克隆形成实验
向6孔板每个孔中接种1000个细胞,每3天更换一次培养液,培养9 d后,吸去培养液,PBS洗2次,然后用4%多聚甲醛固定20 min,0.5%结晶紫染色5 min,最后用PBS洗3次,并用显微镜拍照,Image J进行计数。
1.6 Transwell侵袭实验
使用Matrigel基质胶(BD Sciences,USA)涂覆于8 μm孔径的Transwell小室(Corning,USA)上室,将H460细胞(5×104个)用200 μL无血清培养液接种于上室,下室加入800 μL含有20%胎牛血清的完全培养液。培养48 h后,用棉签轻轻拭去上室的细胞,经4%多聚甲醛固定细胞、结晶紫染色后,用显微镜在5个随机视野下拍照(×200),Image J计数细胞。
1.7 流式细胞术
收集6孔板中处于对数生长期的细胞,用预冷的PBS洗涤,然后用预冷的75%乙醇固定2 h。1000× g离心3~5 min,沉淀细胞,小心吸出乙醇,再用PBS洗涤细胞。用含RNase A的碘化丙啶(PI)染色液(美国Everbright®公司)对细胞进行染色,室温避光孵育30 min后,在615 nm发射波长下用流式细胞仪(BD Biosciences,美国)检测,用ModFit LT分析。
1.8 统计学方法
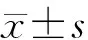
2 结果
2.1 PAFAH1B3在LCLC细胞中的表达
我们通过Western blot检测了PAFAH1B3在肺腺癌细胞系A549、H1299和H1650,LCLC细胞系H460以及人支气管上皮细胞16HBE中的蛋白表达水平。结果显示,与16HBE细胞相比,PAFAH1B3在A549、H1299、H1650和H460细胞中的表达均显著上调(图1,均P<0.01)。

1:A549;2:H1299;3:H1650;4:H460;5:16HBE;与16HBE比较,**P<0.01
2.2 慢病毒转染H460细胞及稳转株的建立
为了进一步研究PAFAH1B3对LCLC生物学特性的影响,我们用慢病毒介导的shPAFAH1B3(shRNA1、shRNA2、shRNA3)和阴性对照shRNA转染H460细胞,沉默H460细胞中PAFAH1B3,并予嘌呤霉素筛选得到稳定沉默PAFAH1B3的H460细胞株。沉默效率通过Western blot验证,结果显示,与阴性对照组细胞相比,三种shPAFAH1B3转染后,H460细胞中PAFAH1B3蛋白表达水平均显著下降(图2,均P<0.01)。我们选取shRNA2转染后的细胞进行下一步的实验,将其记为shPAFAH1B3,阴性对照组记为shControl,空白对照组记为Parental。

1:shRNA1;2:shRNA2;3:shRNA3;4:shControl;5:Parental;与shControl组比较,**P<0.01
2.3 沉默PAFAH1B3抑制H460细胞的增殖和克隆形成能力
在建立了稳定沉默PAFAH1B3的H460细胞株后,我们进行了CCK-8实验,结果显示,与shControl组细胞相比,shPAFAH1B3组细胞生长速度明显变慢(图3,均P<0.05),表明沉默PAFAH1B3可显著抑制H460细胞的增殖能力。

与shControl组比较,*P<0.05
克隆形成实验结果显示,shPAFAH1B3组细胞较shControl组细胞形成的克隆显著变小且变少(图4,P<0.01),表明沉默PAFAH1B3可以显著抑制H460细胞克隆形成的能力。

1:Parental;2:shControl;3:shPAFAH1B3;与shControl组比较,**P<0.01
2.4 沉默PAFAH1B3抑制H460细胞的侵袭能力
为了研究PAFAH1B3缺失后H460细胞侵袭能力的改变,我们进行了Transwell侵袭实验。结果显示,与shControl组细胞相比,shPAFAH1B3组细胞穿过Transwell小室小孔的数目明显减少(图5,P<0.05),表明沉默PAFAH1B3显著抑制了H460细胞的侵袭能力。

1:Parental;2:shControl;3:shPAFAH1B3;与shControl组比较,*P<0.05
2.5 沉默PAFAH1B3促使H460细胞由S期向G0/G1期转化
我们使用流式细胞术检测PAFAH1B3沉默后LCLC细胞的细胞周期变化,结果显示,沉默PAFAH1B3后,H460细胞中分布于G0/G1期细胞所占百分比显著增多,而分布于S期细胞所占百分比显著减少(图6,均P<0.05),表明沉默PAFAH1B3可以促使H460细胞的细胞周期由S期向G0/G1期转化,进而抑制了细胞的增殖。

与shControl组比较,*P<0.05
2.6 沉默PAFAH1B3抑制EMT过程
上皮间质转化(epithelial-to-mesenchymal transition,EMT)在恶性肿瘤的进展中起着关键性的作用,我们进一步研究了PAFAH1B3对EMT过程的调控作用,通过Western blot分析了EMT上皮标志物E-cadherin和间质标志物N-cadherin蛋白表达水平的变化。结果显示,PAFAH1B3缺失的情况下,H460细胞中E-cadherin蛋白表达水平显著上调,N-cadherin蛋白表达水平显著下调(图7,均P<0.01),表明PAFAH1B3促进了EMT的过程。

1:shPAFAH1B3;2:shControl;3:Parental;与shControl组比较,**P<0.01
3 讨论
在本研究中,我们发现与人支气管上皮细胞相比,PAFAH1B3在LCLC细胞中的表达显著上调。在PAFAH1B3缺失情况下,LCLC细胞生长变慢,克隆形成能力减弱,侵袭能力也受到了抑制。沉默PAFAH1B3引起的LCLC细胞增殖减慢可能与其对细胞周期的抑制有关。此外PAFAH1B3的缺失可以逆转EMT的过程。这些研究结果表明,PAFAH1B3在LCLC中发挥着致癌的作用,它通过调控EMT过程促进了LCLC的进展。
PAFAH1B3通常表达于胎儿脑、胰腺、胸腺、结肠、睾丸组织和红细胞中,PAFAH1B3与PAFAH1 B2在哺乳动物中显示较高的同源性,它们参与了神经发育以及精子发生的过程[6]。PAFAH1B3还可以影响血管生成,Wei等[7]发现在胰岛素刺激下,PAFAH1B3可能被棕榈酰化,抑制棕榈酰化或敲除PAFAH1B3可防止胰岛素诱导的血管生成。Livnat等[8]发现过表达PAFAH1B3可以导致β-catenin表达的减少,提示PAFAH1B3可以作为Wnt信号通路的负调节器;而Wnt信号通路影响了癌症干细胞的维持、转移和免疫调节等过程[9]。有研究发现血小板活化因子(platelet activating factor,PAF)的抑制剂可以促进PAFAH1B3的表达,加速PAF的水解,抑制PAF介导的Caspase-3的激活,强调了PAFAH1B3抗凋亡的作用[10]。
目前PAFAH1B3在人类多种肿瘤中已经有相关的研究,现有结果均提示其在肿瘤中的促瘤作用。例如,通过免疫组化分析证实,下咽鳞状细胞癌组织中PAFAH1B3较癌旁组织表达升高,PAFAH1B3高表达与下咽鳞状细胞癌患者较短的总生存期相关[11]。在乳腺肿瘤中,PAFAH1B3表达水平较正常乳腺组织明显上调,其表达升高明显降低了乳腺癌患者无复发生存率[12]。小干扰RNA沉默PAFAH1B3和药物阻断PAFAH1B3均可抑制乳腺癌细胞的致病性,可以引起广泛的脂质代谢变化,包括具有抗肿瘤和促凋亡作用的肿瘤抑制脂质的增加,如神经酰胺、磷脂酰胆碱和磷脂酰丝氨酸等[12-13]。Fiedler等[14]还发现PAFAH1B3的丢失可以使白血病细胞对酪氨酸激酶抑制剂治疗显著致敏。
在本研究中,我们观察到沉默PAFAH1B3抑制了LCLC细胞的增殖、克隆形成和侵袭,并可以诱导细胞周期由S期向G0/G1期转化,这些结果说明了PAFAH1B3在LCLC中的促瘤作用,这与先前的研究结果是一致的。
PAFAH1B3的失调影响了LCLC侵袭能力,然而PAFAH1B3参与LCLC转移的确切分子机制尚不清楚。肿瘤转移是一个多步骤的过程,在这个过程中,肿瘤细胞离开原发肿瘤,扩散到远处部位,并形成继发肿瘤[15]。EMT被认为是转移的起始阶段,在肺癌的进展中起着核心作用,靶向EMT信号传导可能是一种新的治疗策略[16]。在EMT过程中,上皮细胞失去其特征,获得侵入性间质表型。EMT发生时,常可以观察到上皮标志物E-cadherin的表达减少,而间质标志物N-cadherin的表达增加[17]。本研究中,我们发现沉默PAFAH1B3可以诱导LCLC细胞中E-cadherin的表达,降低N-cadherin的表达,说明PAFAH1B3是LCLC中EMT的促进因子。E-cadherin是细胞粘附连接的重要组成部分,在细胞粘附和维持上皮细胞表型中起重要作用,E-cadherin表达降低可以导致细胞的粘附丧失,细胞活力增加[18]。本实验中,我们证实了E-cadherin的蛋白表达与PAFAH1B3的表达呈负相关,但E-cadherin下调的机制尚不明确,肿瘤细胞中TGF-β、转录因子(包括Snail、Zeb和Twist)以及microRNA等均可以通过其相应的通路下调E-cadherin的表达[19-21]。我们后续的研究需要进一步探讨PAFAH1B3促进E-cadherin下调的调控机制以及PAFAH1B3在动物模型中的促瘤作用。
综上所述,PAFAH1B3在LCLC中是肿瘤的促进因子,PAFAH1B3通过调控EMT过程促进了LCLC的进展,PAFAH1B3可能是LCLC治疗中一个潜在靶点。

