lncRNA OIP5-AS1在脑缺血再灌注大鼠模型中的表达及对缺氧缺糖复供诱导的细胞凋亡的影响*
林清江, 魏 冠, 杨锦锋, 张国炳
福建医科大学附属第二医院急诊科,泉州 362000
脑血管疾病已经成为威胁中老年人群生命健康和生活质量的重要原因,脑缺血诱发的脑组织梗死最为常见,其也是目前世界范围内引起老年人残疾和死亡的关键因素。脑缺血会引起糖分、氧气等物质运输障碍,诱导神经细胞损伤,即使是经溶栓治疗后脑组织血液流通恢复,也会产生缺血再灌注损伤[1]。目前的研究显示,脑缺血再灌注损伤发生机制与神经细胞凋亡、氧化损伤等有关,探讨脑缺血再灌注神经细胞损伤机制对于分子靶向治疗缺血性脑损伤具有重要意义[2]。长链非编码RNA(lncRNA)是常见的非编码RNA,其长度大于200 nt,在人体组织中普遍表达,在不同的发育阶段和不同组织中lncRNA的表达谱不同,这可能与lncRNA的生物学作用有关[3]。lncRNA不仅在正常细胞生长、分化、凋亡以及组织代谢中具有十分重要的调节作用,在多种疾病进展过程中也发挥功能,lncRNA也已经成为疾病治疗的潜在靶点[4]。Opa相互作用蛋白5反义转录本1(OIP5-AS1)定位在15q15.1染色体上,在脊椎动物进化过程中十分保守,参与癌症如神经胶质瘤的进展[5]。有实验发现,OIP5-AS1与缺血再灌注组织损伤有关,其在心肌缺血再灌注中表达下调,并且上调OIP5-AS1可改善心肌细胞损伤[6]。目前OIP5-AS1在脑缺血再灌注神经细胞损伤中的作用还不明确。本次实验以PC12细胞为研究对象,给予缺氧缺糖复供(OGD/R)处理,体外模拟脑缺血再灌注神经细胞损伤,探讨OIP5-AS1在脑缺血再灌注神经细胞凋亡和氧化损伤中的作用和机制,为基因治疗脑缺血再灌注神经损伤提供方向。
1 材料与方法
1.1 实验材料
SD雄性大鼠,体重220~250 g,2月龄,购自上海斯莱克实验动物有限责任公司[许可证号:SCXK(沪)2017-0005,动物合格证号:2015000556864];PC12细胞购自通派(上海)生物科技有限公司;Bax抗体、Akt抗体购自美国Cell Signaling Technology公司;p-PI3K抗体购自美国Abcam公司;SOD检测试剂盒(黄嘌呤氧化法)购自北京百奥莱博科技有限公司;Bcl-2抗体购自美国BioVision公司;OIP5-AS1过表达载体、阴性对照载体由广州源井生物科技有限公司构建;MDA检测试剂盒(硫代巴比妥酸法)购自碧云天生物技术研究所;p-Akt抗体购自美国Santa Cruz公司;ROS检测试剂盒(DCFH-DA法)购自上海联迈生物工程有限公司;PI3K抗体购自美国Proteintech公司。
1.2 脑缺血再灌注大鼠模型构建
大鼠分成2组,分别为假手术(Sham)组、脑缺血再灌注(I/R)组,每组9只大鼠,I/R组进行脑缺血再灌注模型构建,Sham组大鼠不插入拴线,其余同I/R组。模型构建采用大脑中动脉阻塞法[7],步骤简述如下:各组大鼠在造模前禁食12 h,按照300 mg/kg剂量以10%的水合氯醛将大鼠麻醉,仰卧固定在手术台上,用碘伏消毒以后,沿着颈部正中的位置将皮肤切开,将组织以及肌肉组织分离,以玻璃分针把右侧的颈外动脉、颈总动脉以及颈内动脉分离,以棉线结扎颈外动脉和颈内动脉。在靠近分叉处的颈总动脉剪出一个小口,将直径为0.28 mm的大鼠大脑中动脉闭塞(MCAO)拴线插入,从颈总动脉的分叉处转入到颈内动脉,当感觉到有轻微阻力时,拴线刚好进入到大脑前动脉,把MCAO拴线血管之外的部分以棉线结扎,缺血90 min后,把拴线取出,恢复血液流通,实现再灌注24 h后,取大鼠脑组织进行后续实验。
1.3 qRT-PCR方法检测脑组织中OIP5-AS1水平
取大鼠脑组织,分别添加Trizol试剂,提取组织中的总RNA,紫外分光光度计检测A260nm/A280nm的比值在1.8~2.0之间。取1 μg的RNA与2 μL的DNA Eraser混合,最后添加Rnase free H2O至10 μL,放在42℃孵育2 min,继续添加1 μL的PrimeScript RT Enzyme MT、1 μL的5×PrimeScript Buffer、1 μL的RT Primer mix,加入Rnase free H2O至20 μL,放在37℃孵育15 min,85℃孵育5 s,放在4℃孵育5 min。合成cDNA长期保存在-80℃。以GAPDH作为参照,进行PCR反应,反应体系如下:2 μL的cDNA、0.8 μL的Forward Primer和Reverse Primer、10 μL的TB Green premix Ex Taq、0.4 μL的Reference Dye,最后加入灭菌水至20 μL,放在95℃孵育30 s,95℃孵育5 s;60℃孵育34 s;95℃孵育15 s,60℃孵育60 s,95℃孵育15 s,共40个循环。结果以2-ΔΔCt法计算OIP5-AS1的表达水平。
1.4 OGD/R体外细胞模型构建及处理
PC12细胞分成Control组、OGD/R组、Vector+OGD/R组、OIP5-AS1+OGD/R组。其中OGD/R、Vector+OGD/R、OIP5-AS1+OGD/R组进行OGD/R处理,Vector+OGD/R、OIP5-AS1+OGD/R组细胞在进行OGD/R处理前转染阴性对照载体(Vector)或OIP5-AS1过表达载体(OIP5-AS1)。细胞转染方法按照转染试剂Lipofectamine 2000说明书进行。OGD/R处理方法[8]如下:将PC12细胞以无糖、无血清细胞培养液悬浮,放在0.2% O2、5% CO2、95%N2条件下培养3 h,然后更换为含糖、含10%胎牛血清的细胞培养液,置于37℃,5% CO2培养箱中培养24 h。Control组细胞正常培养。取Control、OGD/R、Vector+OGD/R、OIP5-AS1+OGD/R组细胞,按照1.3中qRT-PCR方法检测OIP5-AS1水平。
1.5 CCK-8实验检测细胞增殖
将PC12细胞按照Control、OGD/R、Vector+OGD/R、OIP5-AS1+OGD/R组分组方法接种到96孔板中,每个孔中接种3000个细胞,OGD/R处理24 h后,分别在细胞中添加CCK-8溶液10 μL,在37℃孵育2 h,上酶标仪测定450 nm的吸光度(A)值。以不含细胞的空白孔调零,计算细胞存活率。
1.6 流式细胞术检测细胞凋亡
取Control、OGD/R、Vector+OGD/R、OIP5-AS1+OGD/R组细胞,分别将细胞悬浮在预冷的PBS溶液中,1000× g离心10 min,将上清液弃掉,添加400 μL的Binding buffer混合,加入5 μL的PI和Annexin Ⅴ-FITC溶液,放在室温避光条件下结合20 min。用流式细胞仪检测细胞凋亡水平。
1.7 Western blot检测蛋白表达水平
取Control、OGD/R、Vector+OGD/R、OIP5-AS1+OGD/R组细胞,分别在细胞中添加RIPA蛋白裂解试剂,放在冰上裂解30 min,以4℃,12000× g离心10 min,将上清吸取至EP管中,放在-70℃保存,以二喹啉甲酸(BCA)方法测定蛋白浓度。分别配制10%的分离胶和5%的浓缩胶。在蛋白溶液中添加5×Loading buffer,放在100℃煮沸5 min。在聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上样孔中添加40 μg的蛋白样品,接通电源,首先以70 V的电压电泳30 min,观察溴酚蓝染料进入到分离胶以后,再以120 V的电压电泳2 h。观察溴酚蓝染料进入凝胶的下端边缘以后,终止电泳。将聚偏二氟乙烯(PVDF)膜根据凝胶的大小裁剪,放在甲醇中浸泡2 min,然后置于转膜缓冲液中孵育15 min。设置120 mA的恒流转膜2 h。将PVDF膜放在含有5%牛血清白蛋白的封闭液中,在室温结合2 h。把PVDF膜置于一抗稀释溶液中,在4℃的冰箱中结合过夜。将PVDF膜放在TBST中洗涤3次,再放置于二抗稀释溶液中,室温结合1 h。按照电化学发光试剂(ECL)盒方法进行显色。根据条带的灰度值,分析目的蛋白相对表达水平,内参为甘油醛-3-磷酸脱氢酶(GAPDH)。Bax、Bcl-2、PI3K、Akt抗体按照1∶1000稀释,p-Akt、p-PI3K抗体按照1∶600稀释,二抗按照1∶2000稀释。
1.8 MDA、SOD、ROS水平检测
取Control、OGD/R、Vector+OGD/R、OIP5-AS1+OGD/R组细胞,分别用MDA检测试剂盒(硫代巴比妥酸法)、SOD检测试剂盒(黄嘌呤氧化法)、ROS检测试剂盒(DCFH-DA法)测定细胞中MDA、SOD、ROS水平。
1.9 PI3K/Akt信号通路抑制剂对OIP5-AS1的作用检测
取转染OIP5-AS1过表达载体的PC12细胞,用含有50 μmol/L PI3K/Akt信号抑制剂LY294002的细胞培养液预处理4 h,然后给予OGD/R处理,记为OIP5-AS1+OGD/R+LY294002组,以OIP5-AS1+OGD/R组作为参照,CCK-8法检测细胞增殖(步骤同1.5),流式细胞术检测细胞凋亡(步骤同1.6),Western blot检测Bax、Bcl-2、p-PI3K、PI3K、p-Akt、Akt蛋白表达(步骤同1.7),试剂盒检测MDA、SOD、ROS水平(步骤同1.8)。
1.10 统计学方法
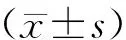
2 结果
2.1 脑缺血再灌注大鼠模型中OIP5-AS1低表达
I/R组大鼠脑组织中OIP5-AS1表达水平(0.53±0.06)低于Sham组(1.00±0.12)(P<0.05)。脑缺血再灌注大鼠脑组织中OIP5-AS1表达水平降低。
2.2 OIP5-AS1过表达载体上调OGD/R处理的PC12细胞中OIP5-AS1水平
与Control组(1.00±0.11)比较,OGD/R组PC12细胞中OIP5-AS1水平降低(0.46±0.07,P<0.05);与Vector+OGD/R组(0.49±0.05)比较,OIP5-AS1+OGD/R组PC12细胞中OIP5-AS1水平升高(1.23±0.15,P<0.05)。OIP5-AS1过表达载体可上调OGD/R处理的PC12细胞中OIP5-AS1水平。
2.3 上调OIP5-AS1对OGD/R处理的PC12细胞增殖和凋亡的影响
结果见图1和表1,与Control组比较,OGD/R组PC12细胞存活率降低,细胞凋亡率升高,细胞中Bax蛋白表达水平升高,Bcl-2蛋白表达水平降低(均P<0.05);与Vector+OGD/R组比较,OIP5-AS1+OGD/R组PC12细胞存活率升高,细胞凋亡率降低,细胞中Bax蛋白表达水平降低,Bcl-2蛋白表达水平升高(均P<0.05)。上调OIP5-AS1可减少OGD/R处理的PC12细胞凋亡,提高细胞增殖活性。

1:Control组;2:OGD/R组;3:Vector+OGD/R组;4:OIP5-AS1+OGD/R组;A:流式细胞术测定PC12细胞凋亡变化;B:Western blot测定Bax、Bcl-2蛋白表达变化

表1 上调OIP5-AS1后OGD/R处理的PC12细胞存活率、凋亡率和Bax、Bcl-2蛋白水平
2.4 上调OIP5-AS1对OGD/R处理的PC12细胞氧化损伤的影响
结果见表2,与Control组比较,OGD/R组PC12细胞中SOD活性降低,MDA水平和ROS水平升高(均P<0.05);与Vector+OGD/R组比较,OIP5-AS1+OGD/R组PC12细胞中SOD活性升高,MDA水平和ROS水平降低(均P<0.05)。上调OIP5-AS1可减少OGD/R处理的PC12细胞氧化损伤。

表2 上调OIP5-AS1后OGD/R处理的PC12细胞中MDA、SOD、ROS水平
2.5 上调OIP5-AS1对OGD/R处理的PC12细胞中PI3K/Akt信号通路的影响
结果见图2和表3,与Control组比较,OGD/R组PC12细胞p-PI3K/PI3K、p-Akt/Akt降低(均P<0.05);与Vector+OGD/R组比较,OIP5-AS1+OGD/R组PC12细胞p-PI3K/PI3K、p-Akt/Akt升高(均P<0.05)。上调OIP5-AS1可激活OGD/R处理的PC12细胞中PI3K/Akt信号通路。

1:Control组;2:OGD/R组;3:Vector+OGD/R组;4:OIP5-AS1+OGD/R组

表3 上调OIP5-AS1后OGD/R处理的PC12细胞中p-PI3K/PI3K、p-Akt/Akt
2.6 PI3K/Akt信号抑制剂逆转上调OIP5-AS1对OGD/R处理的PC12细胞增殖、凋亡和氧化损伤的作用
结果见图3和表4,与OIP5-AS1+OGD/R组比较,OIP5-AS1+OGD/R+LY294002组PC12细胞中p-PI3K/PI3K、p-Akt/Akt降低,细胞存活率降低,细胞凋亡率升高,细胞中Bax蛋白水平升高,Bcl-2蛋白水平降低,SOD活性降低,MDA和ROS水平升高(均P<0.05)。抑制PI3K/Akt信号逆转上调OIP5-AS1对OGD/R处理的PC12细胞增殖、凋亡和氧化损伤的作用。

1:OIP5-AS1+OGD/R组;2:OIP5-AS1+OGD/R+LY294002组;A:流式细胞术测定PC12细胞凋亡变化;B:Western blot测定PC12细胞中Bax、Bcl-2、p-PI3K、PI3K、p-Akt、Akt蛋白表达变化

表4 PI3K/Akt信号通路抑制剂LY294002和上调OIP5-AS1后对OGD/R处理的PC12细胞各种指标的影响
3 讨论
脑缺血使脑组织神经细胞养分及氧气供应不足,导致神经细胞过度凋亡和氧化应激,进而影响神经功能[9]。研究显示,缺血条件下,神经细胞会产生大量的ROS,这些ROS不能及时被抗氧化酶清除而聚集在细胞内,细胞内过量的ROS不仅可以将细胞中的脂质过氧化,造成氧化损伤,还可以激活细胞凋亡途径,诱导细胞凋亡发生[10]。MDA是脂质发生过氧化之后的产物,MDA水平越高,细胞氧化损伤程度也就越重[11]。SOD是ROS的清除剂,其活性的高低与ROS水平相关[12]。Bcl-2蛋白家族是与细胞凋亡有关的调控蛋白,其蛋白成员在细胞凋亡过程中发挥促进或抑制作用,Bax和Bcl-2均属于Bcl-2蛋白家族成员,在细胞凋亡过程中分别发挥促进作用和抑制作用,其表达水平变化被认为是细胞凋亡水平变化的标志[13]。研究表明,细胞内过量的ROS可以激活Bcl-2凋亡相关途径,诱导细胞凋亡发生[14]。本次实验发现,OGD/R处理以后的PC12细胞存活率降低,细胞凋亡率升高,细胞中Bax蛋白水平增加,Bcl-2蛋白水平降低,细胞中ROS水平升高,SOD活性降低,MDA水平增加,这说明OGD/R处理诱导PC12细胞凋亡和氧化损伤,成功构建了缺血再灌注神经细胞损伤模型。
某些基因在脑缺血再灌注损伤中的作用已经引起了人们的广泛关注,其参与影响神经细胞凋亡和氧化损伤,基因治疗脑缺血再灌注损伤也逐渐成为现阶段研究的热点[15]。非编码RNA是不具备编码蛋白质功能的RNA总称,根据大小可以分成lncRNA、miRNA等等,lncRNA是长度超过200 nt的非编码RNA,在人体组织中具有十分重要的调控作用,其在不同的组织、细胞中表达,参与正常生理活动和疾病进程[16]。在脑缺血再灌注损伤中发现多个lncRNA表达改变,并且lncRNA还参与影响神经细胞功能调控[17]。OIP5-AS1从编码OIP5基因的反义方向转录产生,在神经系统发育中发挥关键作用[18]。有研究显示,心肌缺血再灌注损伤中OIP5-AS1表达下调,而上调OIP5-AS1抑制缺血再灌注引起的心肌细胞凋亡,OIP5-AS1在组织缺血再灌注损伤中可能发挥保护作用[6]。本实验发现,脑缺血再灌注大鼠脑组织中OIP5-AS1低表达,而上调OIP5-AS1可提高OGD/R处理诱导的PC12细胞增殖活性,减少细胞凋亡,提高细胞中SOD活性,减少MDA和ROS水平,这提示上调OIP5-AS1可改善OGD/R诱导的PC12细胞损伤,OIP5-AS1在脑缺血再灌注损伤中可能发挥保护作用。
本实验还进一步探讨了OIP5-AS1的作用机制,发现上调OIP5-AS1可提高OGD/R诱导的PC12细胞中p-PI3K、p-Akt水平。p-PI3K、p-Akt分别为PI3K、Akt的磷酸化形式,二者水平升高标志着PI3K/Akt信号被激活[19]。PI3K/Akt信号在多种疾病和生理学过程中发挥作用,如调控肿瘤、高血压疾病进展,参与调控细胞增殖、衰老、分化、凋亡等过程[20-21]。研究表明,PI3K/Akt信号通路在脑缺血再灌注神经细胞中激活水平降低,而激活PI3K/Akt信号通路可改善OGD/R诱导的PC12细胞损伤[22-23]。在骨肉瘤、胃癌等的研究中发现,OIP5-AS1通过激活PI3K/Akt信号通路发挥作用[24-25]。本实验显示,OGD/R诱导的PC12细胞中PI3K/Akt信号激活水平降低,而上调OIP5-AS1可激活PC12细胞中PI3K/Akt信号通路,PI3K/Akt信号通路抑制剂逆转了OIP5-AS1对OGD/R诱导的PC12细胞凋亡和氧化损伤的作用,这提示上调OIP5-AS1通过作用于PI3K/Akt信号通路参与调控OGD/R诱导的PC12细胞损伤。
综上,OIP5-AS1可能是一个脑缺血再灌注神经损伤的保护因子,其能够改善OGD/R诱导的PC12细胞凋亡和氧化损伤,机制与激活PI3K/Akt信号通路有关,这为研究OIP5-AS1在脑缺血再灌注损伤中的分子作用机制奠定了基础,为基因治疗脑缺血再灌注提供了新方向。以后我们会继续探讨OIP5-AS1通过何种靶向机制影响PI3K/Akt信号通路进而参与调控脑缺血再灌注神经损伤。

