慢病毒介导的PYROXD1沉默对乳腺癌细胞MCF-7增殖、迁移、侵袭和EMT的影响*
贾苗苗, 张晓俊
山西白求恩医院(山西医学科学院同济山西医院),山西医科大学第三医院乳腺外科,太原 030032
乳腺癌已经成为目前女性中发病率最高的恶性肿瘤,我国乳腺癌发病率呈现上升趋势,在城市地区乳腺癌已经成为女性中死亡率最高的恶性肿瘤[1]。手术治疗、化学治疗、内分泌治疗等是传统的乳腺癌治疗手段,虽然这些治疗手段有了很大进步,但对已经发生转移的乳腺癌控制效果较差[2]。研究显示,基因靶向治疗是乳腺癌治疗的可能途径,乳腺癌患者有着与正常组织不同的基因表达谱,探讨基因在乳腺癌进展中的作用对于寻找有效的分子标记物抑制肿瘤恶性进展具有重要意义[3]。PYROXD1基因定位在12p12.1染色体上,其可以编码一个由500个氨基酸组成的蛋白质,PYROXD1属于核质内吡啶核苷酸二硫化物还原酶(PNDR),是Ⅰ类氧化还原酶,其含有2个假定的酶结构域,分别为硝化还原酶结构域和吡啶核苷酸二硫化物氧化还原酶结构域。PYROXD1与先天性肌病有关,可调控肌肉组织的发育[4]。有研究显示,PYROXD1沉默能够降低大肠癌细胞的增殖能力,可能是一个肿瘤促进因子[5]。Wnt/β-catenin是具有多种功能的经典Wnt信号通路,广泛参与细胞生长、新陈代谢、细胞分化等过程[6]。Wnt/β-catenin在肿瘤中过度激活可诱导肿瘤进展和转移,而降低Wnt/β-catenin信号激活水平能够抑制肿瘤恶性进展[7]。本实验探讨沉默PYROXD1对乳腺癌细胞增殖、迁移、侵袭和上皮间充质转化(EMT)的影响及机制,为乳腺癌分子靶向治疗提供依据。
1 材料与方法
1.1 实验材料
乳腺癌细胞MDA-MB-231购自上海奥陆生物科技有限公司;乳腺癌细胞MCF-7购自美国ATCC;乳腺癌细胞T47D和正常乳腺上皮细胞MCF-10A购自北京北纳创联生物技术研究院;β-catenin抗体购自美国Santa Cruz;Vimentin抗体购自美国Abcam公司;c-myc抗体购自美国Affinity Biosciences公司;PYROXD1 shRNA慢病毒载体和阴性对照慢病毒载体均由艾柏森(江苏)生物科技有限公司构建;E-cadherin抗体、PYROXD1抗体购自美国Thermo公司。
1.2 qRT-PCR检测乳腺癌细胞和正常乳腺细胞中PYROXD1表达
收集乳腺癌细胞MDA-MB-231、MCF-7、T47D和正常乳腺上皮细胞MCF-10A,在细胞中添加RNAiso Plus,分别提取细胞总RNA。用紫外分光光度计检测RNA浓度和纯度。RNA放在-80℃的冰箱中保存。利用RevertAid第一链cDNA Synthesis试剂盒进行逆转录反应,首先吸取2 μL的RNA与1 μL的Oligo dT、9 μL的DEPC水混合,65℃孵育5 min,然后放在冰上冷却,继续添加4 μL的5×Reaction Buffer、2 μL的dNTP mix(10 mmol/L)、1 μL的RiboLock RNA酶抑制剂、1 μL的ReverAid M-MLV逆转录酶,最后添加DEPC水至25 μL,42℃孵育60 min,70℃孵育5 min。PCR引物由上海生工合成,序列如下:PYROXD1上游(5′-3′),TAGACAGATGGGATGGTATGC;PYROXD1下游(5′-3′),CCCAGCAGTACAACCTTATAG,内参为GAPDH,按照2-ΔΔCt法计算PYROXD1表达水平。PCR体系如下:12.5 μL的SYBR Green mix、1 μL的上游和下游引物、3.5 μL的RNase-free H2O、2 μL的cDNA模板。PCR反应程序为:95℃ 10 min,60℃ 30 s,72℃ 30 s,共30个循环。
1.3 Western blot方法检测乳腺癌细胞和正常乳腺细胞中PYROXD1蛋白表达
收集乳腺癌细胞MDA-MB-231、MCF-7、T47D和正常乳腺上皮细胞MCF-10A,在细胞中添加RIPA裂解试剂,放在冰上裂解30 min,4℃,12000× g离心5 min,吸取上清溶液,以BCA方法检测蛋白样品的浓度和纯度。将蛋白样品和5×Loading Buffer按照4∶1的比例混合,100℃孵育10 min。配制10%的分离胶和5%的浓缩胶。每30 μg的蛋白样品,在浓缩胶中以75 V的电压电泳40 min,在分离胶中以110 V的电压电泳80 min,观察溴酚蓝染料进入到分离胶的底部,停止电泳。将PVDF膜以甲醇平衡,浸泡在转膜液中,按照负极-海绵-滤纸-PVDF膜-滤纸-海绵-正极顺序放置,以100 V电压转膜90 min。配制5%牛血清白蛋白封闭液,将PVDF膜置于封闭液中孵育2 h,将非特异性的结合位点封闭,然后将PVDF膜放在1∶1000稀释的一抗溶液中,在4℃过夜,漂洗后将PVDF膜浸泡在1∶4000稀释的二抗中,在室温中结合2 h。以ECL方法显色。分析条带的灰度值,GAPDH作为内参,计算目的蛋白相对表达水平。每组重复3次。
1.4 慢病毒载体转染和实验分组
将乳腺癌细胞MCF-7种植到12孔板中,细胞贴壁以后,在细胞中添加慢病毒液,感染复数为20,继续培养24 h以后,将上清溶液弃掉,添加新鲜的细胞培养液继续培养48 h,然后用嘌呤霉素筛选稳定转染的细胞用于后续实验。将转染PYROXD1 shRNA慢病毒载体和阴性对照慢病毒载体的乳腺癌细胞MCF-7命名为Lv-sh-PYROXD1和Lv-sh-NC组,将没有转染的细胞命名为Control组。收集Control、Lv-sh-NC、Lv-sh-PYROXD1组细胞,按照1.2和1.3中qRT-PCR和Western blot方法检测细胞中PYROXD1 mRNA及蛋白表达情况。
1.5 CCK-8实验检测细胞增殖
将Control、Lv-sh-NC、Lv-sh-PYROXD1组细胞按照每个孔内100 μL细胞培养液、3000个细胞接种到96孔板中,将细胞置于37℃,5%CO2培养箱中培养24 h,将上清吸弃,继续加入100 μL的细胞培养液和10 μL的CCK-8溶液,放在37℃孵育3 h。在酶标仪上测定570 nm的吸光度值(A)。将Control组细胞存活率设置为100%,分析Lv-sh-NC、Lv-sh-PYROXD1组细胞存活率的变化。每组重复3次。
1.6 Transwell小室检测细胞迁移和侵袭
在细胞侵袭实验前,首先将50 mg/L的Matrigel以1∶8的比例稀释,将Transwell小室的上室包被,4℃条件下风干,在37℃孵育过夜。其余步骤同迁移实验,步骤简述为:将Control、Lv-sh-NC、Lv-sh-PYROXD1组细胞悬浮在不含血清的细胞培养液中,细胞密度为1×105个/mL,取200 μL添加到Transwell小室的上室中,在下室中添加500 μL含血清细胞培养液,培养24 h以后,用棉签把没有穿过膜的细胞擦掉,然后以甲醇固定30 min。0.1%的结晶紫染色。在显微镜下选择5个视野,计数穿膜细胞数量,结果取均值。
1.7 Western blot检测细胞中E-cadherin、Vimentin、β-catenin、c-myc蛋白水平
以Western blot方法检测Control、Lv-sh-NC、Lv-sh-PYROXD1组中E-cadherin、Vimentin、β-catenin、c-myc蛋白水平,步骤参照1.3。
1.8 Wnt/β-catenin信号激活剂对沉默PYROXD1调控乳腺癌细胞的作用
取稳定转染PYROXD1 shRNA慢病毒的乳腺癌细胞MCF-7,以含有Wnt/β-catenin信号激活剂LiCl(10 mmol/L)的细胞培养液培养24 h,记为Lv-sh-PYROXD1+LiCl组,以Lv-sh-PYROXD1组为参照,利用CCK-8法检测细胞增殖,Transwell小室检测细胞迁移和侵袭,Western blot方法检测E-cadherin、Vimentin、β-catenin、c-myc蛋白表达,步骤同上。每组重复3次。
1.9 统计学方法

2 结果
2.1 乳腺癌细胞和正常乳腺细胞中PYROXD1表达比较
乳腺癌细胞MDA-MB-231、MCF-7、T47D中PYROXD1蛋白和mRNA水平明显高于正常乳腺上皮细胞MCF-10A(均P<0.05);乳腺癌细胞MDA-MB-231、T47D中PYROXD1蛋白和mRNA水平明显低于乳腺癌细胞MCF-7(均P<0.05),见图1和表1。选择PYROXD1表达水平最高的乳腺癌细胞MCF-7进行后续实验。
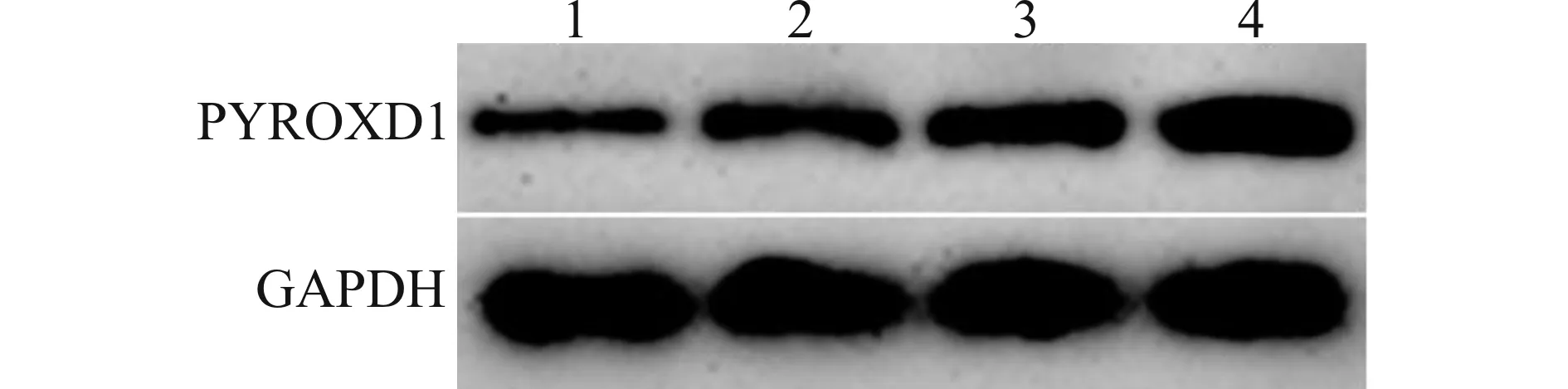
1:MCF-10A;2:MDA-MB-231;3:T47D;4:MCF-7
表1 乳腺癌细胞MDA-MB-231、MCF-7、T47D和正常乳腺上皮细胞MCF-10A中PYROXD1蛋白和mRNA水平
2.2 PYROXD1慢病毒载体沉默乳腺癌细胞MCF-7中PYROXD1表达
与Control、Lv-sh-NC组比较,Lv-sh-PYROXD1组乳腺癌细胞MCF-7中PYROXD1蛋白和mRNA表达水平降低(均P<0.05),见图2和表2。PYROXD1慢病毒载体沉默乳腺癌细胞MCF-7中PYROXD1表达。
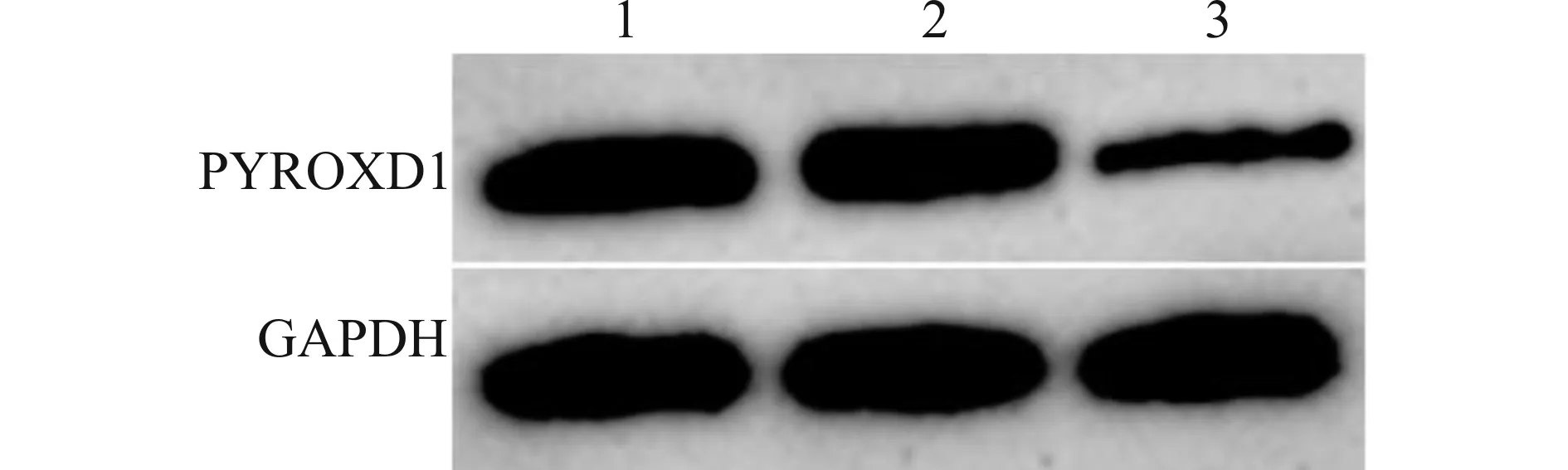
1:Control;2:Lv-sh-NC;3:Lv-sh-PYROXD1
表2 转染PYROXD1慢病毒载体的乳腺癌细胞MCF-7中PYROXD1蛋白和mRNA表达水平
2.3 沉默PYROXD1对乳腺癌细胞增殖、迁移和侵袭的影响
与Control、Lv-sh-NC组比较,Lv-sh-PYROXD1组乳腺癌细胞MCF-7存活率、迁移数目、侵袭数目以及细胞中Vimentin蛋白表达水平均降低,E-cadherin蛋白表达水平升高(均P<0.05)。见图3、图4和表3。沉默PYROXD1可抑制乳腺癌细胞MCF-7增殖、迁移、侵袭和EMT。
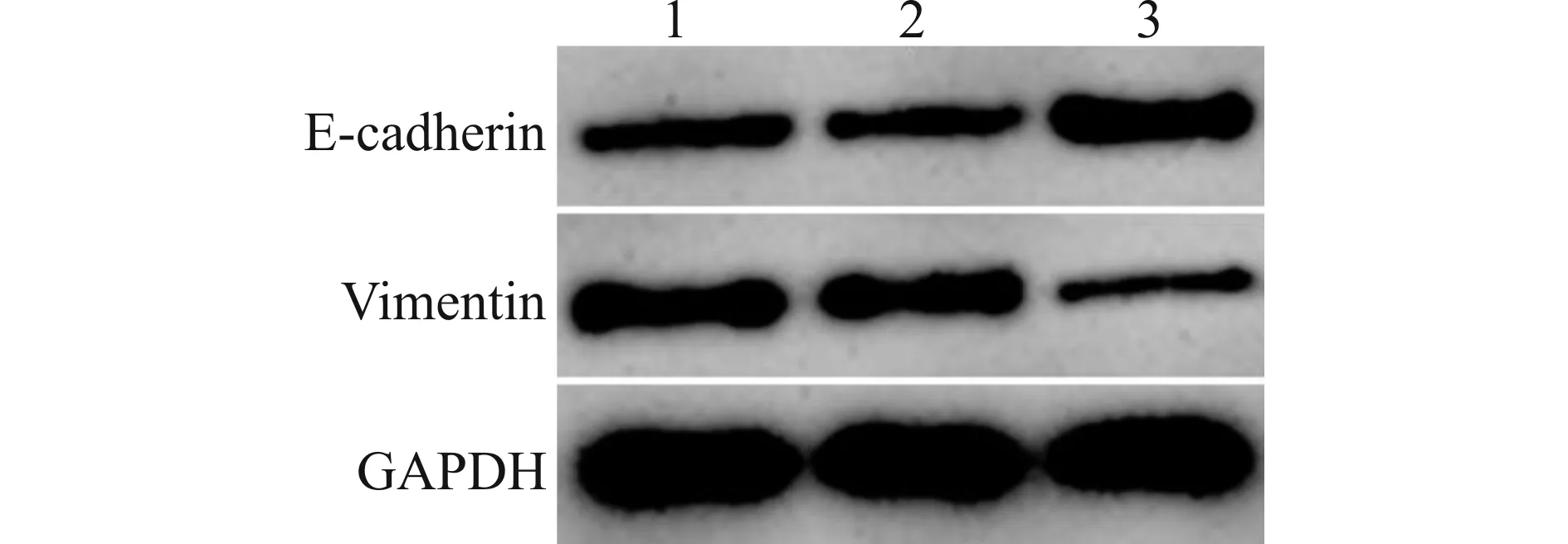
1:Control;2:Lv-sh-NC;3:Lv-sh-PYROXD1
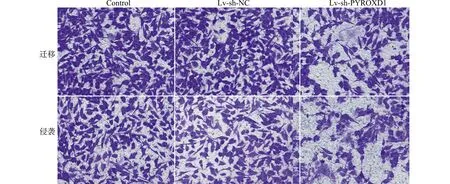
图4 Transwell检测转染PYROXD1慢病毒载体的乳腺癌细胞MCF-7的迁移、侵袭(结晶紫染色,×200)
表3 转染PYROXD1慢病毒载体的乳腺癌细胞MCF-7存活率、迁移数目、侵袭数目以及细胞中E-cadherin、Vimentin蛋白表达水平
2.4 沉默PYROXD1对乳腺癌细胞中Wnt/β-catenin信号通路的影响
与Control、Lv-sh-NC组比较,Lv-sh-PYROXD1组乳腺癌细胞中β-catenin、c-myc蛋白表达水平均降低(均P<0.05),见图5和表4。沉默PYROXD1可抑制乳腺癌细胞MCF-7中Wnt/β-catenin信号通路。
表4 转染PYROXD1慢病毒载体的乳腺癌细胞MCF-7中β-catenin、c-myc蛋白表达水平
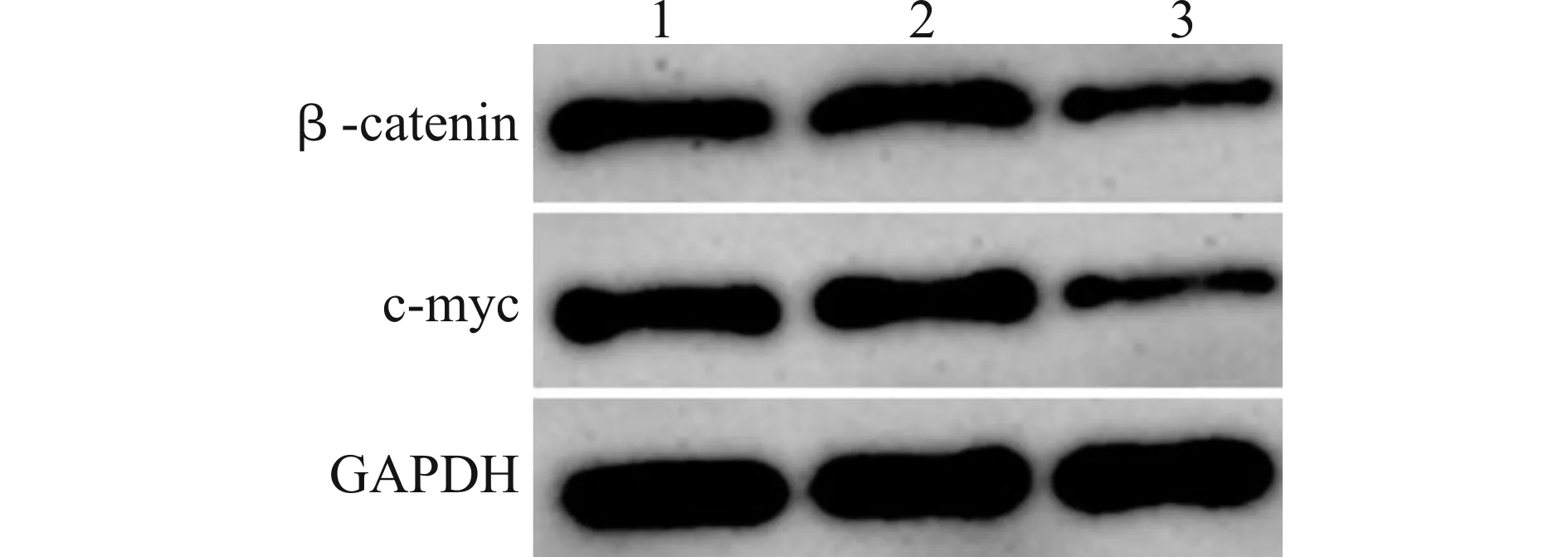
1:Control;2:Lv-sh-NC;3:Lv-sh-PYROXD1
2.5 Wnt/β-catenin信号激活剂对沉默PYROXD1的乳腺癌细胞MCF-7中Wnt/β-catenin信号的影响
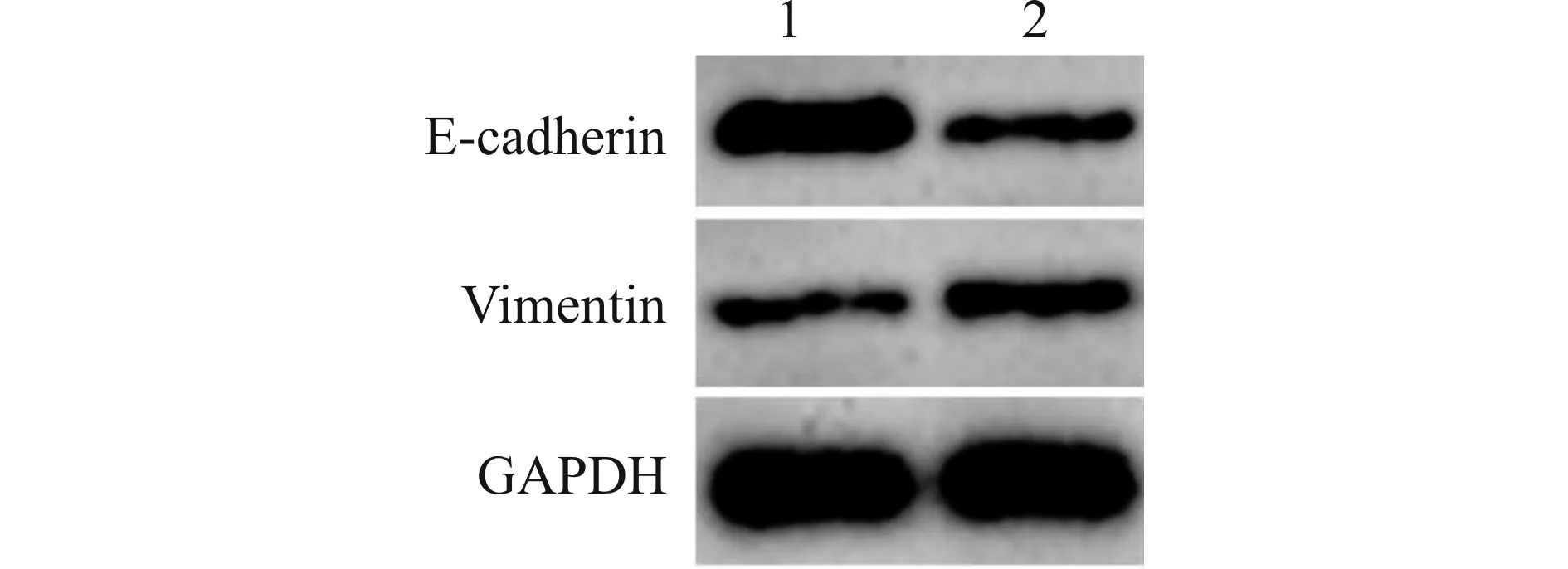
与Lv-sh-PYROXD1组比较,Lv-sh-PYROXD1+LiCl组乳腺癌细胞中β-catenin、c-myc蛋白表达水平均升高(均P<0.01),见图6和表5。
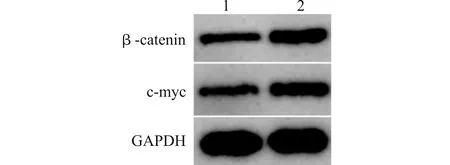
1:Lv-sh-PYROXD1;2:Lv-sh-PYROXD1+LiCl
表5 Wnt/β-catenin信号激活剂处理和转染PYROXD1慢病毒载体的乳腺癌细胞MCF-7中β-catenin、c-myc蛋白表达水平
2.6 Wnt/β-catenin信号激活对沉默PYROXD1影响乳腺癌细胞MCF-7增殖、迁移、侵袭和EMT的作用
与Lv-sh-PYROXD1组比较,Lv-sh-PYROXD1+LiCl组乳腺癌细胞存活率、迁移细胞数目、侵袭细胞数目以及细胞中Vimentin蛋白表达水平均升高,E-cadherin蛋白表达水平降低(均P<0.05)。见图7、图8和表6。
表6 Wnt/β-catenin信号激活剂处理和转染PYROXD1慢病毒载体的乳腺癌细胞MCF-7存活率、迁移细胞数目、侵袭细胞数目以及细胞中E-cadherin、Vimentin蛋白表达水平
1:Lv-sh-PYROXD1;2:Lv-sh-PYROXD1+LiCl
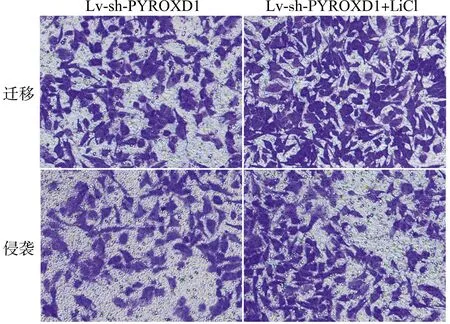
图8 Transwell检测Wnt/β-catenin信号激活剂处理和转染PYROXD1慢病毒载体的乳腺癌细胞MCF-7的迁移、侵袭(结晶紫染色,×200)
3 讨论
乳腺癌是威胁妇女健康的主要恶性肿瘤,靶向治疗研究已经成为乳腺癌治疗领域研究的热点,其特异性较强,不良反应相对小,可为乳腺癌患者提供更多治疗机会[8]。因此,研究影响乳腺癌进展的分子机制可为靶向治疗提供靶点。PYROXD1在人体内的很多组织中表达,参与骨骼肌发育,其属于细胞核和细胞质氧化还原酶的编码物,最近几年发现PYROXD1在人体相关肌病中发挥作用[9]。有实验显示,PYROXD1在大肠癌中表达上调,下调PYROXD1可抑制大肠癌细胞的恶性增殖,表明PYROXD1可能是大肠癌的促进因子[5]。本实验显示,PYROXD1在乳腺癌细胞中的表达水平高于正常乳腺癌细胞,并且沉默PYROXD1可降低乳腺癌细胞增殖能力,这与以前的研究结果相一致,说明PYROXD1在肿瘤进展中可能发挥促癌作用,PYROXD1或可成为乳腺癌靶向治疗的一个靶点。
肿瘤的发生和进展与转移密切相关,肿瘤转移已经成为肿瘤致死的关键原因之一[10]。肿瘤的转移是一个极为复杂的过程,其受到很多因素的影响,例如肿瘤细胞迁移能力、EMT水平等等[11]。EMT主要是指上皮细胞特征逐渐消失,间质细胞特征逐渐明显的过程[12]。在肿瘤转移中,EMT被认为是肿瘤转移的早期标志事件,发生EMT的肿瘤细胞转移能力大大增加[13]。E-cadherin是上皮细胞标志蛋白,其在肿瘤组织中表达下调;Vimentin是间质细胞标志蛋白,其在肿瘤组织中表达上调,E-cadherin、Vimentin表达改变被认为是EMT的标志[14-16]。本实验表明,沉默PYROXD1后,乳腺癌细胞迁移和侵袭能力降低,细胞中E-cadherin蛋白表达水平升高,Vimentin蛋白表达水平降低,这提示沉默PYROXD1降低了乳腺癌细胞迁移、侵袭和EMT能力,表明沉默PYROXD1具有降低乳腺癌细胞转移的作用。
信号通路在人体组织中的作用极为重要,不仅与细胞生长、免疫调节、稳态维持等有关,还与人类众多疾病有关[17]。Wnt信号通路是一个复杂的蛋白质作用网络,其包含很多能够调控Wnt信号相关分子合成的蛋白,其可以与靶细胞膜上的特异性受体相互作用,靶细胞通过细胞以及细胞外Wnt配体作用做出相应的反应,进而影响细胞的分化、迁移、侵袭等过程[18]。Wnt/β-catenin是经典的Wnt信号通路,其是一个在进化中极为保守的信号转导通路,β-catenin是该信号通路的核心,β-catenin表达上调能够诱导Wnt/β-catenin激活,反之,β-catenin表达下调则抑制Wnt/β-catenin激活[19]。c-myc是Wnt/β-catenin信号的下游基因,Wnt/β-catenin信号激活诱导c-myc表达[20]。Wnt/β-catenin在人类肿瘤中过度激活,Wnt/β-catenin信号抑制剂能够降低肿瘤细胞的增殖和迁移能力[21]。本实验显示,沉默PYROXD1后的乳腺癌细胞中β-catenin、c-myc表达水平降低,表明沉默PYROXD1可抑制Wnt/β-catenin信号通路激活。而Wnt/β-catenin信号激活剂能够逆转沉默PYROXD1对乳腺癌细胞增殖、迁移和侵袭作用,这说明沉默PYROXD1可能通过降低Wnt/β-catenin信号激活水平而发挥作用。
综上,PYROXD1在乳腺癌细胞中表达上调,而沉默PYROXD1可抑制乳腺癌细胞增殖、迁移、侵袭和EMT,机制与下调Wnt/β-catenin信号有关。PYROXD1可能是乳腺癌治疗的靶点。本次实验尚未分析PYROXD1通过何种靶向机制影响Wnt/β-catenin信号进而参与乳腺癌进展,在以后实验中会对这部分内容进行分析和讨论。

