扳机日血清雌激素不同水平时授精前后卵母细胞孵育时间对短时受精胚胎移植结局的影响
杨志伟,耿亚松,李国臻,陶林林,戴豪杨,戴芳芳,郑波
(邢台不孕不育专科医院/邢台生殖与遗传专科医院,邢台 054000)
体外受精-胚胎移植(IVF-ET)技术中通过促排卵得到较多的卵母细胞,体外培养后可挑选形态学较好的胚胎移植入子宫,提高单次移植成功率,但卵母细胞利用率较低,通常需要获得10枚卵母细胞才能获得满意的妊娠结局[1]。大量研究表明,体外过夜受精时非生理状态的高浓度精子产生氧自由基等损伤胚胎发育潜能[2-3],短时受精联合早期补救ICSI可有效避免卵母细胞受精失败的风险,并且短时受精比过夜受精可获得更好的胚胎结局和临床妊娠结局[4-5]。因此,短时受精已被广泛应用于国内大量生殖医学中心。
中国专家共识[6]建议短时受精加精时间为HCG注射后38~40 h,受精率较为理想。HCG注射后授精时机可能会影响卵母细胞的发育能力[7]。增加受精前卵母细胞孵育时间有利于卵母细胞质成熟,核质同步成熟是卵子受精和获得优质胚胎的有力保障,但卵母细胞体外孵育时间过长可引起卵母细胞的老化,且培养基中代谢废物的积累均可导致非整倍体概率的增加[8],错过最佳受精时机。短时受精缩短精卵共培养时间至1~6 h,能够改善可移植胚胎率和优质胚胎率[9]。在规范的时间内,适当调整授精时机可导致卵母细胞孵育时间和精卵共孵育时间长短的改变。本研究分析卵母细胞取出后体外孵育时间和精卵共孵育时间对IVF-ET结局的影响,探讨在取卵时间和脱颗粒细胞时间相对固定的情况下,如何综合考虑取卵后卵母细胞孵育时间和精卵共孵育时间,选择合适的授精方案。
材料与方法
一、研究对象
回顾性分析2017年1月至2020年12月在我院生殖中心行IVF-ET治疗患者的临床数据。
纳入标准:女方年龄≤35 岁;首次主因女方输卵管因素接受辅助生殖短时受精助孕,新鲜胚胎移植;排除子宫内膜异位症、盆腔炎等宫腔和盆腔病变,子宫畸形和染色体异常患者。
所研究的时间段共2 060例患者在我中心行短时受精助孕。排除短时受精失败行早期补救ICSI 119例和未新鲜周期移植748例,最终共1 193例行短时受精新鲜周期移植的患者纳入分析。
二、诊疗回顾
1.控制性促排卵:纳入研究对象均采用常规长方案促排卵,女方在黄体期肌肉注射促性腺激素释放激素激动剂(GnRH-a,达菲林,益普生,法国),达到降调节后,给予重组促卵泡β素(rFSH,普利康,欧加农,荷兰)或尿促性素(HMG,乐宝得,珠海丽珠制药)促排卵,定期通过阴道B超监测卵泡发育情况,当1/3卵泡直径≥18 mm时肌肉注射HCG(珠海丽珠制药)5 000~10 000 U,36 h左右B超引导下经阴道穿刺取卵。卵冠丘复合体置于37℃、6%CO2培养箱中培养。
2.体外受精和胚胎移植:HCG注射后38~40 h授精。30~50 μl微滴法授精,每滴1~2个卵母细胞,授精浓度为2×105条/ml。授精后1~6 h拆除卵子周围大量颗粒细胞,观察受精情况酌情行早补救ICSI。授精后16~18 h观察,出现两个极体和两个原核为正常受精,两个以上原核为多原核受精。参考2011年版ESHERE发布的Istanbul共识[10],受精后第3天根据卵裂球数目、大小不均、碎片和有无多核等情况判定胚胎质量为优质、中等和差,选择中等及以上1~2枚胚胎进行移植和冷冻,剩余胚胎培养囊胚;受精后第5天和第6天对囊胚进行评分,参考Gardner评分标准[11],选择3BC及以上评分囊胚移植或冷冻。
3.黄体支持和妊娠确定:取卵当日肌注黄体酮注射液(浙江仙琚)进行黄体支持。视HCG注射日E2水平,移植日给予适量雌二醇(补佳乐,拜耳医药,德国)补充,移植当日常规使用黄体酮(安琪坦,博赏医药,法国)口服或阴道上药进行黄体支持。移植后14 d查血HCG,阳性者移植后28 d行B超检查,见孕囊确定临床妊娠。
三、分组及观察指标
根据注射HCG日雌激素水平的中位数将新鲜周期移植患者二分类为E2≤11 129.63 pmol/L组(A组)和E2>11 129.63 pmol/L组(B组);再根据取卵至授精时长的中位数将新鲜周期移植患者二分类为卵母细胞孵育时间≤3 h组(A1组和B1组)和卵母细胞孵育时间>3 h组(A2组和B2组)。
卵母细胞孵育时间为取卵至授精时间,精卵共孵育时间为授精至脱颗粒细胞时间;正常受精率=受精后16~18 h出现2原核及2极体卵子数/加精卵子总数×100%;多PN率≥3原核卵子数/加精卵子总数×100%;可移植胚胎率=(冷冻或移植评级为中等及以上的卵裂胚数+3BC及以上囊胚数)/卵裂数×100%;优质胚胎率=(冷冻或移植优质卵裂胚数+3BB及以上囊胚数)/卵裂数×100%;早补救ICSI率=早补救ICSI周期数/短时受精周期数×100%;临床妊娠率=临床妊娠周期数/新鲜移植周期数×100%;种植率=孕囊数/移植胚胎数×100%;流产率=流产周期数/临床妊娠周期数×100%。
四、统计学分析
结 果
一、患者基础资料比较
共1 193例短时受精且完成鲜胚移植的患者纳入最终分析。依据HCG日雌激素水平将新鲜周期移植患者分为E2≤11 129.63 pmol/L组(A组,n=596)和E2>11 129.63 pmol/L组(B组,n=597);再依据取卵至授精时间细分为卵母细胞孵育时间≤3 h组(A1组和B1组)和卵母细胞孵育时间>3 h组(A2组和B2组)两个亚组。因而总共分为A1(n=277)、A2(n=319)、B1(n=320)、B2(n=277)4个组进行分析。
4组患者间女方年龄、BMI、基础FSH水平和HCG日子宫内膜厚度均无显著性差异(P>0.05);A1、A2两组HCG日E2和孕酮(P)水平显著低于B1、B2组(P<0.05),但A、B组内亚组间比较无显著差异(P>0.05)(表1)。
二、患者体外受精/新鲜胚胎移植结局比较
1.受精及胚胎培养结局:A组(A1、A2)获卵数显著低于B组(B1、B2)(P<0.05),可移植胚胎率显著高于B组(B1、B2)(P<0.05),而同组亚组间(A1 vs. A2,B1 vs. B2)比较均无显著差异(P>0.05)。4组患者间正常受精率、多PN受精率和囊胚形成率均无显著差异(P>0.05)。A1、B1组较A2、B2组精卵共孵育时间显著延长(P<0.05);B2组优质胚胎率显著高于B1组(P<0.05),A2组优质胚胎率较A1组有增高趋势(25.85% vs. 23.99%),但差异无统计学意义(P>0.05)(表2)。

表1 患者基础资料比较(-±s)

表2 患者体外受精及胚胎培养结局比较[(-±s),%]
2.新鲜胚胎移植周期结局:4组间移植胚胎数、囊胚占比、临床妊娠率和流产率均无显著差异(P>0.05);A1组胚胎种植率显著低于其他3组(P<0.05),A2组临床妊娠率相对于A1组有增高趋势但无显著差异(63.32% vs. 57.40%,P>0.05);B1与B2组间临床妊娠率和种植均无显著差异(P>0.05)(表3)。

表3 患者新鲜胚胎移植周期结局比较[(-±s),%]
三、卵母细胞孵育时间和精卵共孵育时间与短时受精胚胎结局的相关性
采用Pearson相关性分析,结果显示:随着卵母细胞孵育时间的增加,精卵共孵育时间显著缩短(R=-0.318,P<0.001);卵母细胞孵育时间和精卵共孵育时间与正常受精率、囊胚形成率和可移植胚胎率无显著相关性(P>0.05);卵母细胞孵育时间与多PN率呈显著负相关(R=-0.006,P=0.008);精卵共孵育时间与优质胚胎率呈显著负相关(R=-0.057,P=0.012)(表4)。
四、卵母细胞孵育时间和精卵共孵育时间对短时受精临床结局的影响
采用二元Logistics回归排除了女方年龄、BMI、子宫内膜厚度、获卵数、移植囊胚占比和胚胎移植个数的影响。结果显示,2 060例患者行短时受精助孕,其中短时受精失败行早期补救ICSI 119例,卵母细胞孵育时间和精卵共孵育时间对于短时受精是否失败均非独立影响因素(P>0.05);1 193例行短时受精新鲜周期移植的患者中,卵母细胞孵育时间与精卵共孵育时间对新鲜周期移植的临床妊娠率、种植率和流产率均非独立影响因素(P>0.05)(表5)。
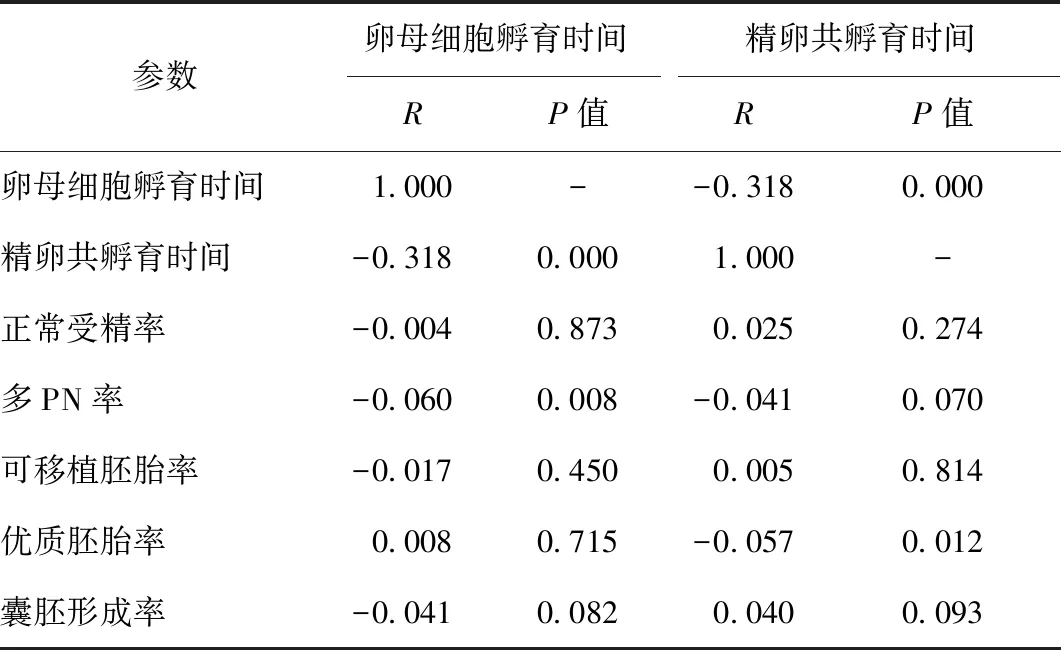
表4 卵母细胞孵育时间、精卵共孵育时间与短时受精胚胎结局的相关性分析

表5 卵母细胞孵育时间、精卵共孵育时间对短时受精临床结局的二分类Logistic回归分析
讨 论
体外受精通常采用长受精,精卵共孵育18~20 h,但发生完全不受精比例为4%~16%[12],而在不明原因不孕的患者中,这一比例甚至高达25%[13]。短时受精缩短精卵共孵育时间为1~6 h,联合补救ICSI成为预防完全受精失败和受精率低的有效方法[14]。很多研究表明短时受精可提高卵母细胞利用率和胚胎种植率,人类自然生理条件不会出现高浓度精子与卵母细胞共同孵育情况,短时受精缩短了高浓度精子对卵母细胞作用,更接近生理状态。因此,短时受精已被广泛应用于体外受精-胚胎移植技术中[3-4]。
受精前卵母细胞孵育时间对IVF-ET结局的影响存在争义,增加受精前卵母细胞孵育时间有利于卵母细胞质成熟,核质同步成熟是卵子受精和优质胚胎获得的有力保障。蔡慧中等[15]发现在注射HCG后38~42 h范围内授精,授精时机在41~42 h时优质胚胎率和可利用胚胎率最高,并且可获得较好的临床妊娠率,但卵母细胞体外孵育时间过长可引起卵母细胞的老化,且培养基中代谢废物的积累均可导致非整倍体概率的增加[16-17],错过最佳受精时机。本研究显示注射HCG后38~40 h授精,随着卵母细胞孵育时间的增加,多原核受精明显降低,但正常受精率、囊胚形成率、优质囊胚形成率和可移植胚胎率没有显著变化。卵母细胞孵育时间3~4 h和精卵共孵育时间1~6 h的条件下,授精时机不影响短时受精失败,同时对临床妊娠率、种植率和流产率也没有明显的影响。
然而调整授精前后孵育时间可能改善特定人群助孕结局。近年有研究报道适当延长卵母细胞体外培养时间[HCG注射后(41±1)h授精]是高龄卵巢低反应患者获得优质胚胎的一种简单有效的方法[18],Le Bras等[19]就证实缩短精卵共孵育时间可以改善胚胎碎片多患者的胚胎质量。考虑到雌激素水平可能是反映卵母细胞成熟度的有效指标[20],本研究根据HCG注射日雌激素水平的中位数将新鲜周期移植患者二分类为低E2组(E2≤11 129.63 pmol/L,A组)和高E2组(E2>11 129.63 pmol/L,B组),再根据取卵至授精时长分为短卵母细胞孵育时间组(≤3 h,A1组和B1组)和长时间卵母细胞孵育时间组(>3 h,A2组和B2组),探讨扳机日不同血清雌激素水平时授精前后孵育时间对IVF-ET妊娠结局的影响。A组获卵数、HCG日E2和P水平显著低于B组,但A、B组内亚组间比较无显著差异(P>0.05),因此,A1与A2以及B1与B2的胚胎结局和妊娠结局有一定的可比性。B2组优质胚胎率显著高于B1组(P<0.05),A2组优质胚胎率较A1组有增高趋势,但差异没有统计学意义(P>0.05)。HCG日E2水平较低时A2组的种植率显著高于A1组(P<0.05);HCG日E2水平较高时B1和B2两组种植率没有显著差异。因此,注射HCG日E2水平较低时增加卵母细胞孵育时间降低精卵共孵育时间,可能获得较好的IVF-ET结局。
减少了精卵共孵育时间是否影响卵母细胞受精率是胚胎技术人员最关心的问题,多数研究表明缩短精卵共孵育时间并不影响受精率。中国专家共识建议短时受精加精时间为HCG注射后38~40 h,精卵共孵育时间1~6 h受精率和胚胎结局较为理想[6]。本研究纳入病例的受精时间和精卵共孵育时间均在专家共识建议范围内。取卵时间和脱颗粒细胞时间相对固定的情况下,授精时机影响取卵后卵母细胞孵育时间和精卵共孵育时间。本研究显示随着卵母细胞孵育时间的延长,精卵共孵育时间(R=-0.318,P=0.000)显著缩短。理想条件下,哺乳动物性交后20 min内可使卵母细胞受精[21],荧光标记的精子与正常卵冠丘复合体共孵育15 min进入卵丘,3 h内穿过卵丘层,4 h出现在卵母细胞皮层,且精卵共孵育时间16 h比1 h多精受精率高,这表明缩短精卵共孵育时间到1 h不影响卵母细胞受精[22]。这与我们的研究结果相似,在1~6 h内,精卵共孵育时间与短时受精失败没有显著相关性,但男方精液质量、加精浓度和操作流程均可能影响受精率,不同生殖中心可能有不一样的结果。早期大量研究表明短时受精缩短了高浓度精子对卵母细胞作用,更接近生理状态。常规体外受精时较短时受精时具有较高浓度的活性氧(reactive oxygen species,ROS)[23],颗粒细胞持续分泌E2及 P[24],高水平E2对胚胎有毒性作用,缩短精卵共孵育时间可降低ROS,较早去除大量颗粒细胞可以降低ROS和E2等对胚胎的不利因素。在短时受精中精卵共孵育时间是否对胚胎发育潜能有影响,目前没有报道。我们的数据显示,精卵共孵育时间1~6 h范围内,随着精卵共孵育时间增加优质胚胎率显著降低(R=-0.057,P=0.012)。短时受精中降低精卵共孵育时间可能通过降低大量精子产生的ROS对胚胎发育潜能的负面影响,提高优质胚胎率。这可能是本研究中HCG日E2水平较低时A2组胚胎种植率显著高于A1组的原因,而HCG日高E2组具有较高的获卵数,新鲜周期可以获得较多优质胚胎用于移植,B1和B2组的首次移植周期胚胎种植率没有显著差异。
综上所述,随着卵母细胞孵育时间的延长,精卵共孵育时间显著缩短;卵母细胞孵育时间3~4 h和精卵共孵育时间1~6 h的条件下,随着卵母细胞孵育时间的增加多原核受精率降低,精卵共孵育时间的增加不利于优质胚胎的形成;授精前后孵育时间非影响短时受精失败、临床妊娠率、种植率和流产率的独立影响因素。但若注射HCG日E2水平≤11 129.63 pmol/L,建议增加卵母细胞孵育时间降低精卵共孵育时间,可能获得较好的胚胎种植率。调整授精时机,适当延长卵母细胞孵育时间降低精卵共孵育时间的策略是否能够改善IVT-ET的结局有待进一步前瞻性随机对照研究,期望为IVF-ET精细化治疗提供参考。

