甜菜全基因组SSR引物的筛选与评价
李乔乔,王宇晴,刘 蕊,刘乃新,邳 植,吴则东
(1黑龙江大学现代农业与生态环境学院,哈尔滨 150080;2黑龙江省普通高校甜菜遗传育种重点实验室/黑龙江大学,哈尔滨 150080;3黑龙江种业技术服务中心,哈尔滨 150008)
0 引言
甜菜为苋科、甜菜属,二年生草本植物,原产于欧洲西部和南部沿海。1906年,糖用甜菜引入中国,主要在新疆、黑龙江以及内蒙古等地种植。甜菜是除甘蔗外的主要糖源,其产糖量约占世界总糖量的25%[1]。除生产蔗糖外,甜菜及其副产品也具有广泛的开发利用前景。中国甜菜作为重要的糖料作物,其育种工作仍远远落后于德国、美国、法国以及荷兰等国。在中国甜菜产业中,用于机械化精量播种的遗传单粒种子基本依靠进口,对外依存度在95%以上。为了促进甜菜分子生物学的发展,可以利用分子标记技术,寻找合适的引物,这对甜菜遗传图谱和指纹图谱的构建、遗传多样性的鉴定等分子标记辅助育种具有重要意义[2]。缺乏理想的分子标记工具和基因组资源是阻碍甜菜遗传研究和分子育种发展的重要因素。
近年来,基因组学不断发展,利用分子标记分析种质资源遗传多样性和亲缘关系已经在多种重要作物上广泛开展[3]。另外也有多种分子标记,如AFLP[4]、SRAP[5]、RAPD[6]、SSR[7]、ISSR[8]、SNP[9]以及 SCoT[10]等应用于遗传多样性分析,在众多类型的分子标记中,SSR因其相对丰富、重复性好、多态性高、共显性遗传模式和在基因组中的随机分布而成为应用最广泛的作为遗传图谱、基因作图和标记辅助选择的工具。SSR标记是近年来发展起来的一种以特异引物PCR为基础的分子标记技术,也称为微卫星DNA(Microsatellite DNA),是一类由几个核苷酸(一般为1~6个)为重复单位组成的长达几十个核苷酸的串联重复序列。每个SSR两侧的序列一般是相对保守的单拷贝序列,因此可以通过SSR两端序列设计特异引物开发分子标记引物。开发并筛选一系列稳定性好,多态性高的通用SSR核心引物,对于鉴定甜菜种质资源、分析遗传多样性、检测品种纯度及真实性、构建品种DNA指纹数据库等均具有重要的价值[11]。
李艳等[12]利用4份不同的辣椒资源对152对SSR引物进行筛选,最终选出14对条带清晰、稳定性好的引物,并利用这14对引物将26份辣椒资源按照遗传多样性分为7类;此前也有学者曾经对甜菜的SSR引物进行筛选,吴则东等[13]利用16个甜菜品种从200对SSR引物中进行筛选,从中筛选出24对核心引物,并将16个甜菜品种分为3类;赵尚敏等[14]从91对SSR引物中仅筛选出7对条带清晰的引物。此次基于前人研究基础上,进一步利用甜菜基因组数据库,筛选多态性高的SSR引物,为后期甜菜的遗传多样性和指纹图谱建立等分析提供支持。
1 材料与方法
1.1 材料
1.1.1 实验材料 实验所用的材料为4个甜菜种质资源以及4个甜菜品种,引物在群体间的多态性验证选取M206的50份不同的DNA进行。材料名称、编号及来源见表1。
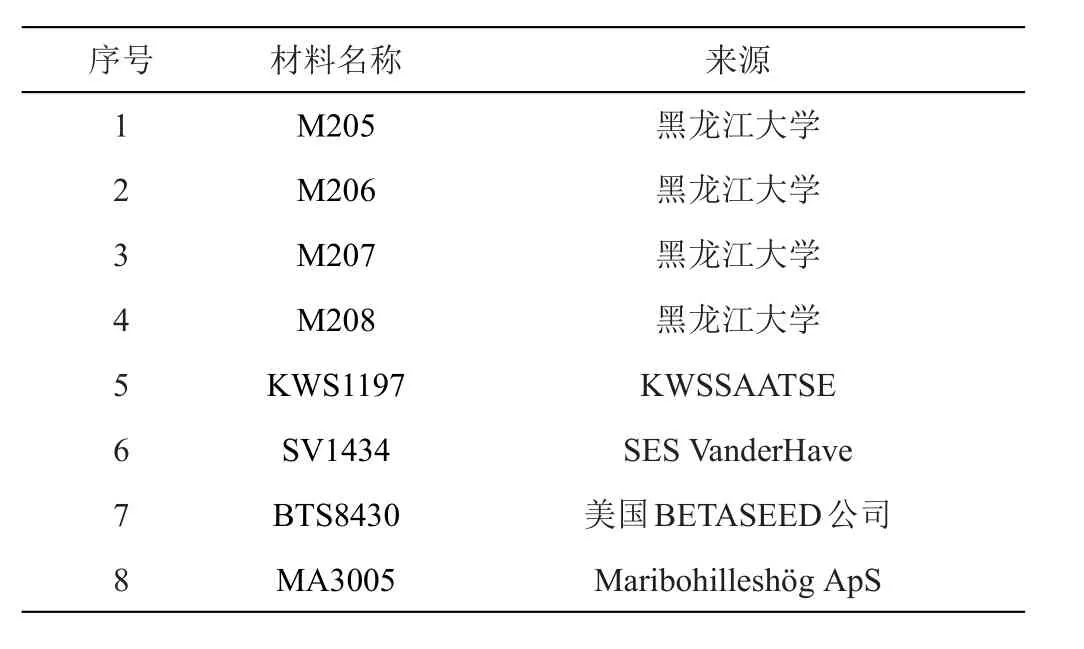
表1 实验材料及来源
1.1.2 主要试剂及仪器 纯净水、DNA模板、琼脂糖粉、10×TBE、40% PA、AP、TEMED、0.5×TBE、红色荧光核酸染料、2×Rapid Tap Master Mix。主要仪器有稳压稳流电泳仪(DYY-8B型)、DYCZ-30C型电泳槽以及eppendorf PCR仪。
1.1.3 引物合成与稀释 早期的SSR引物主要是从基因组库和微卫星库中开发出来的,开发成本高,时间也长。随着高通量测序技术的不断发展,可以一次测定数十万至数百万个DNA分子的序列[11]。本次SSR引物的开发大部分基于甜菜全基因组序列,使用perl脚本Micro SAtellite(MISA)在甜菜基因组中检索SSR[15],并将碱基长度定义为默认核苷酸长的基准。识别标准为:单核苷酸重复次数≥8次;二核苷酸、三核苷酸、四核苷酸、五核苷酸和六核苷酸,重复序列的数目都大于5[16]。使用primer3_core程序,根据识别的SSR的侧翼序列来设计引物对[17-18]。引物的设计参数为:引物长度为18~27个核苷酸,退火温度为55~65℃,GC含量为30%~70%,预测PCR产物长度为100~500 bp。然后再与之前筛过的引物进行比较分析,利用电子PCR进行扩增,最终确定了使用的引物。本次实验共计设计247对引物。引物由上海生工生物工程有限公司进行合成。
引物合成后,将干粉状的引物按照合成单中参数进行溶解稀释,取相同摩尔数的上下游引物混合在一起,作好标记后,均置于-20℃保存以备使用[19]。
1.2 实验方法
1.2.1 DNA模板制备 供试材料采用CTAB法提取DNA,并稀释到10 ng/μL置于4℃冰箱保存备用。
1.2.2 PCR反应的体系和程序 PCR扩增反应在PCR扩增仪上进行,反应总体积为5 μL,其中,PCR-Mix 2.5 μL、10 μmol/L的SSR引物共0.4 μL,DNA模板1 μL,最后用纯净水补至5 μL。
扩增程序为94℃模板DNA预变性3 min,1个循环;95℃模板DNA变性15 s,固定退火温度58℃引物与模板靶位点结合15 s,72℃引物沿模板延伸30 s,共32个循环;最后72℃延伸5 min;4℃保存。还有一种采用Touch down程序,退火温度65℃一直降到56℃,每度使引物与模板靶位点结合15 s,72℃引物沿模板延伸30 s,每降1℃2个循环,最后降至55℃设20个循环。由于引物只有在最佳的退火温度下才能表现出真实的扩增条带,故针对不同的引物使用了不同的PCR退火温度。具体引物所用退火温度见表2。
1.2.3 PCR产物检测 利用8%的非变性聚丙烯酰胺凝胶电泳对PCR产物进行分离[20],电泳结束后,将凝胶放入核酸染料中,均匀晃动3~5 min,然后将凝胶取出放入凝胶成像仪查看,拍照保存以便进行后续数据分析。
1.3 数据分析
根据SSR扩增产物在电泳凝胶上的相对位置,确定不同的等位基因,按照分子量从大到小的顺序进行记录,在同一位置上,有带记为“1”,无带记为“0”,根据记录结果统计多态性条带数,并计算引物多态性信息量(PIC),其计算方法见公式(1)。

其中Pi为第i个等位基因出现的频率。
2 结果与分析
2.1 SSR引物筛选及扩增结果
利用8份供试材料对247对SSR引物进行扩增,最终从247对引物中筛选出27对具有多态性的引物。这27对SSR引物在8份材料中共扩增出103个条带,其中多态性条带95条,多态性比率为90.43%,单个引物扩增总条带最多的为6条,最少的为2条,单个引物扩增有多态性的条带最多6条,最少2条。多态性信息量(PIC)范围为0.549~0.983,平均每一对引物的PIC值为0.841。其中W12的PIC值最高为0.983。说明筛选出的引物多态性较高。筛选的引物名称、多态性条带数、扩增总条带数、多态性百分比以及所在的染色体以及多态性信息量(PIC)见表2。
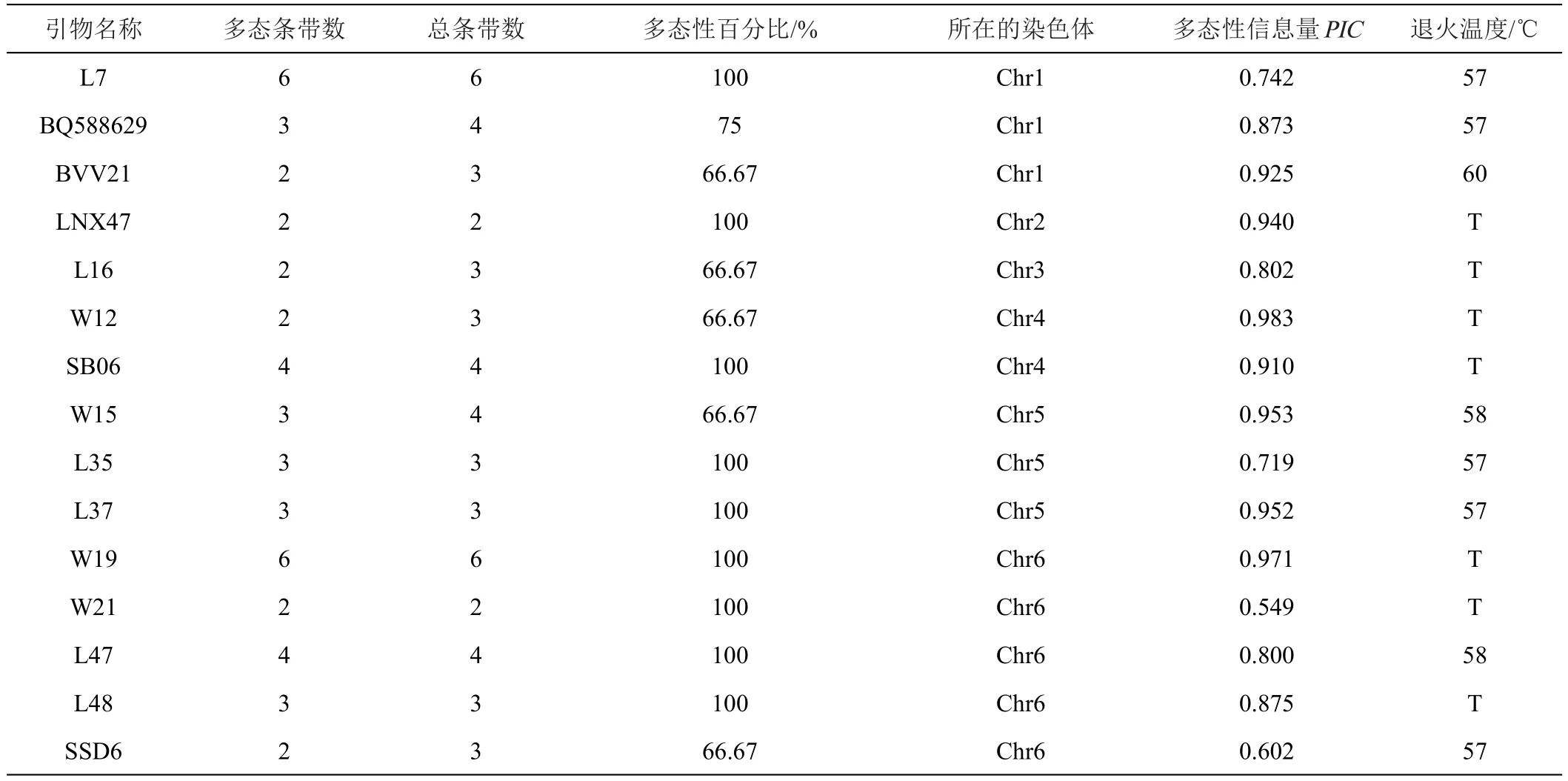
表2 筛选出的甜菜SSR引物及多态性信息
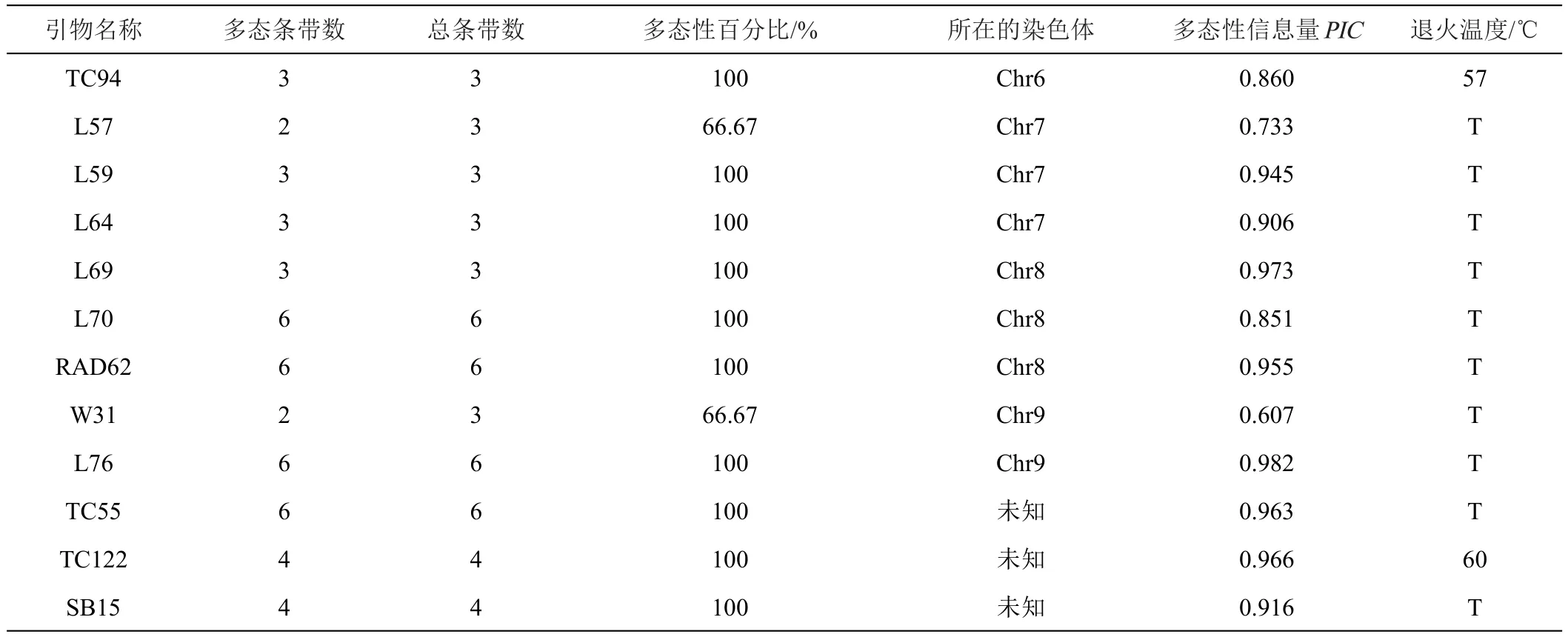
续表2
2.2 引物多态性分析验证
在27对引物中挑选一对扩增条带清晰,多态性高的引物L48在M206甜菜群体的50份DNA中进行PCR扩增,以验证SSR引物在群体间存在稳定的多态性。本研究中选取M206甜菜群体单株对L48引物进行验证,L48在50份DNA中共扩增出3条带,均为多态性带,多态性百分率为100%。可见SSR引物在甜菜群体间存在着稳定的多态性,为将来SSR引物在甜菜分子生物学上的应用打下良好的基础。图1为引物L48对M206群体的50个甜菜DNA的扩增图。
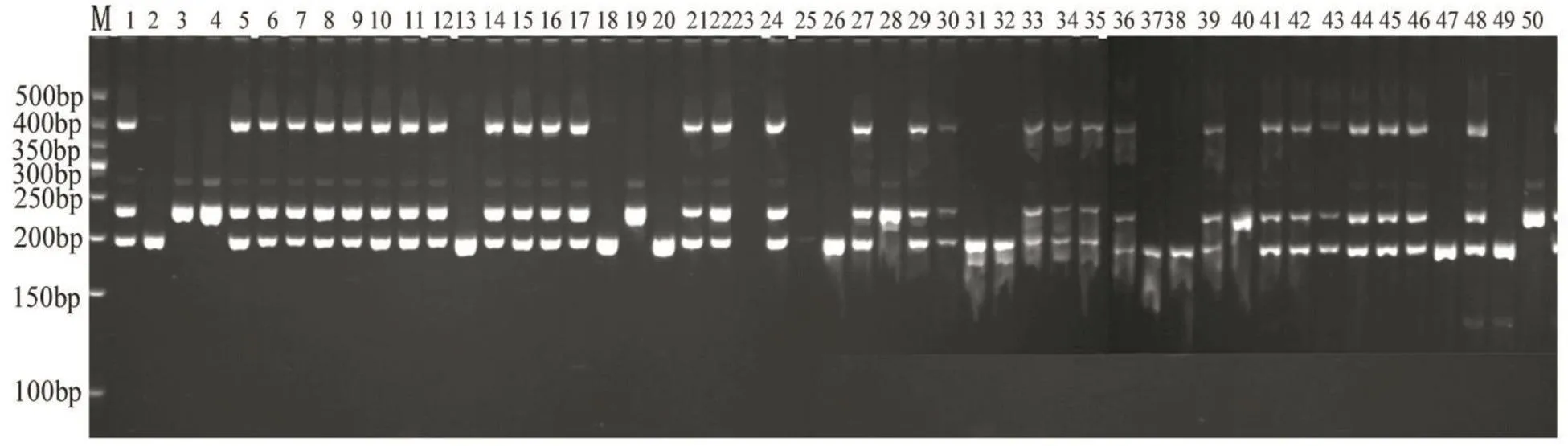
图1 L48对M206的50份甜菜DNA的PCR扩增图
3 结论与讨论
由于中国并不是甜菜的起源国,目前所拥有的甜菜种质资源大部分都来自国外,而且严重缺乏野生资源以及单胚资源,现存的这些种质资源之间的亲缘关系较近。开展有针对性的资源收集、评价和开发利用显得十分必要,而利用分子标记技术开展分子水平研究具有重要意义[21]。利用SSR分子标记技术进行甜菜指纹图谱构建及遗传多样性分析,至关重要的是要筛选一套优良的SSR引物[22]。
本研究从大量引物中仅筛选出少量的具有多态性的引物,与大多引物筛选的试验结果相似,说明甜菜核心SSR引物筛选依旧困难。但本文基于甜菜全基因组序列设计引物,同时先利用电子PCR进行分析,保证甜菜的每条染色体上都有核心引物可供后续遗传分析。为了保证筛选出的SSR引物具有高效稳定的多态性,就要充分考虑具有代表性的遗传物质来源。本实验采用的是来自国外与国内各4份甜菜材料,最终得到的27对优秀的SSR引物,但少量的筛选材料并不足以代表一个物种的基因多样性[23],因此最终优秀的SSR引物的确定,还需要尽量多的甜菜品种进行验证,才能保证最终的引物筛选能够对甜菜种质资源进行准确的遗传多样性分析。本研究丰富了中国甜菜种质资源SSR分子标记的研究,为中国甜菜种质资源的遗传多样性分析及甜菜品种鉴别提供了新的分子标记工具,但本研究所获得的多态性引物数目较有限,有待进一步挖掘与探讨。
本研究通过8份甜菜材料对247对甜菜SSR引物进行筛选,从中筛选出27对可以用于甜菜分子标记利用的多态性引物。这27对引物共扩增出条带103条,其中多态性条带95条,多态性比率为90.43%,多态性信息量(PIC)范围为0.549~0.983,平均每一对引物的PIC值为0.841。为了验证引物在群体间的多态性,选取M206的50份不同的DNA对引物进行PCR扩增,扩增总条带数为3,均为多态性带,多态性百分率为100%。本研究开发的全基因组SSR标记将为甜菜分子标记分析、连锁图谱构建、QTL定位和分子育种提供有效的分子标记工具。

