低温胁迫对甜菜抗氧化系统的影响
孙佳平,张福顺,邳 植,周 芹
(1黑龙江大学中俄联合研究生院,哈尔滨 150080;2黑龙江大学生命科学学院黑龙江省寒地生态修复与资源利用重点实验室,哈尔滨 150080;3黑龙江大学现代农业与生态环境学院,哈尔滨 150080;4农业农村部甜菜品质监督检验测试中心,哈尔滨 150080)
0 引言
甜菜(Beta vulgaris L.)属苋科,甜菜属,二年生草本植物,别名菾菜、红菾菜[1]。甜菜具有耐寒、耐旱、耐盐碱等特点,是一种适应性广、抗逆性强的作物[2]。甜菜是一种经济作物,在糖业生产中占有重要作用,是世界乃至中国重要的糖料作物之一,甜菜制糖的产量约占世界食用糖总产量的20%,约占中国食用糖总产量的10%~20%[3-4]。甜菜在国民经济生产中占有重要的地位,除用于制糖外,甜菜制糖的副产品也具有较高的综合利用价值。甜菜属于北方冷凉作物,能够生长在气温较低的高纬度地区[5]。甜菜适宜生长的温度范围大约是17~25℃,世界主要甜菜栽培区位于45°N附近的气候温和地区。在甜菜种植生产的过程中,不同类型以及不同程度的逆境胁迫,都会对甜菜的生长发育带来不利的影响。低温胁迫对农作物影响尤为严重,已成为世界各国农作物栽培中普遍存在的问题[6-8]。尤其全球温室效应愈发严重,引起自然环境恶化,极冷天气极易产生,对甜菜种子萌发期、幼苗期乃至生长期都会产生不利的影响,受到的低温伤害可能影响植物后续的生长发育,进而影响甜菜的产质量[9],限制中国甜菜产业稳步发展[10-11],因此,研究甜菜低温冷害具有必要性和时效性。植物在非胁迫状态下,体内ROS的产生与释放是属于一个动态平衡的状态,不会对植物体的新陈代谢产生影响。当受到低温胁迫时,植物体内的这种平衡被打破,导致ROS的大量积累,ROS的特点是具有极强的氧化性,导致细胞膜发生膜脂过氧化反应,从而使细胞受到破坏[12]。
丙二醛属于细胞膜脂过氧化的分解产物,可表示植物受损害的程度,因此植物丙二醛含量是反映植物对低温胁迫耐受能力的主要生理指标[13]。低温胁迫下,植株受到逆境影响,会启动一系列响应机制来应对低温环境[14]。植物体内的抗氧化系统分为酶促防御系统和非酶促防御系统,在酶促防御系统中,SOD、POD、APX、CAT是研究最多的几种酶,这4种酶被称为细胞保护酶系统[15],其活性的强弱可反映植物的抗寒能力。抗氧化酶在植株应答低温胁迫中起着重要作用,植物通过增加抗氧化酶的活性来清除ROS的积累防止细胞膜脂过氧化,保护细胞膜系统,因此抗氧化酶的活性可以作为衡量植物抗逆性的重要指标[16-17]。低温胁迫下玉米、茶树以及烟草的抗氧化系统的变化研究的较多,目前低温胁迫对甜菜的研究虽有报道,但是国内的科学研究者对低温胁迫甜菜生理生化响应的研究却很少,有待进一步研究[18-20],因此,本文以甜菜品种‘KWS9147’为实验材料,测定低温胁迫下(4℃)甜菜幼苗中MDA含量和抗氧化系统酶(T-AOC、SOD、POD、APX、CAT)活性的变化,探讨甜菜抵在低温胁迫下生理指标的变化及响应低温胁迫的生理机制,完善甜菜抗寒生理机制,并为其他植物抗寒机制提供理论依据,对提高甜菜产质量具有重要意义[21-23]。
1 材料与方法
1.1 实验材料
实验所用甜菜品种为‘KWS9147’,购自德国KWS种子股份有限公司。
实验在黑龙江大学现代农业与生态环境学院甜菜品质监督检验测试中心一楼光照培养室,于2021年3月—4月进行。
1.2 实验设计
该实验采用水培方式,甜菜种子从播种到可供实验处理共分为以下3个阶段。
发芽:选取籽粒饱满、均匀一致的甜菜种子播种于灭菌消毒的蛭石基质的塑料盆中(规格为长20 cm、宽14 cm、高7 cm),放入光照培养室培养一周,等待其长出两片子叶。
移苗:挑选出生长均匀且无病害的甜菜幼苗用蒸馏水反复洗净后移入带有圆孔的泡沫板上(每板8孔,每孔两株),在黑色避光玻璃槽(规格为长36 cm、宽14.5 cm、高15 cm)用1倍的营养液进行培养,通入空气。
间苗:为保证幼苗有足够的生长空间与营养面积,待其长出两片真叶后,拔除生长柔弱、畸形的苗,留下大小一致、优良的甜菜幼苗继续水培,每孔仅保留一株,以促进幼苗健壮生长。
在水培第10天和第20天换一次营养液,保证植物汲取到足够的养分,期间进行正常的苗期管理。从移苗开始将甜菜幼苗置于光照培养室培养21天后,选取大小一致、生长正常健硕、无病虫害的甜菜放入人工气候培养箱中,设置3个重复,每个重复8株,进行低温胁迫处理。
实验设置由风冷低温培养箱进行4℃低温胁迫处理(L),以光照培养室中正常生长的甜菜幼苗为对照(CK)。培养室温度设置为昼25℃,夜20℃;光周期为昼14 h,夜10 h;光照强度为140 μmol/(m2·s)。在低温胁迫1天后,室温生长幼苗和低温胁迫幼苗同时取样,采集生长部位相同的成熟叶片剪碎,用电子天平精确称取0.10 g,用锡纸包好样品放入液氮中进行速冻处理,后转移入-80℃冰箱进行超低温保存,用于后续生理生化指标的测定,每个处理3次重复。
1.3 指标测定及方法
1.3.1 MDA含量的测定 MDA用鲜样测量,采用硫代巴比妥酸法,参考Heath的方法进行测定[24],结果以μmol/g FW来表示。
1.3.2 抗氧化能力指标的测定 T-AOC[25]、SOD[26-27]、POD[28-29]、APX[30-31]、CAT[32-33]的测定,采用北京索莱宝科技有限公司测定试剂盒,用紫外分光光度法进行测量,所有指标均3次重复,实际操作步骤可以参照试剂盒内的说明书,各种酶活性均以U/g FW来表示。
1.4 数据处理
所有实验数据采用测定的平均值表示,借助Microsoft Excel 2010软件进行实验数据的整理、统计与图表制作,借助IBM SPSS Statistics 26软件对实验数据采用独立样本T检验,采用最小显著差异法(LSD)进行显著性检验,检验低温处理前后各生理指标是否存在显著差异,P<0.05代表差异显著。
2 结果与分析
2.1 低温胁迫对甜菜植株表型的影响
低温胁迫会引起植物形态发生一定的变化,不同的低温胁迫条件引起的变化有一定差异,低温胁迫的温度条件和时间条件都是引起这种差异的主要原因[34]。低温往往导致植物生长发育缓慢,受过低温胁迫的植株生长矮小,地上部位的变化研究较多,其中植物茎的高度、叶片的形状特征、叶片的颜色变化很为明显,地下部位(根系)的变化研究较少。叶柄是植物进行光合作用、输导和贮存营养物质的重要器官,在低温胁迫下,叶柄的生长发育受到影响,通常表现为株高降低,这也是植物为了应对低温条件预防叶柄结冰的一种应对策略[35-37]。叶片是甜菜直接暴露在空气中的器官,对温度的变化最为敏感,也是直接能体现温度对甜菜带来的影响,主要体现在叶片的形状上,低温使甜菜叶片中的细胞结构受到破坏,细胞受损,不能进行正常的新陈代谢,细胞缺水,表现为叶片萎蔫,卷曲,叶宽及叶长缩短[38]。同时,低温胁迫会抑制植物的光合作用,抑制叶绿素的形成,加快叶绿素的降解,从而使植物叶片变黄,具体见图1。4℃低温胁迫下,叶片轻度受害,叶柄由直立变成轻斜,叶片出现了由于缺水而导致轻微程度的萎蔫、卷曲,叶片大小无明显变化。

图1 低温胁迫对甜菜形态特征的影响
2.2 低温胁迫对甜菜叶片MDA含量的影响
MDA是细胞膜脂过氧化的最终产物[39],MDA的大量积累会损害细胞膜,使细胞膜的通透性增加,功能丧失。MDA作为细胞膜氧化受损的指标之一,在一定程度上可以反映植物在逆境胁迫下受损害的程度,其含量高低与植物抗寒性强弱呈负相关[40]。低温胁迫会使细胞膜脂发生过氧化反应,低温胁迫对甜菜叶片MDA含量的影响见图2,低温胁迫会使甜菜叶片中的MDA含量上升,L组与CK组相比,差异显著(P<0.05),低温胁迫1天后,MDA含量升高幅度达到31.32%。

图2 低温胁迫对甜菜叶片MDA含量的影响
2.3 低温胁迫对甜菜叶片T-AOC的影响
T-AOC是衡量抗氧化系统功能的综合指标。其大小可以代表抗氧化酶系统和非酶系统的性能,一般反映防御系统的抗氧化能力高低。测定T-AOC反映植物防御系统受低温的影响状况[41]。低温胁迫对甜菜叶片T-AOC的影响见图3,图3表明,低温胁迫会使甜菜叶片中的T-AOC上升,L组与CK组相比,差异显著(P<0.05),低温胁迫1天后,T-AOC升高幅度达到10.74%。
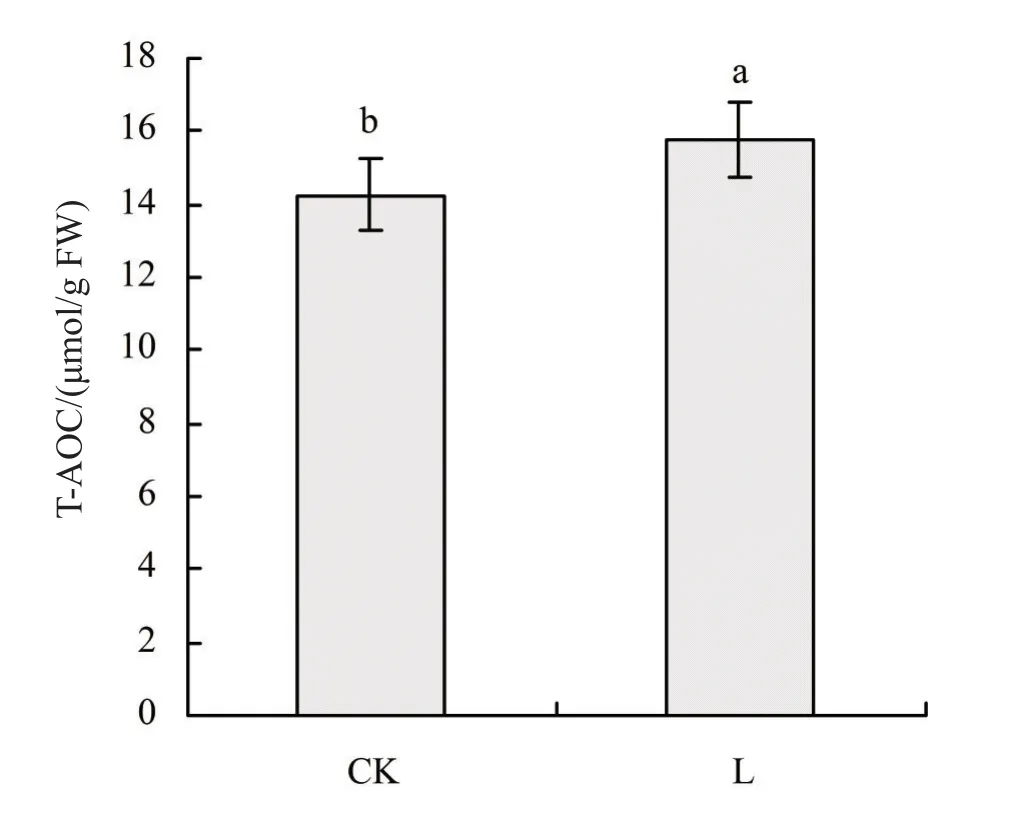
图3 低温胁迫对甜菜叶片T-AOC的影响
2.4 低温胁迫对甜菜叶片抗氧化酶活性的影响
在低温胁迫下,植物甜菜体内的抗氧化酶活性发生改变,这有助于植物清除ROS。SOD是一种在植物体内广泛分布的金属酶,是在逆境下,植物体内ROS的重要清除剂,可使ROS发生歧化作用,分解为H2O2和O2,对生物的抗氧化性起着重要的作用。低温胁迫对甜菜叶片中SOD的影响见图4B,低温胁迫使甜菜叶片中的SOD上升,L组与CK组相比,差异非常显著(P<0.05),低温胁迫1天后,SOD升高幅度达到4倍之多,在一定程度上可以消除或减少低温胁迫引起的活性氧自由基的积累,从而有效缓解甜菜的低温损伤。
POD可催化过氧化氢氧化酚类和胺类化合物,具有消除过氧化氢和酚类、胺类毒性的双重作用。低温胁迫对甜菜叶片中POD的影响见图4B,低温胁迫会使甜菜叶片中的POD上升,L组与CK组相比,差异也非常明显显著(P<0.05),低温胁迫1天后,POD升高幅度达到2.22倍。
APX催化H2O2氧化AsA,是植物AsA的主要消耗者。低温胁迫对甜菜叶片中的APX的影响见图4C,低温胁迫会使甜菜叶片中的APX上升,L组与CK组相比,差异显著(P<0.05),低温胁迫1天后,APX上升高幅度达到32.85%。
CAT是最主要的H2O2清除酶,在活性氧清除系统中具有重要作用。低温胁迫对甜菜叶片中CAT的影响见图4D,低温胁迫会使甜菜叶片中的CAT上升,L组与CK组相比,差异非常显著(P<0.05),低温胁迫1天后,CAT升高幅度达到2.56倍。


图4 低温胁迫对甜菜叶片4种抗氧化酶活性的影响
3 讨论
低温作为常见的非生物因素之一,能够影响植物超微结构、形态和生理,并且随着胁迫时间的延长,对植物的损害程度持续加深严重时能导致植物死亡[42]。植物在逆境下会产生复杂的生物化学和生理学上的响应,从微观到宏观,从细胞、分子、组织、器官甚至表型都会发生改变[43]。最直观的体现就是植物的表型变化,植物表型的变化有萎蔫、叶片发黄、叶面积减小,株高降低,这与付娟娟等[44]和胡倩等[45]在研究低温胁迫下其他植物表型的变化的研究结果一致。张珍珠等[46]研究发现,低温会干扰植物体内正常的生理代谢,影响细胞间水分的运输,细胞吸水能力降低,但蒸腾作用依然存在,当蒸腾大于吸水时,细胞失水,从而叶片出现萎蔫,卷曲的现象。舒必超等[47]研究发现,低温来临时,植物叶片中的气孔关闭,导致CO2吸入受阻,流通不足,从而使光合作用降低,光合作用是植物产生叶绿素的主要途径,叶绿素的合成受到抑制,从而导致叶片发黄。Körner[48]和Falster等[49]研究发现植物在逆境条件下,会通过改变自身的生长和形态特征如降低植株的高度、叶面积减少适应这种逆境条件,通过调整自身生物量的分配来维持逆境条件下植株的存活。
植物在正常的生长状况下,ROS的产出与分解属于动态平衡的状态,低温胁迫下导致ROS的大爆发,从而损害细胞膜,细胞膜发生膜脂过氧化反应,产生大量有害物质膜脂过氧化物分解产生MDA,作为一种过氧化产物,可表示植物细胞受损害的程度,MDA含量与植物抗逆性强弱呈负相关。
在低温胁迫过程中,植物有自己的一套活性氧清除系统,其中酶促防御系统起着重要的作用,酶促防御系统里面的抗氧化酶作为活性氧清除系统,能够清除植物体内的活性氧,使植物细胞和组织免受伤害。抗氧化酶主要包括SOD、POD、APX及CAT,SOD负责把O-2歧化成H2O2,而POD、CAT和APX在第二步起到了关键的作用,进一步将SOD歧化的H2O2分解为H2O和O2[50-51],从而缓解活性氧对细胞膜造成的伤害,减轻低温胁迫对植物的伤害。这4种酶的活性可反映其对ROS的清除能力。
低温胁迫下MDA和超氧阴离子的积累,对甜菜差生一定的毒害作用,从而启动了甜菜自身的抗氧化防御系统,T-AOC发生变化,SOD、POD、APX及CAT活性显著上升,以便清除有害物质,这与其美拉姆等[44]的研究结果一致。其中SOD的变化幅度最大,CAT和POD次之,APX变化幅度最小,不同的抗氧化酶的功能不同,其活性变化程度也不相同。我们可以推测出在抗氧化酶系统中,SOD发挥了主要的作用。
本研究对甜菜抗寒性生理机制变化进一步进行了补充。目前在低温胁迫下甜菜非酶促抗氧化系统变化研究的较少。低温胁迫下甜菜酶促抗氧化系统的变化的研究取得了一定的进展,但是还存在一些不足,主要体现在:对低温胁迫下甜菜酶促抗氧化系统的酶活性的变化仅仅停留在经验性研究中,对甜菜在低温胁迫下甜菜酶促抗氧化系统酶活性的变化机理性研究较少。以及抗氧化酶活性变化产生的具体原因尚不清楚。这都是我们应该注意的问题。在下一步的工作中,将继续研究非酶促抗氧化系统的变化,深入研究甜菜抗氧化酶系统各类酶变化产生的机制,投入到甜菜的具体生产实践中,为社会带来更高的经济效益。
甜菜是一种重要的经济作物,在在制糖产业中占有重要的地位,因此提高甜菜的产量和品质具有十分重要的意义。北方作为甜菜的主要种植区域,由于气候原因,低温是限制植物生长发育的最重要的环境因素,严重影响了甜菜的产量和品质,深入研究植物低温应答分子调控与代谢机制的基础,也将为提高植物耐低温特性和作物产量提供重要信息,以为植物抗逆性的研究提供参考。
4 结论
本实验研究了低温胁迫(4℃)甜菜品种‘KWS9147’的表型、细胞膜受损情况及抗氧化系统酶活性的变化。低温会影响作物表型的建成,表型变化主要体现在叶面积减小、叶片颜色变黄、株高降低及叶片出现轻微程度的萎蔫卷曲,植物通过表型的变化保护自身受到低温侵害。低温胁迫下,植物体内的自由基的产生和代谢的平衡遭到破坏,ROS大量积累,导致植物细胞膜系统受到伤害,从而使过氧化程度加深。本实验结果表明,在4℃低温胁迫下甜菜叶片的氧自由基的产生速率迅速增强、过氧化氢的积累量大幅增加,MDA含量升高了31.32%,这说明在4℃低温胁迫下甜菜叶片出现了轻微程度的氧化损伤。
甜菜的T-AOC显著上升了10.74%,其中里面的酶促防御系统发挥了积极主要的作用,来提高自身的抗寒性。SOD、POD、APX及CAT的含量分别增加了4倍、2.22倍、32.85%和2.56倍,随着有害物质的积累,SOD、POD、抗APX及CAT通过提高自身的活性来清除有害物质,保护细胞膜。

