板蓝根多糖促进NKG2D配体表达增强NK细胞对食管癌细胞的杀伤作用及机制研究
梁宗英 侯继申 孙光蕊 赵宝山 辛国华 (承德医学院附属医院胸外科,承德 067000)
食管癌是常见的消化系统异质性恶性肿瘤,确诊时多为晚期[1]。我国食管癌的发病和死亡例数均约占世界的50%[2]。手术和放化疗是食管癌的主要治疗方式,晚期患者主要采用放疗等方式治疗[3],中药联合治疗对提高患者生存质量具有较好的效果[4]。研究中药抑制和控制癌症的机制对食管癌的靶向治疗具有重要指导意义。
自然杀伤细胞(natural killer cell,NK cell)是机体重要的免疫细胞,与抗肿瘤、 抗病毒感染和免疫调节有关,在某些情况下参与超敏反应和自身免疫性疾病的发生。研究表明,板蓝根多糖(radix isatidis polysaccharides,RIP)能够刺激淋巴细胞转化,增强NK细胞的杀伤活性,对荷瘤小鼠具有抗肿瘤作用[5]。NKG2D(natural-killer group 2,member D) 特异的配体分子主要包括 MICA/B 和 ULBPs 两类,是 NKG2D 发挥杀伤活性的主要配体。NKG2D通过与肿瘤细胞表面相应配体MHCⅠ类相关蛋白A/B(MICA/B)或UL16结合蛋白(ULBP)的结合激活NK细胞[6,7]。上调肿瘤细胞表面NKG2D配体表达可增强NK细胞对其杀伤敏感性[8]。苦参碱可增强NK细胞对白血病K562细胞的体外杀伤活性,其机制可能与NK细胞受体及配体表达调节作用有关[9]。但RIP是否可以通过调控食管癌细胞表面NKG2D配体的表达增强NK细胞对食管癌细胞的杀伤作用目前还尚未可知。本研究以食管癌细胞株Eca-109和NK细胞系NK-92为研究对象,以RIP处理Eca-109和NK-92的方法来检测RIP在NK-92杀伤食管癌细胞Eca-109过程中的作用,并探寻其潜在作用机制。
1 材料与方法
1.1材料 食管癌细胞株Eca-109和NK细胞系NK-92(ATCC);RPMI1640培养基、MEM-EBSS培养基和胎牛血清(fetal bovine serum,FBS)、胰蛋白酶Trypsin(Gibco公司);RIP、钙黄绿素(acetoxymethy-lester of calcein,Calcein-AM)、碘化丙啶(PI)(Sigma-Aldrich公司);抗CD56免疫磁珠和抗PE免疫磁珠(德国Miltenyi Biotech公司);抗CyclinD1抗体、抗p21抗体、抗p27抗体、抗MICA抗体、抗MICB抗体、抗ULBP1抗体、抗ULBP2抗体和抗GAPDH抗体(美国BD公司);TNF-α和IFN-γ ELISA试剂盒(Invitrogen公司);总RNA提取试剂盒、Real-time PCR试剂盒、反转录试剂盒(RT-PCR)(美国Invitrogen公司);流式法细胞凋亡检测试剂盒、流式细胞仪(美国BD公司);光学显微镜、Real-time PCR仪(美国Bio-Rad公司);BCA浓度检测试剂盒(凯基生物)。
1.2方法
1.2.1细胞培养和药物处理
1.2.1.1细胞培养 将食管癌细胞Eca-109培养于含10 % FBS、1% 青-链霉素(青霉素100 U/ml、链霉素100 μg/ml)的RPMI1640培养基中,NK-92细胞培养于MEM-EBSS培养液中,分别于37℃、5% CO2、湿度95%的培养箱中培养,待细胞融合度达到80%~90%时,用Trypsin消化传代。
1.2.1.2药物处理 将无菌过滤的RIP以0 μg/ml、100 μg/ml、200 μg/ml和400 μg/ml的终浓度加入培养液中。取对数生长期细胞,以加入RIP的培养液稀释细胞,以1×106个/ml接种于96孔板,培养48 h,收集细胞,进行实验。
1.2.2NK-92细胞分选和纯度检测 收集NK-92细胞并计数,每1×107个细胞加入80 μl PBS缓冲液和20 μl抗CD56免疫磁珠,4℃孵育15 min,每1×107个细胞加入1 ml缓冲液,1 200 r/min离心10 min,弃上清,每1×108个细胞加入500 μl缓冲液混匀,磁场分离,收集流出的阴性细胞,500 μl缓冲液洗3次,用1 ml培养液收集阳性细胞,流式细胞仪检测NK-92细胞纯度,计算CD3-CD56+细胞所占百分比。
1.2.3MTT法检测细胞增殖抑制率 待NK-92和Eca-109细胞培养至对数生长期,稀释至1×105个/ml,取100 μl细胞接种于96孔板中,培养过夜,加入100 μl含RIP的培养液(使RIP终浓度为 0 μg/ml、100 μg/ml、200 μg/ml和400 μg/ml),培养48 h,每孔加入20 μl MTT溶液,培养4 h,弃上清培养液,加入150 μl DMSO,室温振荡10 min,酶标仪检测490 nm吸光度(A)值。按照如下公式计算抑制率(%)=(0 μg/ml组A均值-用药组A均值)/0 μg/ml组A均值×100%。
1.2.4ELISA检测TNF-α和IFN-γ的表达 将经RIP处理的各组NK-92和/或Eca-109细胞培养48 h,收集不同处理的细胞培养上清,按照TNF-α和IFN-γ ELISA试剂盒的说明书进行操作,检测培养上清中TNF-α和IFN-γ的水平(pg/mg),每组重复检测3次。
1.2.5流式细胞术测定食管癌细胞NKG2D配体表达 收集经RIP处理后各组Eca-109细胞,洗涤2次,计数,分管,用间接标记法检测Eca-109细胞中NKG2D配体的表达,加入流式抗体(抗MICA抗体、抗MICB抗体、抗ULBP1抗体、抗ULBP2抗体),4℃避光孵育30 min,PBS缓冲液洗涤细胞2次,加入FITC标记的羊抗鼠IgG1二抗,4℃避光孵育30 min,PBS缓冲液洗涤,以同型IgG1抗体为阴性对照,流式细胞仪分析细胞中阳性细胞数,计算百分率。
1.2.6Western blot检测蛋白表达 将培养48 h的各组Eca-109细胞进行收集,加入RIPA 裂解液,超声破碎,离心收集蛋白,测定总蛋白浓度。进行SDS-PAGE,蛋白转膜,脱脂奶粉封闭2 h,加入稀释的一抗(抗CyclinD1抗体1∶1 000、抗p21抗体1∶1 000、抗p27抗体1∶1 000和抗GAPDH抗体1∶1 000),4℃孵育过夜,PBST洗膜2次,加入稀释的二抗,室温孵育2 h,分析蛋白表达水平,以GAPDH 为内参照。
1.2.7NK-92细胞杀伤实验[8]采用钙黄绿素释放法检测NK-92细胞对食管癌细胞Eca-109的杀伤作用。用Calcein-AM处理NK-92细胞进行荧光标记,效靶比为10∶1,37℃孵育30 min,然后与100 μg/ml RIP处理的食管癌Eca-109细胞混合,酶标仪检测NK-92细胞对Eca-109细胞的杀伤作用,杀伤率=(FNK-92处理组-F自发释放)/(F总溶解-F自发释放)×100%,F代表荧光强度。
2 结果
2.1NK-92细胞纯度检测结果 流式细胞术结果显示:NK-92细胞分选前CD3-CD56+细胞纯度为(10.54±1.18)%,分选后纯度为(74.58±5.34)%,达到纯化的目的,见图1。
2.2RIP可促进NK-92细胞增殖 MTT实验结果显示,与RIP 0 μg/ml组相比,RIP 100 μg/ml组、RIP 200 μg/ml组和RIP 400 μg/ml组的NK-92细胞增殖率显著上升(P<0.05);与RIP 100 μg/ml组相比,RIP 200 μg/ml组和RIP 400 μg/ml组的NK-92细胞增殖率显著上升(P<0.05);与RIP 200 μg/ml组相比,RIP 400 μg/ml组的NK-92细胞增殖率均显著上升(P<0.05),见表1。说明RIP可促进NK-92细胞增殖。
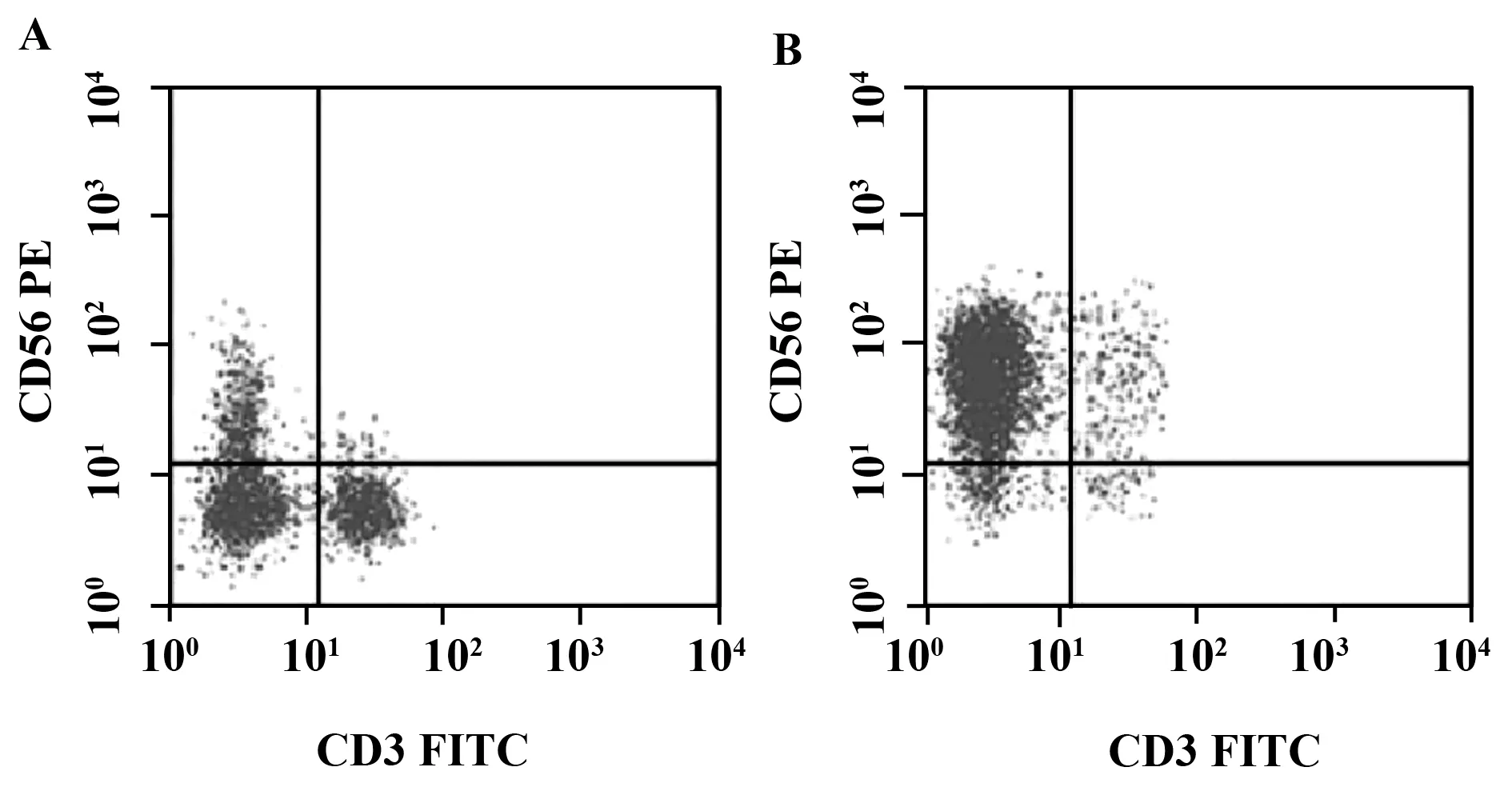
图1 分选前(A)和分选后(B)NK-92细胞的纯度检测Fig.1 NK-92 cell purities were tested before(A) and after(B) grading

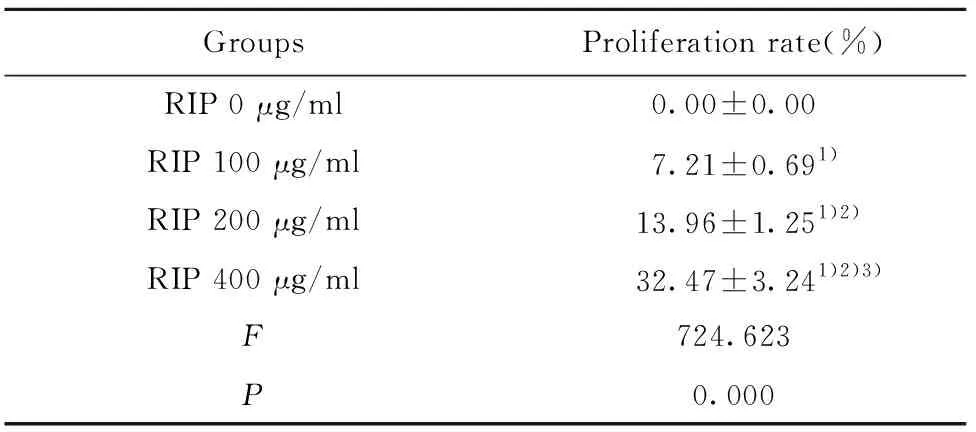
GroupsProliferation rate(%)RIP 0 μg/ml0.00±0.00RIP 100 μg/ml7.21±0.691)RIP 200 μg/ml13.96±1.251)2)RIP 400 μg/ml32.47±3.241)2)3)F724.623P0.000
Note:Compared with RIP 0 μg/ml group,1)P<0.05;compared with RIP 100 μg/ml group,2)P<0.05;compared with RIP 200 μg/ml group,3)P<0.05.
2.3RIP对食管癌Eca-109细胞增殖的影响 MTT和Western blot实验结果显示,与RIP 0 μg/ml组相比,RIP 100 μg/ml组、RIP 200 μg/ml组和RIP 400 μg/ml组的增殖相关蛋白Cyclin D1表达量呈显著下降趋势(P<0.05),p21和p27表达量呈显著增加趋势(P<0.05),细胞增殖抑制率呈显著上升趋势(P<0.05),具有显著的剂量依赖性,见图2和表2。说明RIP抑制食管癌Eca-109细胞增殖,且具有显著剂量依赖性。
2.4RIP对食管癌细胞中NKG2D配体表达的影响 流式细胞术结果表明,与RIP 0 μg/ml组相比,RIP 100 μg/ml、RIP 200 μg/ml和RIP 400 μg/ml组的NKG2D配体MICA、MICB、ULBP1和ULBP2表达呈显著升高趋势(P<0.05),且呈显著剂量依赖性,见表3。而与RIP 0 μg/ml组相比,RIP 400 μg/ml组处理下NKG2D配体MICA、MICB、ULBP1、ULPBP2表达差异最为显著,因此选用该浓度下的图片说明RIP的影响,见图3。表明RIP在食管癌细胞Eca-109中可促进NKG2D配体MICA、MICB、ULBP1和ULBP2的表达,增强NK-92对食管癌细胞的杀伤活性。
2.5RIP(100 μg/ml)对NK细胞中TNF-α和IFN-γ表达的影响 根据前述实验结果,选取100 μg/ml RIP进行后续实验。ELISA结果发现,与NK细胞组相比,NK细胞+食管癌细胞组、NK细胞+RIP组和NK细胞+RIP+食管癌细胞组NK细胞的TNF-α和IFN-γ表达量均显著上升(P<0.05);与NK细胞+食管癌细胞组和NK细胞+RIP组相比,NK细胞+RIP+食管癌细胞组NK细胞的TNF-α和IFN-γ表达量显著上升(P<0.05),见表4。说明食管癌可促进NK细胞中TNF-α和IFN-γ的表达, RIP可促进食管癌细胞联合作用后NK细胞中TNF-α和IFN-γ表达。
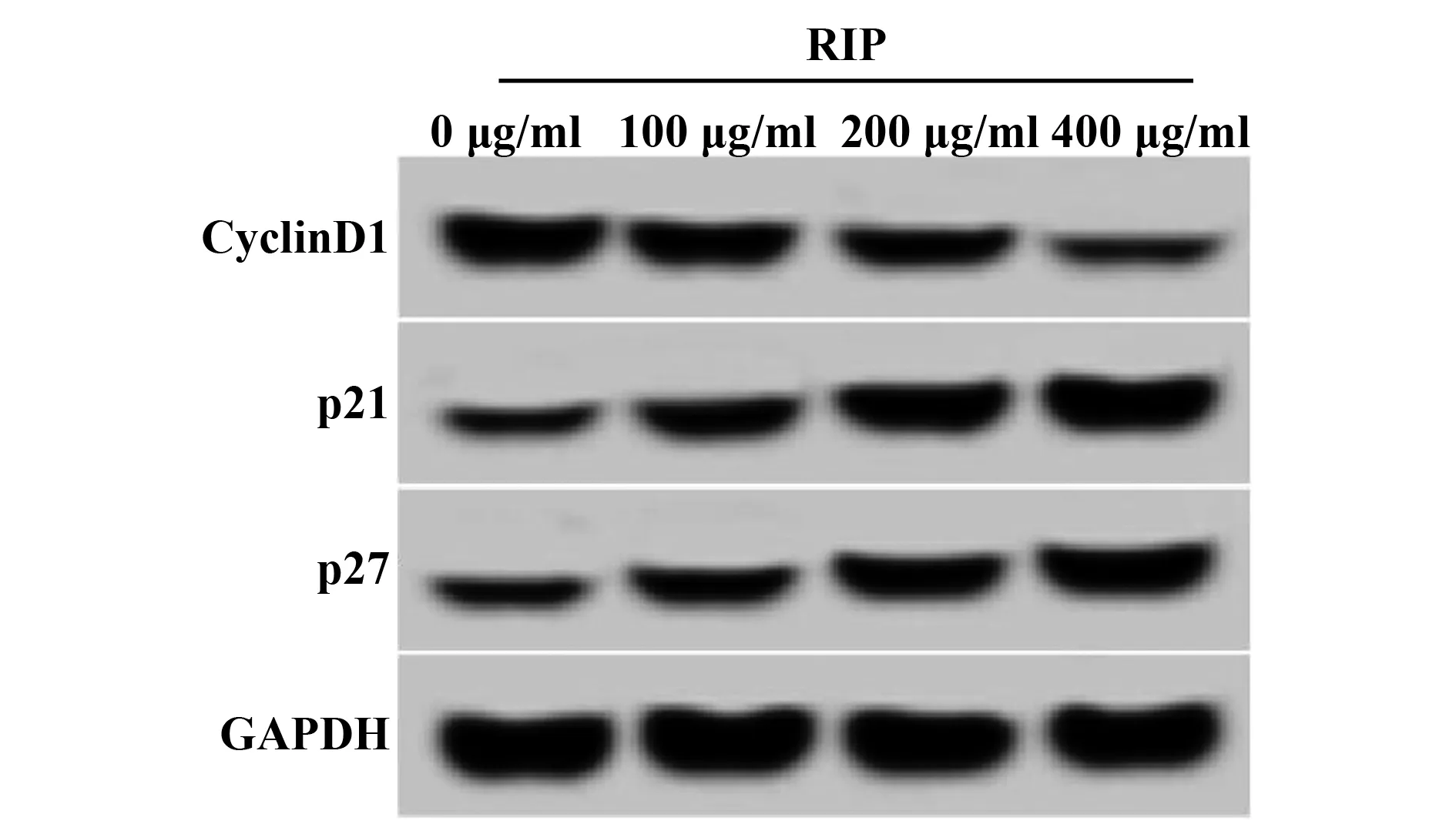
图2 食管癌Eca-109细胞中增殖相关蛋白表达Fig.2 Expression levels of proliferation-related proteins in Eca-109 cells

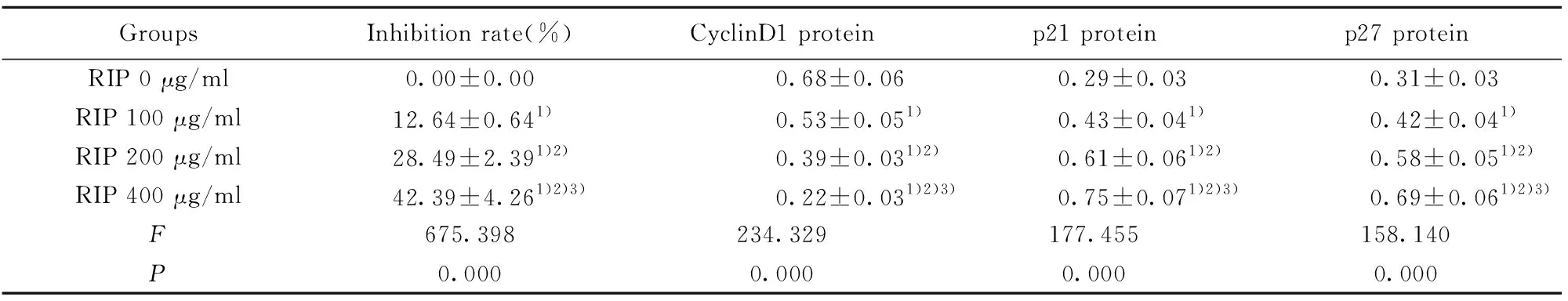
GroupsInhibition rate(%)CyclinD1 proteinp21 proteinp27 proteinRIP 0 μg/ml0.00±0.000.68±0.060.29±0.030.31±0.03RIP 100 μg/ml12.64±0.641)0.53±0.051)0.43±0.041)0.42±0.041)RIP 200 μg/ml28.49±2.391)2)0.39±0.031)2)0.61±0.061)2)0.58±0.051)2)RIP 400 μg/ml42.39±4.261)2)3)0.22±0.031)2)3)0.75±0.071)2)3)0.69±0.061)2)3)F675.398234.329177.455158.140P0.0000.0000.0000.000
Note:Compared with RIP 0 μg/ml group,1)P<0.05;compared with RIP 100 μg/ml group,2)P<0.05;compared with RIP 200 μg/ml group,3)P<0.05.

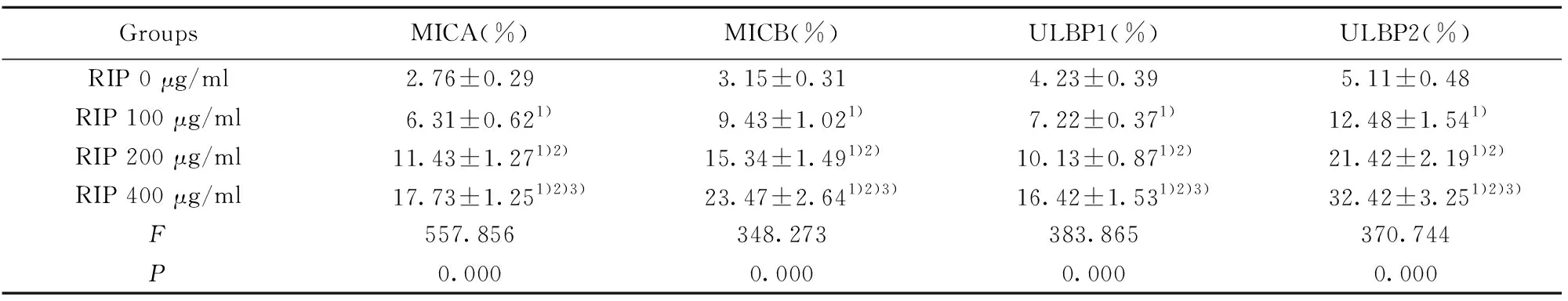
GroupsMICA(%)MICB(%)ULBP1(%)ULBP2(%)RIP 0 μg/ml2.76±0.293.15±0.314.23±0.395.11±0.48RIP 100 μg/ml6.31±0.621)9.43±1.021)7.22±0.371)12.48±1.541)RIP 200 μg/ml11.43±1.271)2)15.34±1.491)2)10.13±0.871)2)21.42±2.191)2)RIP 400 μg/ml17.73±1.251)2)3)23.47±2.641)2)3)16.42±1.531)2)3)32.42±3.251)2)3)F557.856348.273383.865370.744P0.0000.0000.0000.000
Note:Compared with RIP 0 μg/ml group,1)P<0.05;compared with RIP 100 μg/ml group,2)P<0.05;compared with RIP 200 μg/ml group,3)P<0.05.

图3 RIP对食管癌细胞Eca-109中NKG2D配体表达的影响Fig.3 Effect of RIP on expression of NKG2D ligands in esophageal cancer cells Eca-109

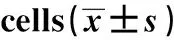

GroupsIFN-γ(pg/mg)TNF-α(pg/mg)NK cells19.72±2.0216.98±1.71NK cells+esophageal cancer cells41.42±5.061)34.26±3.471)NK cells+RIP43.19±4.291)37.34±4.011)NK cells+RIP+esophageal cancer cells72.43±7.141)2)3)65.18±6.211)2)3)F226.908274.502P0.0000.000
Note:Compared with RIP 0 μg/ml group,1)P<0.05;compared with RIP 100 μg/ml group,2)P<0.05;compared with RIP 200 μg/ml group,3)P<0.05.
2.6RIP可提高NK-92细胞对食管癌Eca-109细胞杀伤率的影响 钙黄绿素释放法结果显示,与对照组NK细胞杀伤率(9.35±0.83)%相比,RIP组的NK细胞杀伤率(32.47±3.46)%显著上升(P<0.05)。说明RIP可提高NK-92细胞对食管癌Eca-109细胞的杀伤率。
3 讨论
在中国,食管癌居恶性肿瘤死亡率第四位,且其农村发病率比城市发病率高2~10倍,给患者带来沉重负担[10]。研究发现,79%的食管癌患者有营养不良的症状[11],而中医主要通过调节机体平衡和提高患者免疫力,在控制食管癌复发和转移、减少放射损伤和提高疗效等方面发挥优势作用,延长患者生存期、提高患者生存质量[12]。中药抑制食管癌机制,是食管癌的一个研究热点。
NK细胞是防御肿瘤的重要效应细胞,对原发性食管鳞状细胞癌(ESCC)细胞具有高度的细胞毒性,高水平NK浸润患者5年生存率明显高于低水平NK浸润患者,肿瘤内NK细胞浸润也是预测原发性切除ESCC预后的一个重要参数[13,14]。本研究发现,RIP可促进NK-92细胞增殖,剂量越高,效果越好。
RIP是板蓝根的有效生物活性物质之一,具有抗癌、抗氧化、抗病毒、抑菌、提高机体免疫力、保肝降脂等功能[15]。Liu等[16]研究证实,板蓝根与槐耳双向发酵提取物,可抑制乳腺癌细胞系SK-BR-3 和MDA-MB-231的增殖和迁移,比槐耳提取物对MDA-MB-231的抗癌效果更好。赵从凯等[17]研究表明,板蓝根多糖可抑制小鼠S180肉瘤的增殖,抑制率高达76%。RIP对食管癌的作用尚不清楚。本研究证实,RIP可抑制食管癌Eca-109细胞增殖,且具有显著剂量依赖性。证实RIP具有抗癌的作用,对食管癌具有潜在的临床抑制作用,剂量越高,效果越好,但具体机制尚不清楚。
NKG2D的配体通常在肿瘤细胞系和肿瘤组织中高表达,其很少在健康细胞和组织表面表达,激活受体NKG2D及其配体在NK、γδ(+)和CD8(+)T细胞介导的肿瘤免疫应答中起着重要作用[18]。Zhou等[19]研究表明,化疗联合自体NK细胞治疗晚期食管癌及NKG2D配体MICA阳性表达患者,安全、副作用小,能有效改善患者的免疫系统、生活质量和生存率。本研究结果表明,RIP可促进食管癌细胞Eca-109中NKG2D配体MICA、MICB、ULBP1和ULBP2的表达,促进NKG2D与配体结合,激活NK细胞对Eca-109细胞的杀伤活性。
TNF-α和IFN-γ均是具有广泛生物学作用的细胞因子,TNF-α直接杀伤肿瘤细胞,但大剂量使用时副作用严重;IFN-γ是病毒感染后淋巴细胞分泌的抗病毒和抗肿瘤的糖蛋白,可抑制细胞分裂增殖;两者共固定后可抑制宫颈癌Hela细胞增殖,诱导癌细胞的程序性死亡[20]。本研究发现,RIP可促进与食管癌细胞联合作用后NK细胞中TNF-α和IFN-γ表达,提高NK-92细胞对食管癌Eca-109细胞的杀伤活性,说明RIP通过促进食管癌细胞Eca-109中NKG2D配体的表达和NK细胞中TNF-α和IFN-γ的表达,激活NK细胞对食管癌细胞Eca-109的杀伤敏感性,抑制Eca-109细胞增殖。
本研究阐述了RIP通过促进食管癌细胞表面NKG2D配体的表达,激活NK细胞的杀伤敏感性,促进NK细胞增殖并分泌TNF-α和IFN-γ,抑制食管癌细胞增殖、控制肿瘤的作用机制。RIP是食管癌的潜在治疗药物。

