二甲双胍对小鼠急性肺损伤的保护作用及可能机制研究①
王贵佐 韩 冬 马惠辉 尚文丽 张 薇 张永红
(陕西省人民医院呼吸与危重症医学科,西安 710068)
急性肺损伤 (acute lung injury,ALI)/急性呼吸窘迫综合征 (acute respiratory distress syndrome,ARDS)是指由心源性以外的各种肺内、外致病因素导致的急性、进行性呼吸衰竭,目前ALI/ARDS的死亡率极高[1],因此急需寻找新的治疗方法。ALI/ARDS的发病机制包括氧化和抗氧化失衡[2]。在ALI/ARDS的发病中,肺组织内浸润的炎症细胞(中性粒细胞和肺泡巨噬细胞等)及肺泡上皮细胞等结构细胞可产生大量的活性氧 (reactive oxygen spec-ies,ROS)[2];超氧化物岐化酶(superoxide dismut-ase,SOD)为体内重要的抗氧化酶,是体内清除ROS的关键酶之一,是机体抗氧化系统的重要组成部分。在感染、中毒和休克等环境因素作用下,SOD的表达及活性均显著下降,造成ROS的清除能力明显降低,进而导致氧化应激与抗氧化反应失衡[3],ROS在体内增多可导致脂质的过氧化损伤,产生丙二醛(malondialdehyde,MDA),还可导致蛋白质和DNA的氧化损伤,另外还可进一步激活NF-κB等信号通路,促进促炎介质的分泌,加重肺泡上皮细胞和肺血管内皮细胞的损伤[4,5]。因此重建氧化及抗氧化反应平衡是临床治疗ALI/ARDS的新方向。
二甲双胍是临床应用广泛的口服降糖药物,安全性较高。研究发现二甲双胍预处理可降低动物模型肺泡毛细血管通透性,从而减轻呼吸机所致肺损伤[6]。最新研究发现二甲双胍可能通过恢复AMPK依赖的mTOR抑制,在LPS诱导的ALI中发挥保护作用[7]。然而二甲双胍能否通过重建氧化及抗氧化反应平衡,从而对ALI动物模型发挥保护作用尚待研究。本研究应用LPS诱导的ALI动物模型,评估二甲双胍能否通过重建氧化及抗氧化反应平衡从而对ALI发挥保护作用。
1 材料与方法
1.1材料 BALB/c雄性小鼠由西安交通大学医学部动物实验中心提供。二甲双胍由上海施贵宝制药有限公司提供。脂多糖(Lipopolysaccharide (LPS),Escherichia coli 055:B5)、HRP偶联的羊抗兔二抗购于Sigma-Aldrich。兔抗鼠SOD1一抗购于Bioworld technology。MDA测试盒、SOD活力测试盒购于南京建成生物工程研究所。RIPA裂解液由武汉博士德生物工程有限公司提供。
1.2方法
1.2.1模型制作和实验分组 6~8周龄BALB/c雄性小鼠 (20~25 g) 15只随机分为3组:①对照组(Con),气管内滴注无菌PBS 60 μl,作用24 h;②LPS模型组(LPS),气管内滴注1 mg/ml LPS 60 μl,作用24 h;③二甲双胍组(二甲双胍预处理)(Met+LPS),在气管插管气道滴注LPS前0.5 h给予二甲双胍 (250 mg/kg) 腹腔注射,再气管内滴注1 mg/ml LPS 60 μl作用24 h。小鼠均在西安交通大学医学部动物中心SPF级动物房饲养,LPS气道滴注24 h后处死小鼠。
1.2.2收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)及肺组织样本 造模24 h后用10%水合氯醛0.8 ml/100 g腹腔注射处死BALB/c小鼠,用4℃预冷的无菌PBS 0.7 ml进行支气管肺泡灌洗,重复灌洗3次,支气管肺泡灌洗液的回收率达80%。BALF在4℃,1 000 g,离心10 min。分别收集上清和沉淀,BALF上清液在-80℃保存备用。细胞沉淀用无菌PBS重新重悬,利用细胞计数板进行细胞计数。取细胞沉淀涂片,晾干后进行瑞氏染色,进行中性粒细胞计数。支气管肺泡灌洗后分离右肺组织并在-80℃保存。
1.2.3肺组织病理学检查 取出分离后的左肺组织利用10%中性缓冲甲醛液固定,固定后对左肺组织进行脱水,透明,石蜡包埋后切片(5 μm),进行苏木精-伊红(HE)染色,观察肺组织病理学改变。
1.2.4肺组织匀浆丙二醛含量测定 精密称取各组小鼠肺组织,根据RIPA裂解液使用说明书制备肺组织匀浆,肺组织与RIPA裂解液的比例为1 mg∶7.5 μl,用玻璃匀浆器上下、旋转充分碾磨。在冰上裂解1 h后,14 000 g离心20 min,取上清。肺组织MDA含量是机体脂质过氧化程度的标志,同时可以间接反映肺组织损伤程度。测定原理:MDA在高温及酸性环境下可与2-硫代巴比妥酸(2-Thiobarbituric acid,TBA)反应,产生红棕色的产物3,5,5-三甲基恶唑2,4-二酮,并且在532 nm处有最大吸收峰值。根据测试盒说明书操作,用分光光度计测定吸光度值,并通过如下公式算出待测样品的MDA含量:肺组织中MDA含量(nmol/mg)=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度(10 nmol/ml)/待测样品蛋白浓度(mg/ml)。
1.2.5肺组织匀浆SOD活力测定 实验采用黄嘌呤氧化酶法(羟胺法)测定SOD活力,肺组织中SOD活力计算公式:肺组织匀浆中SOD活力(U/gHb)=(对照OD值-测定OD值)/对照OD值÷50%×反应液总体积/取样量(ml)÷待测样品蛋白浓度(mg/ml)。
1.2.6免疫印迹法检测SOD1表达变化 精密称取各组小鼠肺组织,根据RIPA裂解液使用说明书制备肺组织匀浆,肺组织与RIPA裂解液的比例为1 mg∶7.5 μl,用玻璃匀浆器上下、旋转充分碾磨。在冰上裂解1 h后,14 000 g离心20 min,取上清,利用Western blot检测各组小鼠肺组织SOD1表达的变化,SOD1应用GAPDH作为内参校正。
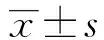
2 结果
2.1二甲双胍对小鼠急性肺损伤肺组织病理改变的影响 如图1所示,LPS模型组显示内皮细胞和上皮细胞被严重破坏,肺出血及炎症细胞在肺组织内大量浸润,肺部正常的组织形态结构消失,二甲双胍治疗组显著抑制LPS诱发的肺组织上述改变,对照组未见小鼠肺组织内明显的炎症反应。
2.2AMPK激动剂二甲双胍对小鼠肺组织浸润炎症细胞数的影响 如图2所示气道内滴注LPS 24 h后,BALF内炎症细胞数显著升高(P<0.01,图2A),中性粒细胞计数显著升高(P<0.01,图2B)。而应用二甲双胍预处理后,可显著减轻LPS诱导小鼠急性肺损伤炎症细胞的浸润。
2.3二甲双胍对肺组织脂质过氧化产物MDA含量影响 与对照组比较,LPS模型组中肺组织匀浆内脂质过氧化产物MDA含量(图3)显著升高,而应用二甲双胍治疗后的小鼠,MDA含量显著下降,提示二甲双胍具有抗氧化作用。
2.4二甲双胍对小鼠肺组织SOD活性的影响 SOD活性反映肺组织抗氧化能力的强弱。如图4所示,与对照组相比,SOD活性显著下降(P<0.01),应用二甲双胍提前干预处理后,显著逆转 SOD活性下降(P<0.05)。提示二甲双胍可提高SOD活性,从而对ALI发挥保护作用。
2.5二甲双胍对小鼠肺组织SOD1表达的影响 SOD1是体内重要抗氧化酶,是体内清除氧自由基的首要物质,是机体抗氧化系统的重要组成部分。为探讨二甲双胍对肺组织保护作用是否通过上调SOD1的表达实现的,在气管插管气道滴注LPS前0.5 h给予AMPK激动剂二甲双胍 (250 mg/kg) 腹腔注射。图5所示,与对照组比较,免疫印迹结果显示LPS模型组小鼠肺组织内SOD1的表达显著降低(P<0.05),应用二甲双胍提前干预处理后,肺组织内SOD1表达较前明显增加。提示二甲双胍可增加肺组织SOD1的表达。

图1 二甲双胍对LPS诱导小鼠急性肺损伤病理改变的影响(HE染色,×200)Fig.1 Effect of metformin on pathological changes of LPS-induced acute lung injury in mice(HE staining,×200)Note:A.Control group;B.LPS model group;C.Met+LPS group.
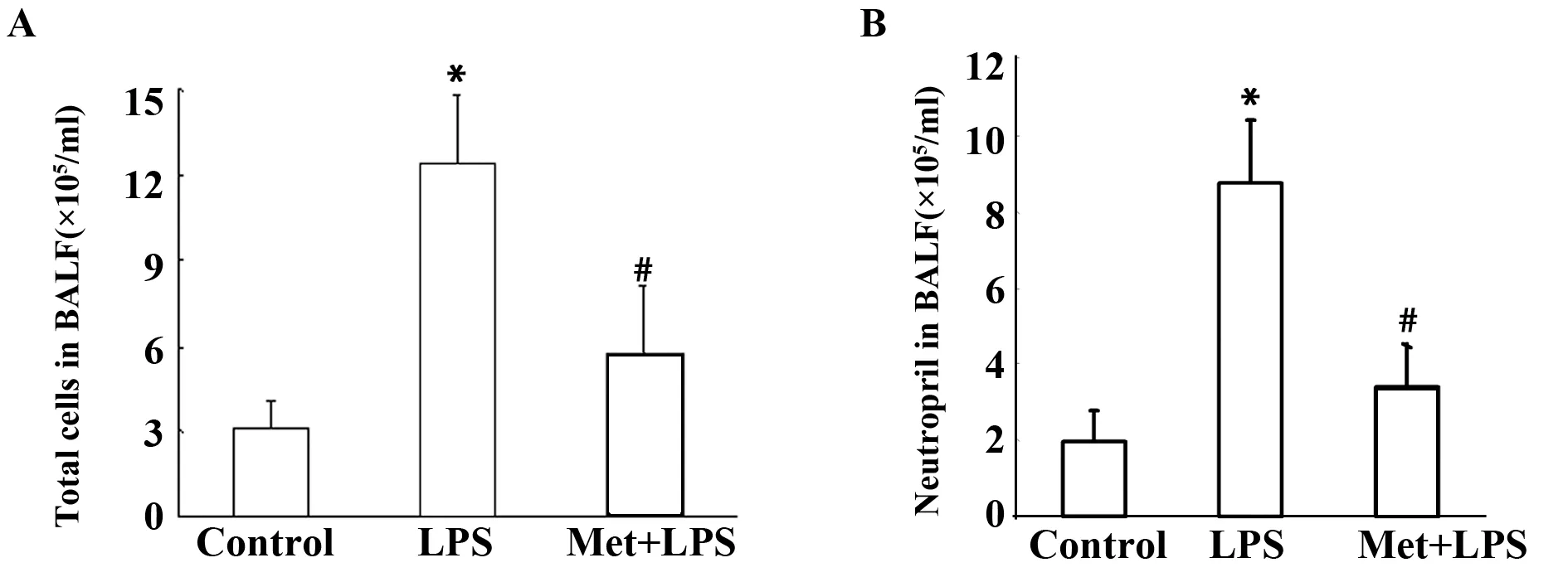
图2 二甲双胍对小鼠肺组织浸润炎症细胞数的影响(n=3)Fig.2 Effect of metformin on inflammatory cell numbers in lung tissue of mice(n=3)Note: A.Total cells in BALF;B.Neutrophils in BALF.*.P<0.01 vs control group;#.P<0.01 vs LPS model group.
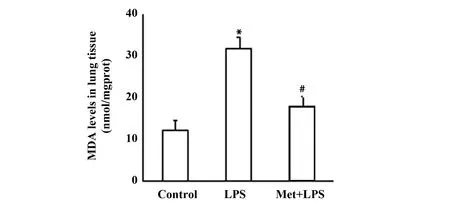
图3 二甲双胍对小鼠肺组织MDA的影响 (n=3) Fig.3 Effect of metformin on MDA in lung tissue of mice (n=3)Note: *.P<0.01 vs control group;#.P<0.01 vs LPS model group.
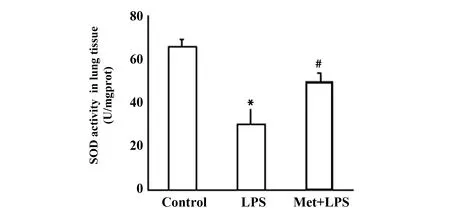
图4 二甲双胍对小鼠肺组织SOD活性的影响(n=3) Fig.4 Effect of metformin on SOD activity in lung tissue of mice (n=3)Note: *.P<0.01 vs control group;#.P<0.05 vs LPS model group.

图5 二甲双胍对肺组织内SOD1表达的影响(n=3)Fig.5 Effect of metformin on expression of SOD1 in lung tissue (n=3)Note: A.Result of Western blot;B.Expression of SOD1 in lung tissue was determined.GAPDH was used as loading control.*.P<0.01 vs control group;#.P<0.05 vs LPS model group.
3 讨论
研究发现氧化-抗氧化失衡是急性肺损伤的重要发病机制之一[2],在ALI/ARDS的发病中,ROS的产生显著增多,ROS可导致脂质的过氧化损伤,DNA损伤及蛋白质失活,进而激活NF-κB 和activator protein 1信号通路,导致黏附分子、趋化因子和炎症细胞因子的大量表达,导致细胞损伤及死亡[2]。在本研究中发现,在ALI动物模型中,脂质过氧化损伤的标志物MDA含量明显增加,SOD活性显著降低,以中性粒细胞为主的炎症细胞在肺组织内大量浸润,进一步证明氧化应激在ALI的发病机制中发挥重要作用。
研究发现二甲双胍对LPS诱导的ALI动物模型发挥保护作用与激活AMPK信号通路有关[7],另有研究发现二甲双胍通过促进AMPK-α1在肺组织中的表达。从而减轻ALI期间的毛细血管损伤,对LPS诱导ALI模型发挥保护作用[8]。近年来研究发现二甲双胍还能减轻多种因素导致的动物模型ALI[6,9,10]。提示二甲双胍可能成为上述肺部疾病新的治疗策略,然而二甲双胍对上述疾病保护作用的具体机制尚待研究。
近年来研究发现增强抗氧化能力,进而抑制氧化应激成为干预ALI/ARDS的重要的策略之一。Yilmaz等[11]研究发现槲皮素(Quercetin)通过增加SOD的表达和增强SOD活性,对误吸导致的大鼠ALI发挥保护作用。临床研究发现ALI患者应用抗氧化剂乙酰半胱氨酸治疗后,氧合指数明显增加,同时减少了对呼吸支持的需求[12]。上述研究提示寻找药物或其他物质来抑制增强抗氧化能力,进而减轻氧化应激可能是临床治疗ALI/ARDS的新方向。Kim等[13]研究发现白藜芦醇通过激活AMPK可以上调SOD1的表达,抑制高血糖诱导的氧化应激和细胞凋亡,对糖尿病肾病模型发挥保护作用。因此二甲双胍能否通过上调SOD1,并增强抗氧化能力减轻氧化应激,进而对LPS诱导的ALI/ARDS模型发挥保护作用值得研究。本研究发现,二甲双胍可上调SOD1的表达,进而增加SOD的活性,减少脂质的过氧化产物MDA的产生,肺组织病理HE染色显示,二甲双胍抑制中性粒细胞为主的炎症细胞在肺组织内的浸润,减轻肺间质、肺泡内出血和肺泡结构的破坏,提示二甲双胍对LPS诱导小鼠ALI/ARDS模型具有保护作用,这种保护作用可能与上调SOD1的表达,和增强SOD活性有关。本研究发现二甲双胍可能通过重建氧化及抗氧化平衡,进而对ALI发挥保护作用。
二甲双胍是一种体外合成的AMPK激动剂,多年来在临床上广泛应用于2型糖尿病的治疗[14]。本研究提示二甲双胍可通过重建氧化与抗氧化之间的平衡,从而为ALI/ARDS的治疗提供新的策略。

