人卵巢癌荷瘤裸鼠肿瘤微环境局部F4/80阳性巨噬细胞表达Foxp3①
胥 琴 邓 波 李曼琳 转 黎 (云南省第一人民医院,昆明 650032)
卵巢癌死亡率占妇科肿瘤首位,严重威胁女性生命健康。卵巢癌免疫疗法仍处于初期研究阶段,探索卵巢癌改造免疫微环境的新机制并逆转免疫抑制状态是卵巢癌免疫疗法的研究策略和热点。巨噬细胞通过调节获得性免疫反应、细胞生长、血管生成、细胞外基质重塑、转移部位微环境构建、肿瘤转移、激素和化疗药物反应等在肿瘤发生发展中发挥重要作用[1]。
叉头框蛋白P3(forkhead box P3,Foxp3)最初被认为是CD25+CD4+调节性T细胞的特异性分子标志[2,3]。2011年Manrique等[4]报道,巨噬细胞可表达Foxp3,并具有免疫抑制效应。因其他研究组在巨噬细胞中不能检测出Foxp3而撤稿,但这些学者并没有给予在肿瘤微环境下的详细研究报告[5,6]。2014年Devaud等[7]指出,正常小鼠巨噬细胞不能表达Foxp3,但肾癌小鼠肿瘤局部浸润的巨噬细胞可以表达Foxp3,因此他们认为肿瘤相关巨噬细胞可以表达Foxp3。目前,巨噬细胞是否表达Foxp3仍然存在争议。
本项目拟鉴定人卵巢癌裸鼠腹腔荷瘤模型外周血、腹水和肿瘤局部的F4/80阳性巨噬细胞是否表达Foxp3,初步探索卵巢癌微环境改造F4/80阳性巨噬细胞的新机制,为寻找卵巢癌免疫疗法新靶点奠定基础。
1 材料与方法
1.1材料 BALB/c Nude雌性小鼠购自京华阜康生物科技股份有限公司,鼠龄8周。人卵巢上皮癌细胞株SKOV3为本实验室所有。RPMI 1640培养基由澳大利亚Gibco公司生产。四季青胎牛血清购自浙江天杭生物科技有限公司。FITC抗小鼠F4/80(123107)、Cy3标记驴抗兔IgG(406402)和FITC标记山羊抗大鼠IgG(405404)购自Biolegend公司。兔抗小鼠Foxp3抗体(ab75763)和大鼠抗小鼠F4/80抗体(ab16911)购自Abcam公司。PE抗小鼠Foxp3(12-4771-82)、Foxp3固定/透膜试剂(00-5521)购自eBioscience公司。红细胞裂解液由武汉纯度生物科技有限公司生产。辣根过氧化物酶标记山羊抗兔IgG(H+L)(A0208)和RIPA裂解液(强)(P0013B)购自碧云天生物技术研究所。Pierce ECL Western blot Substrate试剂盒(32106)由美国Thermo scientific公司生产。总RNA提取试剂盒(DP419)由中国北京天根生物有限公司生产。逆转录试剂盒(04896866001)由瑞士罗氏集团生产。引物由英潍捷基(上海)贸易有限公司合成。流式细胞仪为美国BD公司制造。凝胶电泳分析成像系统和实时荧光定量PCR仪由美国Bio-Rad公司制造。荧光显微镜由德国徕卡仪器有限公司生产。
1.2方法
1.2.1建立人卵巢癌裸鼠腹腔荷瘤模型 常规复苏SKOV3细胞,接种于含10%四季青胎牛血清的1640培养基的培养瓶中,置于37℃,5%CO2细胞培养箱中培养,用0.25%的胰酶消化传代。胰酶消化对数生长期的SKOV3细胞,计数,并用PBS调整细胞浓度为2×107个/ml,1 ml注射器空针抽取0.5 ml细胞悬液注入裸鼠腹腔,40 d后观察小鼠腹胀形成腹水。
1.2.2流式细胞术检测小鼠体内巨噬细胞Foxp3的表达情况 实验分组:①实验组:人卵巢癌裸鼠腹腔荷瘤模型;②对照组:裸鼠腹腔内注入PBS。两组各4只小鼠,准备以下组织:摘除眼球取血法获得外周血,并置于含有EDTA-K2的离心管中,PBS等量稀释待用;颈椎脱臼法处死小鼠,注射器抽吸腹水置于离心管中待用。将上述各细胞悬液1 000 r/min离心5 min,弃上清,加入2 ml红细胞裂解液静置1~2 min,加入4 ml PBS中和,离心弃上清,PBS洗涤2次,获得外周血单个核细胞和腹腔细胞。各管加入50 μl PBS和0.5 μl FITC抗小鼠F4/80吹打混匀,室温避光孵育30 min;各管加入1 ml PBS混匀,离心弃上清,分别加入100 μl IC Fixation Buffer,吹打混匀后室温避光孵育15 min;各管加入1 ml 1×Permeabilization Buffer,吹打混匀,离心弃上清,各加入50 μl 1×Permeabilization Buffer和0.5 μl PE 抗小鼠Foxp3的混合液,吹打混匀,室温下避光孵育30 min;各管加入1 ml PBS,离心弃上清,各加入350 μl PBS重悬细胞,转入流式管,上机检测。以上实验重复3次。
1.2.3流式细胞术分选腹腔F4/80阳性巨噬细胞 按1.2.2方法获取人卵巢癌裸鼠腹腔荷瘤模型腹腔细胞悬液,各管加入50 μl PBS和0.5 μl FITC抗小鼠F4/80吹打混匀,室温避光孵育30 min,各管加入1 ml PBS,离心弃上清,各加入500 μl PBS重悬细胞,转入流式管,上机分选腹腔F4/80阳性巨噬细胞。
1.2.4Western blot检测腹腔F4/80阳性巨噬细胞Foxp3的表达
1.2.4.1细胞总蛋白的提取 收集流式细胞术分选的腹腔F4/80阳性巨噬细胞,应用RIPA裂解液(强)提取细胞蛋白,测定浓度,蛋白变性后置于-80℃冰箱保存待用。
1.2.4.2SDS-PAGE凝胶电泳 制作10%分离胶和5%浓缩胶,每孔分别加入10~25 μg蛋白或5 μl Marker,先60 V恒压电泳,待Marker分开后100 V恒压继续电泳,待溴酚蓝超过钢丝线停止电泳。350 mA 恒流转膜1.5 h,转膜后的PVDF膜用5%脱脂牛奶室温封闭1 h。封闭用牛奶配制一抗(兔抗小鼠Foxp3抗体),与PVDF膜置于4℃冰箱中过夜孵育(≥16 h)。PBST洗涤5次,约8 min/次,5%脱脂牛奶配制HRP标记的二抗(辣根过氧化物酶标记山羊抗兔IgG),37℃孵育1 h。PBST洗涤5次,约8 min/次,按照试剂盒说明书避光配制显色液,凝胶电泳分析成像系统曝光显影,图片拍照保存。
1.2.5实时荧光定量PCR检测腹腔F4/80阳性巨噬细胞Foxp3 mRNA的表达 收集流式细胞术分选的腹腔巨噬细胞,总RNA提取试剂盒提取细胞总RNA,逆转录试剂盒合成cDNA。实时荧光定量PCR:荧光PCR仪及其分析软件iQ5进行PCR扩增和定量分析,每次扩增均设3个复孔。Foxp3引物序列:上游5′-AGACCCCTGTGCTCCAAGTG-3′,下游5′-CAGACTCCATTTGCCAGCAG-3′;反应体系(20 μl):10 μl SYBR Green PCR Master Mix,0.5 μl 上游引物,0.5 μl下游引物,1 μl cDNA,8 μl DEPC水。反应条件:95℃变性3 min后,95℃ 5 s,56℃ 30 s,72℃ 30 s,循环40次后进行溶解曲线分析。
1.2.6免疫荧光检测肿瘤局部F4/80阳性巨噬细胞Foxp3的表达 颈椎脱臼法处死人卵巢癌腹腔移植瘤模型小鼠,制作冰冻切片,4%多聚甲醛室温固定15 min。PBS洗涤3次,每次5 min,加入1 ml 0.1%Triton X-100室温通透15 min。PBS洗涤 3次,每次5 min,各孔加入5% BSA置37℃温箱中封闭30 min。滴加70 μl一抗稀释液(兔抗小鼠Foxp3抗体和大鼠抗小鼠F4/80抗体,1∶200),并设置空白对照,置湿盒中于4℃冰箱中过夜孵育。PBS洗涤3次,每次5 min,避光滴加70 μl荧光二抗稀释液(Cy3标记驴抗兔IgG和FITC标记山羊抗大鼠IgG,1∶200),放于湿盒中37℃避光孵育1 h。PBS避光洗涤3次,每次5 min,避光滴加70 μl Hoechst 33342稀释液(1 mg/ml,1∶2 000),室温避光孵育5 min。PBS避光洗涤3次,每次5 min;滴加适量抗荧光淬灭封片剂,将爬片正面向下盖于其上,在荧光显微镜下观察,图片拍照保存。
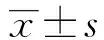
2 结果
2.1人卵巢癌裸鼠移植瘤模型腹腔F4/80阳性巨噬细胞在蛋白水平表达Foxp3 人卵巢癌裸鼠移植瘤模型建立40 d后,收集外周血和腹腔细胞,流式细胞术检测结果显示,正常小鼠和荷瘤小鼠外周血F4/80阳性巨噬细胞中Foxp3的表达率均为0,两组间差异无统计学意义(P>0.05),见图1。两组小鼠腹腔F4/80阳性细胞Foxp3表达率分别为0.45%±0.10%和4.42%±0.46%,差异有统计学意义(P<0.05),见图1。流式细胞术分选腹腔F4/80阳性细胞,Western blot检测结果显示对照组Foxp3表达阴性,而荷瘤小鼠Foxp3表达阳性(图2)。以上结果表明正常小鼠外周血和腹腔F4/80阳性巨噬细胞均不表达Foxp3,人卵巢癌裸鼠移植瘤模型腹腔F4/80阳性巨噬细胞表达Foxp3,但外周血F4/80阳性巨噬细胞不表达Foxp3。
2.2人卵巢癌裸鼠移植瘤模型腹腔F4/80阳性巨噬细胞在基因水平表达Foxp3 人卵巢癌裸鼠移植瘤模型建立40 d后,流式细胞术分选腹腔F4/80阳性细胞,实时荧光定量PCR检测结果发现,与对照组比较,荷瘤小鼠Foxp3表达升高,两组间差异有统计学意义(P<0.05),见图3。说明人卵巢癌裸鼠移植瘤模型腹腔F4/80阳性巨噬细胞在基因水平表达Foxp3。
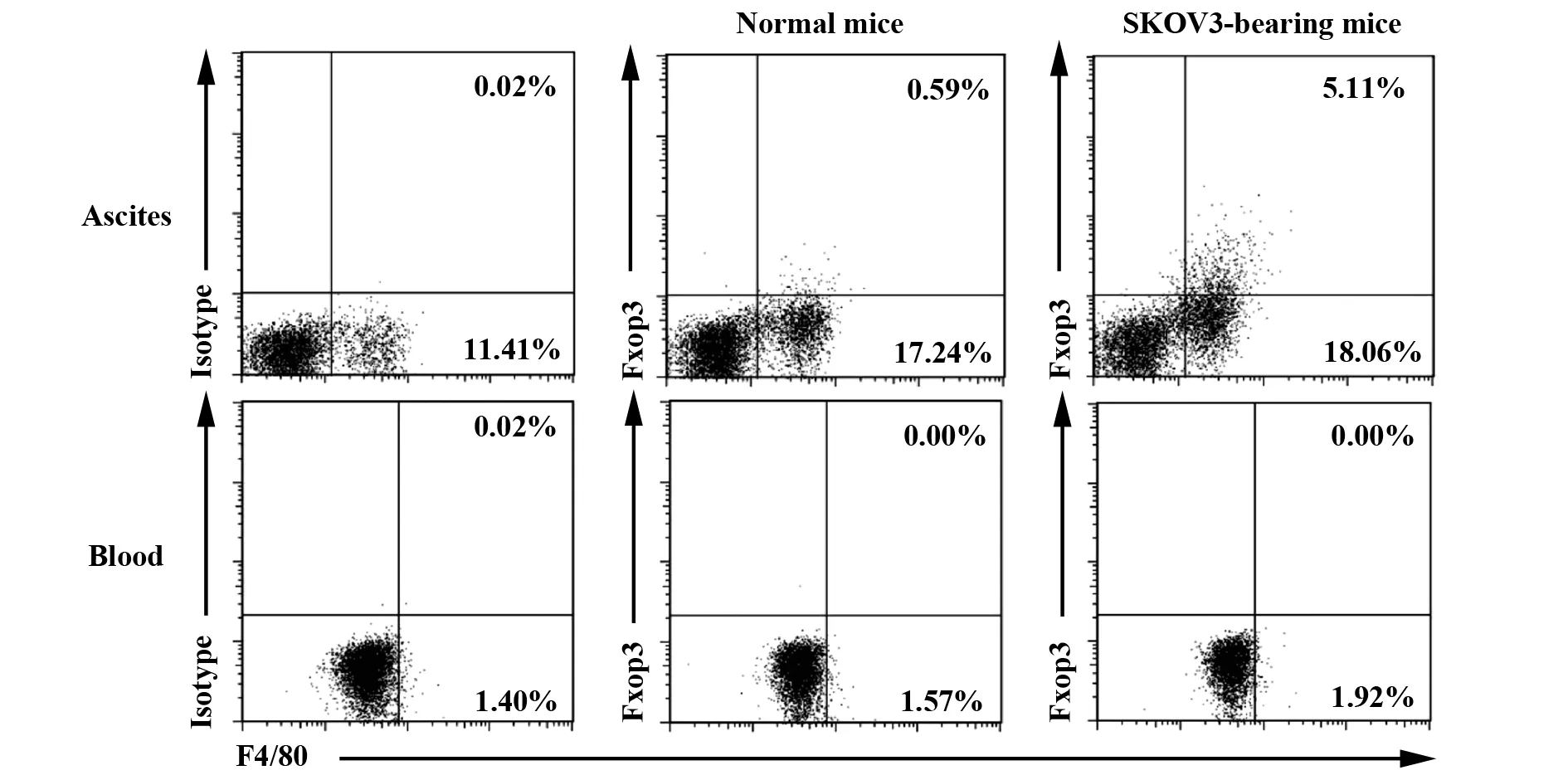
图1 流式细胞术检测腹水和外周血F4/80阳性巨噬细胞中Foxp3表达情况Fig.1 Expression levels of Foxp3 was detected in F4/80+ macrophages of ascites and blood by FASC

图2 Western blot鉴定腹水F4/80阳性巨噬细胞中Foxp3表达情况Fig.2 Expression levels of Foxp3 was detected in F4/80+ macrophages of ascites by Western blotNote:1.Normal mice;2.SKOV-3bearing mice.
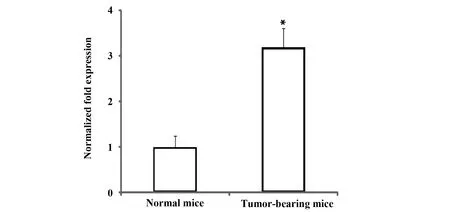
图3 PCR鉴定腹水F4/80阳性巨噬细胞Foxp3在mRNA水平的表达情况Fig.3 Expression levels of Foxp3 mRNA was detected in F4/80+ macrophages of ascites by PCRNote:*.P<0.05.

图4 免疫荧光鉴定肿瘤局部F4/80阳性巨噬细胞中Foxp3表达情况Fig.4 Identification of Foxp3 expression in F4/80+ macrophages of ovarian cancer by immunofluorescence
2.3人卵巢癌裸鼠移植瘤模型肿瘤局部浸润F4/80阳性巨噬细胞表达Foxp3 人卵巢癌裸鼠移植瘤模型建立40 d后,冰冻切片免疫荧光检测显示,腹腔种植瘤肿瘤局部可见F4/80 和Foxp3双阳性细胞(图4),说明肿瘤局部浸润的F4/80阳性巨噬细胞可表达Foxp3。
3 讨论
卵巢癌是女性生殖系统最常见的三大恶性肿瘤之一,早期病变不易发现,晚期病例尚缺乏有效治疗手段,致死率居妇科恶性肿瘤首位。尽管新辅助化疗已应用于临床,但并未显著改善临床结局。随着研究的不断深入,肿瘤免疫疗法治疗恶性肿瘤具有较好的应用前景。免疫检查点分子抑制剂治疗白血病、大B细胞淋巴瘤等效果显著[8]。然而,在卵巢癌中仅少数抑制剂疗效尚可,其主要原因之一就是卵巢癌自身诱导的免疫抑制微环境[9]。
多年来,Foxp3被认为特异性表达于CD4+CD25+调节性T细胞(Tregs)中,其主要功能是调控Treg的发育和功能,而Treg主要抑制免疫反应并诱导免疫耐受而促进肿瘤发展[2,3]。巨噬细胞在肿瘤发生发展中发挥重要作用,但因具有很强的可塑性而在不同微环境中发挥不同功能[10]。
为了避免Tregs中Foxp3的表达影响检测结果,本研究应用T淋巴细胞缺陷的BALB/c Nude雌性小鼠建立人卵巢癌裸鼠腹腔荷瘤模型。首先应用基于抗体的检测技术证明Foxp3在蛋白水平表达于人卵巢癌裸鼠移植瘤模型的腹腔巨噬细胞中。流式细胞术和Western blot两种蛋白检测技术应用来自不同公司的两种抗体都可以检测出腹腔F4/80阳性细胞表达Foxp3。其中,用于流式细胞术的抗体结合第1至第75氨基酸位点,用于Western blot的抗体结合第229至第250氨基酸位点,这些结合位点与NCBI Blast中查询的多个物种蛋白质序列之间无任何显著的同源性。以上方法均在一定程度上避免了巨噬细胞表达Foxp3的假阳性。
为了进一步验证该结果,我们应用实时荧光定量PCR在基因水平证明腹腔F4/80阳性巨噬细胞确实表达Foxp3。同时,我们发现正常小鼠的腹腔巨噬细胞和外周血、腹腔荷瘤小鼠的外周血中F4/80阳性巨噬细胞均不表达Foxp3。此外,免疫荧光双染法发现肿瘤局部见Foxp3和F4/80双阳性细胞。这些结果均说明,Foxp3仅表达于卵巢癌局部微环境的巨噬细胞中。该结果与2014年Devaud等[7]的结果类似,该研究组认为肾癌相关巨噬细胞可以表达Foxp3。
综上所述,本研究应用人卵巢癌裸鼠腹腔荷瘤模型,通过流式细胞术、Western blot、实时荧光定量PCR和免疫荧光在基因和蛋白水平均证明卵巢癌微环境中的F4/80阳性巨噬细胞可表达Foxp3。然而,该研究的流式细胞术和免疫荧光双染法均提示,人卵巢癌荷瘤裸鼠体内并非所有的腹腔和肿瘤局部浸润的F4/80阳性巨噬细胞都表达Foxp3。因此,肿瘤局部微环境诱导巨噬细胞表达Foxp3的具体机制仍需进一步研究。阻断巨噬细胞表达Foxp3可能是卵巢癌等肿瘤免疫治疗的新靶点。

