PLR和NLR对女性良恶性腹水鉴别诊断的预测价值
肖斯柔 肖 盛 肖丽君 范自力 (中南大学湘雅三医院全科医学科,长沙 410013)
腹水是腹腔内液体的病理性积聚,是常见的临床体征,产生腹水的病因很多,包括直接影响腹膜(如感染、恶性肿瘤)或远离腹膜(如低蛋白血症、肝病、心力衰竭等)的各种疾病[1]。对于女性患者,腹水也是一些妇科疾病的常见表现[2],如上皮性卵巢癌、良性卵巢纤维瘤、卵巢间质增生、子宫内膜异位症和子宫肌瘤等。因此医护人员在女性腹水患者鉴别诊断过程中需考虑潜在的妇科疾病。腹水的治疗取决于液体潴留的原因,良恶性腹水的鉴别是一个重要的临床问题,对进一步的诊断和治疗有重要价值。侵袭性检查被认为是区分良恶性腹水的必要手段,然而研究表明尽管腹水的生化特性,如纤维连接蛋白、胆固醇、乳酸脱氢酶等,在临床鉴别上有帮助,但在鉴别良恶性腹水方面仍缺乏足够的敏感度和特异度,且某些检测手段由于其成本、技术等原因难以在临床上推广应用[3]。腹水细胞学诊断在腹膜癌病的疑似病例诊断中具有极其重要的价值,在这些患者中,很容易检测出腹水中的恶性细胞[4]。有证据表明,高达97%的腹膜癌病患者的细胞学检查呈阳性,这使其成为诊断腹膜癌病的一种高度敏感且特异的试验和金标准[5,6]。然而如果不用于选择性患者,腹水细胞学检查则检出率低,研究发现只有7%的腹水患者细胞学检查中发现肿瘤细胞[5]。此外对于恶性腹水患者,一些报道指出,仅50%~60%的恶性腹水患者细胞学检查呈阳性,其敏感性不尽如人意[6],主要原因是腹水中肿瘤细胞浓度低和肿瘤细胞与反应性间皮细胞之间难以区分[7]。因此尽管细胞学检查特异性高,但并不适合作为腹水诊断的筛查试验。同时这些检测指标往往需通过抽取腹水送检得出,当腹腔积液量少或腹腔内广泛粘连时,腹腔穿刺难度大,加上部分指标检测期较长,诊断存在一定滞后性。因此,需要寻找有效且易于获得的良恶性腹水早期鉴别诊断指标,以指导临床决策。
近年来,肿瘤相关炎症是肿瘤免疫领域的研究热点,炎症已被公认为是恶性肿瘤的生物学特点之一[8]。越来越多的证据表明,炎症在癌症发生、发展、恶性转化、侵袭、转移以及癌症的综合治疗及免疫防御都起着至关重要的作用[9]。研究已经提出应用基于炎症细胞计数的综合指标来监测全身炎症反应,如外周血中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、间接中性粒细胞/淋巴细胞比值(derived neutrophil-to-lymphocyte ratio,dNLR)、血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)、淋巴细胞/单核细胞比值(lymphocyte-to-monocyte ratio,LMR)、平均血小板体积(mean platelet volume,MPV),可通过廉价而可靠的全血细胞计数进行常规测定,在多种肿瘤类型和肿瘤分期的癌症患者中显示出独立的预后价值[10-14]。恶性腹水是晚期肿瘤转移至腹膜的直接和突出表现[1],患有恶性腹水的患者往往预后不良[15]。这些血液学指标在良恶性腹水患者间是否存在差异,能否用于腹水良恶性鉴别,从而减少对其他侵入性技术的需求,目前尚不清楚。有研究表明这些炎症血液标记物在男女性健康人群中存在差异[16]。因此本文旨在探讨炎症血液标记物对女性腹水良恶性鉴别诊断的预测价值,以便为腹水良恶性鉴别诊断提供新的思路和方法。
1 资料与方法
1.1资料
1.1.1研究对象 回顾性连续纳入2016年3月至2018年2月就诊于中南大学湘雅三医院的274例女性腹水患者。根据腹水病因分为恶性腹水组130例、良性腹水组144例(包括类良性腹水组54例和单纯良性腹水组90例)。
1.1.2腹水患者一般情况 本研究共纳入274例女性腹水患者,根据腹水病因分为恶性腹水组130例,中位年龄54.50岁(15~88)岁,原发病为胃癌11例,结直肠癌8例,胰腺癌3例,胆囊胆管癌3例,腹膜假黏液腺瘤5例,卵巢癌72例,子宫内膜癌5例,子宫肉瘤1例,宫颈癌1例,恶性黑色素瘤1例,肺癌2例,乳腺癌1例,淋巴瘤1例,原发灶不明的转移性癌16例。良性腹水组144例,中位年龄46.00岁(12~85)岁,其中类良性腹水组54例,中位年龄46.50岁,原发肿瘤为肝癌5例,胃癌1例,卵巢癌36例,子宫内膜癌8例,子宫肉瘤2例,肺癌1例,乳腺癌1例;单纯良性腹水组90例,中位年龄46.00岁,原发病为肝硬化腹水21例,结核性腹水17例,心功能不全3例,低蛋白血症2例,肾病综合征1例,结缔组织疾病1例,卵巢良性肿瘤33例,子宫内膜异位症8例,子宫肌瘤4例。
1.1.3纳入及排除标准
1.1.3.1纳入标准 初次就诊、临床资料完善、病因诊断明确的女性腹水患者;入院前未接受过任何抗肿瘤治疗(包括放射治疗、化学治疗、生物治疗、免疫治疗、靶向治疗及中药治疗);住院期间通过腹腔穿刺或腹腔手术留取腹水进行细胞学检查,和/或进行腹膜活检患者。
1.1.3.2排除标准 有骨转移临床表现,如骨痛、活动障碍、病理性骨折、高钙血症等,或经放射性核素骨显像、PET-CT等影像学检查明确有骨转移者;影像学检查提示脾脏增大者;有发热、合并腹腔感染患者;合并血液系统疾病、活动性出血者;近3月有输注血液制品病史者;既往长期服用激素、免疫抑制剂、抗结核药物、口服避孕药者。
1.1.4评价标准
1.1.4.1恶性腹水的诊断 腹水细胞学检查阳性或腹膜活检病理提示腹膜转移癌;并排除肝硬化、结核等可能引起腹水的良性疾病。
1.1.4.2类良性腹水的诊断 癌症患者由于合并症所致腹水,而非肿瘤转移至腹膜所产生的腹水,腹水细胞学检查阴性或腹膜活检病理未发现腹膜转移癌。
1.1.4.3单纯良性腹水的诊断 由临床症状、实验室检测及影像学检查等综合判断,排除合并肿瘤可能,且腹水细胞学检查阴性或腹膜活检病理未发现腹膜转移癌。
1.2方法 收集患者临床病理学资料,包括年龄、疾病类型、组织病理学结果、腹水脱落细胞学结果、影像学资料以及入院当天血常规中的白细胞及其分类计数绝对值、血小板绝对值、MPV及血清白蛋白结果。并计算得出NLR、dNLR、PLR和LMR,计算保留小数点后2位。
1.3统计学处理 应用SPSS24.0软件进行统计分析。偏态分布计量资料以中位数(下四分位数,上四分位数)[M(P25,P75)]表示,组间比较采用非参数Mann-WhitneyU检验。应用ROC曲线评价单项指标在女性良恶性腹水鉴别诊断中的价值。多因素logistic回归分析筛选女性恶性腹水的独立预测因子。P<0.05为差异有统计学意义。
2 结果
2.1各组患者各项指标比较 各组患者各项指标经正态性检验,均呈偏态分布。女性恶性腹水组外周血NLR、dNLR、PLR水平及年龄均明显高于良性腹水组(P<0.05),外周血LMR明显低于良性腹水组(P<0.05);两组患者MPV差异无统计学意义(P>0.05)。良性腹水患者中单纯良性腹水组与类良性腹水组间各项指标差异无统计学意义(P>0.05)。见表1。
2.2各炎症血液标记物对女性良恶性腹水的鉴别诊断效能 选择上述差异有统计学意义的炎症血液标记物构建ROC曲线,通过计算约登指数确定最佳截断值。结果显示,单项指标诊断女性恶性腹水价值方面,外周血PLR曲线下面积最大,其次是NLR。LMR、dNLR曲线下面积低于0.700。见表2。
2.4良恶性腹水鉴别诊断相关指标的多因素logistics回归分析 以腹水性质为因变量,将单因素分析中P<0.05的指标纳入多因素logistics回归分析,其中年龄设置为哑变量(分为<40岁,40~59岁,≥60岁),外周血NLR、dNLR、PLR及LMR按各自最佳截断值划分,转化为分类变量纳入。共线性诊断提示各变量间不存在多重共线性。采用向前逐步法进行回归运算(纳入概率为0.05,剔除概率为0.10)。结果发现,经过年龄调整,NLR≥2.29、PLR≥217.84是女性恶性腹水的独立危险因素(P<0.05)。见表3。
表2 外周血NLR、dNLR、PLR及LMR对女性腹水良恶性的鉴别诊断效能
Tab.2 Diagnostic efficacy of peripheral blood NLR,dNLR,PLR and LMR in differentiating malign-ant and benign female ascites
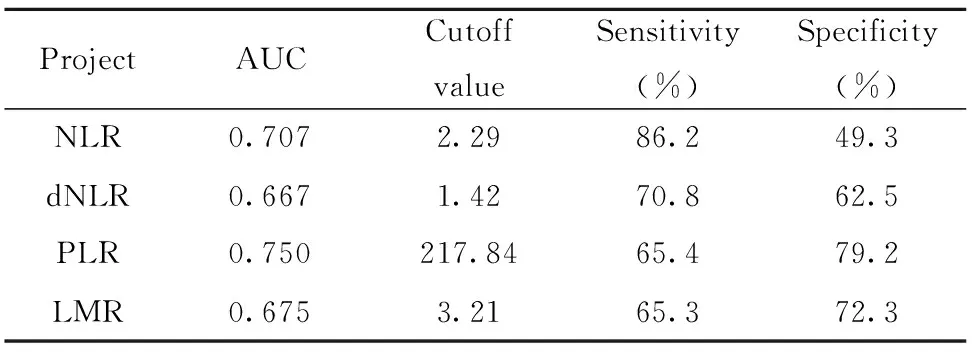
ProjectAUCCutoffvalueSensitivity(%)Specificity(%)NLR0.7072.2986.249.3dNLR0.6671.4270.862.5PLR0.750217.8465.479.2LMR0.6753.2165.372.3
表1 女性良恶性腹水患者各项指标比较[M(P25,P75)]
Tab.1 Comparison of indexes in female patients with benign and malignant ascites[M(P25,P75)]
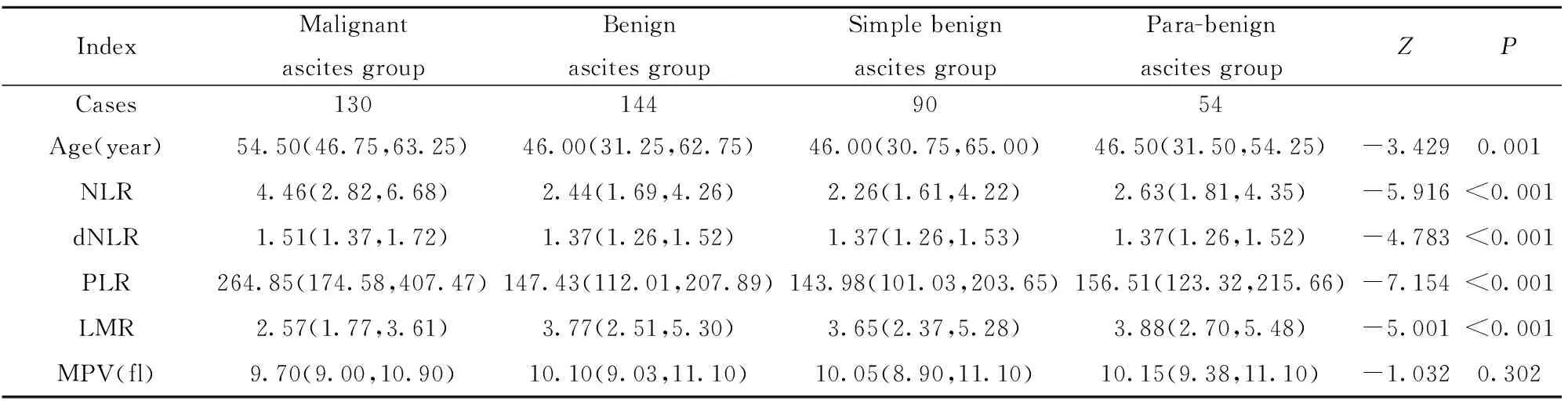
IndexMalignantascites groupBenignascites groupSimple benignascites groupPara-benignascites groupZPCases1301449054Age(year)54.50(46.75,63.25)46.00(31.25,62.75)46.00(30.75,65.00)46.50(31.50,54.25)-3.4290.001NLR4.46(2.82,6.68)2.44(1.69,4.26)2.26(1.61,4.22)2.63(1.81,4.35)-5.916<0.001dNLR1.51(1.37,1.72)1.37(1.26,1.52)1.37(1.26,1.53)1.37(1.26,1.52)-4.783<0.001PLR264.85(174.58,407.47)147.43(112.01,207.89)143.98(101.03,203.65)156.51(123.32,215.66)-7.154<0.001LMR2.57(1.77,3.61)3.77(2.51,5.30)3.65(2.37,5.28)3.88(2.70,5.48)-5.001<0.001MPV(fl)9.70(9.00,10.90)10.10(9.03,11.10)10.05(8.90,11.10)10.15(9.38,11.10)-1.0320.302
表3 良恶性腹水鉴别诊断相关指标的多因素logistics回归分析
Tab.3 Multivariate logistics regression analysis of related indexes in differential diagnosis of benign and malignant ascites

ProjectβSEWaldPOR(95%CI)<40 year(Reference group)7.4740.02440-59 year1.0130.3757.2850.0072.752(1.320-5.741)≥60 year0.8320.3964.3980.0362.297(1.056-4.996)NLR≥2.291.0330.3449.0060.0032.809(1.431-5.515)PLR≥217.841.4830.30623.478<0.0014.408(2.419-8.032)
3 讨论
恶性腹水是全身或腹腔来源的恶性肿瘤引起腹膜弥漫性病变而导致的腹膜液异常及过度积聚,其病理生理机制是多因素且复杂的,至今尚未完全阐明[6]。许多研究表明,血管内皮生长因子(VEGF)及基质金属蛋白酶(MMP)在腹膜液体的过度分泌中起着重要的作用[17]。炎症细胞因子如IL-1b和IL-6可调节VEGF、MMP的生成,从而刺激肿瘤血管生成并提高血管通透性,导致液体滤过增加[18]。此外炎症还参与肿瘤的腹膜转移,通过破坏细胞间连接暴露细胞外基质,促进细胞间黏附因子的表达,加强肿瘤细胞与腹膜间的黏附[19]。而恶性腹水作为一种复杂的可溶性因子和细胞成分的混合物,不仅是肿瘤细胞的被动载体,也为肿瘤细胞提供促炎和促肿瘤的微环境[20,21]。上述证据有力地表明肿瘤相关炎症反应与恶性腹水之间互相促进且互相依存,共同在肿瘤进展和转移中发挥重要作用,与肿瘤患者预后不良密切相关。因此推测反映全身炎症的血液标记物可能在良恶性腹水患者间存在差异。
NLR、dNLR、PLR、LMR作为多种炎症细胞相结合的指标能够相对客观和可靠地反映机体的促肿瘤和抗肿瘤效应,在临床实践中易于测量且检测价格低廉,近年来得到了学者们广泛的研究,研究证实NLR、dNLR、PLR升高是多种类型肿瘤无进展生存及总体生存的不良预后因素[11,12,22],而LMR降低往往提示预后不良[13]。尽管这些标记物被认为是肿瘤潜在的预后预测因子,但在女性良恶性腹水鉴别诊断的背景下,这些标记物的作用目前尚不明确。本研究发现女性恶性腹水患者外周血NLR、dNLR、PLR各项指标水平均明显高于良性腹水患者(P<0.05),外周血LMR水平低于良性腹水患者(P<0.05)。在肿瘤患者中,腹水细胞学检查阴性(即类良性腹水)患者预后明显优于腹水细胞学检查阳性(即恶性腹水)患者,类良性腹水及恶性腹水之间的区分对于癌症患者的临床分期及治疗决策有重要意义[23]。本研究发现,与恶性腹水患者相比,类良性腹水患者外周血NLR、dNLR、PLR各项指标水平均明显减低,外周血LMR水平明显升高,而良性腹水患者中类良性腹水组与单纯良性腹水组间各项指标差异无统计学意义(P>0.05)。
在此基础上,我们还绘制ROC曲线来评估各炎症标志物的表现,以确定这些指标是否有助于区分女性良恶性腹水。结果显示,PLR诊断价值最高,其次是NLR,曲线下面积分别为0.750、0.707。dNLR、LMR因曲线下面积小于0.700,而不适用于女性腹水良恶性鉴别。在单项预测恶性腹水方面NLR诊断灵敏度优于其他指标,可用于女性恶性腹水的初步筛查。而在诊断特异度方面,PLR优于其他指标,可用于女性恶性腹水的辅助诊断。
流行病学调查发现,恶性肿瘤发病率在0~39岁组处于较低水平,40岁以后开始快速升高[24]。有研究显示肿瘤患者中60岁以下人群相较60岁以上人群发生腹膜转移的风险增高[25]。在本研究中,女性良恶性腹水患者间年龄存在差异,为避免可能由年龄产生的混杂影响,我们运用多因素分析发现,女性腹水患者40~59岁、≥60岁年龄人群相对于40岁以下年龄人群恶性腹水患病风险增高,OR值分别为2.752、2.297,且恶性腹水患病风险随着年龄的增长有所下降。经过年龄调整,NLR≥2.29、PLR≥217.84是女性恶性腹水的独立危险因素(P<0.05)。Nakayam等[26]发现NLR>2.37时,胃癌发生腹膜转移的风险升高。Chua等[27]发现PLR>166与阑尾上皮性肿瘤的腹膜癌指数升高相关。本研究截断值与既往研究存在差异,这可能与我们纳入的研究对象不同有关。
本研究是对单个机构记录的回顾性分析,同时由于纳入标本相对有限,在多因素研究中,我们分析的事件数量相对较少,若对各类腹水患者进行分层分析以控制其他可能混杂因素的影响,本研究样本量相对有限,因此以后应该扩大样本量,以多机构队列为基础进行更大范围的前瞻性研究,以证实我们的发现,且可能会提高多元分析的能力,从而识别更多的预测因素。另外本研究排除了可能影响血象的相关合并症,如脾大、感染等,一定程度上限制了炎症血液标记物在临床工作中的适用范围,而进一步分层分析可能对于明确合并脾大、感染等因素是否会对炎症血液标记物在良恶性腹水鉴别诊断效能上产生影响提供帮助,以扩大补充炎症血液标记物的应用前景。
综上所述,外周血NLR、PLR对于女性腹水良恶性鉴别具有一定诊断价值,具有简便、便宜、快捷可靠等优点,当NLR、PLR升高时应警惕恶性腹水可能。

