黄芪多糖在人血γδT细胞体外抑制人肺癌A549细胞增殖作用的研究①
席雪琴 何愉胜 (重庆三峡医药高等专科学校附属医院,重庆 404000)
黄芪多糖(astragalus polysaccharide,APS)是黄芪的主要药理成分之一,近年来对黄芪药理成分及现代药理、临床疗效等有较多的研究,发现黄芪多糖有利于肿瘤治疗;γδT细胞主要分布于上皮组织和外周血;主要有两个亚群:Vδ1及Vδ2,一些研究发现γδT细胞能对多种肿瘤细胞起到杀伤作用[1]。黄芪多糖对正常人γδT细胞具有免疫调节作用,能促进产生IFN-γ及TNF-α。但目前有关黄芪多糖联合γδT细胞作用于肿瘤细胞的效应如何未见报道,故本研究探讨黄芪多糖在人外周血γδT细胞体外抑制人肺癌 A549细胞增殖作用的影响。
1 材料与方法
1.1材料 注射用APS购自天津赛诺制药(批号180302);人肺腺癌细胞株A549细胞来源于重庆医科大学;MTS试剂盒购自Promega公司(CellTiter 96 AQueous Non-Radiotive Cell Proliferatim Assay,普洛麦格北京生物技术有限公司);Ficoll淋巴细胞分离液购自北京鼎国生物技术公司;RPMI1640培养基购自美国Hyclone公司,添加100 U/ml 青霉素,100 μg/ml 链霉素、10 mmol/L Hepes购自美国Sigma公司;10%胎牛血清购自四季青公司;白细胞介素-12(IL-2)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)购自Peprotech公司;淋巴细胞分离液购自中国生科院;小鼠抗人TCRγδ-FITC(AB 1575111;No.331207)购自Biolegend公司;EpicsXL流式细胞仪购自美国Beckman Coulter公司。
1.2方法
1.2.1外周血单个核细胞(PBMC)的制备 取健康成人外周血40 ml,肝素抗凝。加入等体积的D-Hanks液混匀。取2只50 ml离心管,每只加入20 ml 淋巴细胞分离液,将与D-Hanks液混匀的外周血沿离心管管壁缓慢加入,在加入过程中保持分界面清晰,2 000 r/min离心20 min,小心吸取D-Hanks液与血清之间的白色层于10 ml离心管中,分别用5 ml PBS以1 500 r/min离心洗涤2次以及5 ml RPMI1640以1 500 r/min离心洗涤1次,每次10 min,即得外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。
1.2.2γδT细胞的分离纯化及刺激扩增 将离心所得的PBMC细胞加入50 ml培养瓶中,再加入含10%胎牛血清的RPMI1640培养基3 ml,在5%CO2、37℃恒温培养箱中培养3 d,然后离心,转入EP管中,加入 Anti-human gamma-delta TCR-FITC抗体标记γδT细胞,4℃冰箱放置30 min离心,加入适量PBS,经流式细胞仪分离纯化γδT细胞,并检测γδT细胞的纯度。将分离纯化的γδT细胞加入50 ml培养瓶中,加入3 ml含10%血清、100 U/ml双抗的RPMI1640培养基中,再加入唑来膦酸(终浓度为300 pg/ml)、 IL-2(终浓度为200 U/ml),置于5%CO2、37℃恒温培养箱中培养,每3 d换一次液,培养12 d,调整细胞浓度为106L-1备用。
1.2.3ELISA测定IL-12、IFN-γ、TNF-α含量 将上述分离纯化及刺激扩增的γδT细胞(细胞密度为1×106ml-1),加入不同浓度黄芪多糖(终浓度分别为40、80、160 mg/L),继续培养48 h后,用ELISA法测定γδT细胞分泌的IL-12、IFN-γ、TNF-α含量,求得最佳黄芪多糖浓度。
1.2.4肺癌A549细胞的培养 将复苏的肺癌A549细胞株培养于50 ml的玻璃培养瓶中,加入3 ml的含10%胎牛血清、100 U/ml双抗的RPMI1640培养基,置于5%CO2、37℃恒温培养箱中,每隔1 d换一次液,细胞长到85%左右传代培养。培养细胞状态到对数期,备用。
1.2.5A549细胞抑制实验 将对数生长期的人肺腺癌A549细胞以每孔(0.5~1)×104的细胞数接种于96孔板,每孔100 μl(终浓度为1×105ml-1)。待细胞贴壁后,实验分为3组,黄芪多糖组(黄芪多糖+A549细胞,其中黄芪为含药完全培养液,浓度为80 mg/L)、γδT细胞组(扩增并纯化后的γδT细胞+A549细胞)、黄芪多糖刺激扩增并纯化后的γδT细胞组(黄芪多糖+扩增并纯化后的γδT细胞+A549细胞,其中黄芪为含药完全培养液,浓度为80 mg/L),置于37℃、5%CO2培养箱内继续培养48 h,其后,每孔加入5 mg/ml MTT 10 μl(终浓度为5 g/L),继续培养4 h后,弃上清液,每孔加入DMSO 150 μl,轻轻振荡后静止20 min,在酶标仪上570 nm波长处测每孔吸光度值(A值)。抑制率(%)=(对照孔A值-实验孔A值)/对照孔A值×100%。
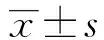
2 结果
2.1外周血单个核细胞(PBMC)的制备、γδT细胞的分离纯化及刺激扩增 从外周血PBMC中用流式分离出γδT细胞,经唑来膦酸和IL-2同时刺激扩增培养后,其浓度可达88.63%(图1) 。该纯度可以满足γδT细胞的功能研究。
2.2不同浓度黄芪多糖与纯化扩增的γδT细胞联合培养后IL-12、IFN-γ、TNF-α的浓度 扩增后的γδT细胞(细胞密度为1×106ml-1),加入不同浓度黄芪多糖(终浓度分别为0、40、80、160 mg/L),继续培养48 h后,用ELISA法测定γδT细胞上清液中IL-12、IFN-γ、TNF-α的含量。其中,80 mg/L黄芪多糖组,IL-12、IFN-γ、TNF-α浓度较高,与0 mg/L对照组和40 mg/L 梯度组比较有统计学意义(P<0.05),见表1。
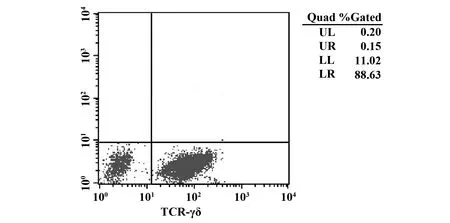
图1 流式细胞仪分析γδT细胞的纯度Fig.1 Detecting purity of γδT cells with flow cytometry
表1 不同浓度黄芪多糖与γδT细胞联合培养后IL-12、IFN-γ、TNF-α浓度
Tab.1 Concentrations of IL-12,IFN-γ and TNF-α after co-cultured with different concentrations of Astragalus polysaccharide and γδT cells

Concentrationof APS(mg/L)IL-12(pg/ml)IFN-γ(pg/ml)TNF-α(pg/ml)00.623±0.2831)0.142±0.1601)0.107±0.1511)408.876±4.5124.564±3.3144.162±3.1368024.731±4.3912)9.635±3.5683)8.967±3.2354)16025.684±4.0759.479±3.5639.075±3.402
Note:1) γδT cells treated by 0 mg/L APS were set as negative controls;2)The concentration of IL-12 in 80 mg/L APS pretreated group was significantly different compared with 40 mg/L APS pretreated group (P<0.05);3)The concentration of IFN-γ in 80 mg/L APS pretreated group was significantly different compared with 40 mg/L APS pretreated group (P<0.05);4)The concentration of TNF-α in 80 mg/L APS pretreated group was significantly different compared with 40 mg/L APS pretreated group (P<0.05).
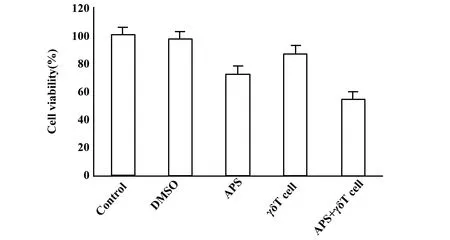
图2 黄芪多糖、γδT细胞对A549细胞的增殖抑制效应Fig.2 Effects of Astragalus polysaccharide and γδT cells on proliferation inhibition of A549 cells
2.3对A549细胞的增殖抑制效应 黄芪多糖、γδT细胞及黄芪多糖+γδT细胞分别显示对人肺癌A549细胞的增殖有抑制效应,抑制率分别为 28.13%、13.35%及45.67% (黄芪多糖、γδT细胞及黄芪多糖+γδT细胞组A549细胞活力分别为对照组的71.87%、86.65%及54.33%) ,其中黄芪多糖联合γδT细胞对人肺癌A549细胞的增殖抑制效应最强;各组比较,差异有统计学意义(P<0.05),见图2。
3 讨论
黄芪的主要药理成分是黄芪多糖(APS)和黄芪甲苷(AS)。近年来对黄芪药理成分、药代动力学、相关临床疗效等有许多的研究,研究结果表明黄芪对心血管系统、血液系统、呼吸系统、免疫系统及肿瘤等方面均有良好的作用。Wang等[2]以黄芪多糖(APS)注射于小鼠腹腔,发现小鼠腹腔巨噬细胞数量增多,同时细胞内的补体C3含量增加。王光等[3]用C57BL/6鼠和其自发产生的黑色素瘤B16细胞,以生存期为指标,建立了黄芪多糖增强IL-2/LAK抗肿瘤作用的动物模型,结果表明黄芪多糖自身具有一定的抗肿瘤作用。赵克胜等[4]研究发现黄芪多糖能促进正常人及肿瘤患者外周单个核细胞在体外分泌肿瘤坏死因子(TNF);进一步将外周单个核细胞分离为黏附和不黏附细胞后,发现黄芪多糖对两者产生的TNF均有增强作用,表明黄芪多糖有利于肿瘤治疗。
γδT细胞主要有两个亚群:Vδ1和Vδ2,Vδ1主要分布于上皮组织,Vδ2主要分布于外周血。γδT细胞具有独特的生物学作用,γδT细胞主要参与固有免疫,不受MHC的限制,识别多肽类抗原和磷酸盐抗原[5],在抗感染免疫、肿瘤免疫、炎症反应及自身免疫疾病等方面均有重要作用。研究发现γδT细胞能对多种肿瘤细胞起到杀伤作用[6,7],且杀伤过程是不受MHC限制的,γδT细胞介于适应性免疫与固有免疫之间,可识别和杀伤那些逃避了αβT细胞攻击的肿瘤细胞。γδT细胞主要通过表面受体NKG2D识别表达于肺癌等肿瘤细胞上的MHCⅠ相关分子A(MICA),通过NKG2D-MICA途径,产生肿瘤免疫[8]。
本研究体外制备外周血单个核细胞(PBMC)、分离纯化γδT细胞,采用IL-2及唑来膦酸同时刺激扩增γδT细胞,获得了后续实验要求丰度的γδT细胞,不同浓度的黄芪多糖与γδT细胞联合培养,γδT细胞可分泌IL-12、IFN-γ及TNF-α;其细胞上清液含量与黄芪多糖浓度呈量效关系,且黄芪多糖浓度在80 mg/L时,量效关系最明显;此结果与其他研究表明黄芪多糖生物学效应广泛,不仅对单个核细胞、巨噬细胞,同时对γδT细胞也具有正向的促分泌细胞因子的作用,尽管在不同的实验中,研究者采用的黄芪浓度有差异,但实验结果均表明,黄芪多糖的药理作用有一定的量效关系[9,10]。
一方面黄芪多糖对免疫正向作用是肯定的,刘爱平等[11]研究表明黄芪多糖对人肺癌A549细胞的增殖有抑制作用,其可能机制为下调了Bcl-2和上调了Bax的表达;庄梦婕等[12]采用黄芪多糖联合顺铂抑制了小鼠Lewis肺癌移植瘤生长。另一方面学者对γδT细胞的研究发现,通过扩增γδT细胞,对小鼠肺鳞癌的过继免疫治疗,观察到小鼠的成活期延长; Nakajima等[13]进一步通过对12例晚期肺癌患者回输经体外扩增培养的自体γδT细胞,发现对肺癌患者的治疗有一定作用。同样本研究显示不论是黄芪多糖,还是γδT细胞分别都对人肺癌A549细胞增殖有相应的抑制作用;同时黄芪多糖联合γδT细胞对A549细胞增殖的抑制率大于二者单独抑制率之和,表明黄芪多糖联合γδT细胞对A549细胞增殖的抑制作用有相互增效作用。
本研究显示黄芪多糖联合γδT细胞对A549细胞增殖的抑制作用有相互增效作用,为黄芪多糖、γδT细胞的抗瘤应用有积极的正向作用,但仍有许多问题需解决,其一黄芪多糖联合γδT细胞的抗瘤增效机制需进一步研究,其二需在动物体内进行相应的验证,以便获得更多的实验数据。

