靶向APE/Ref-1基因沉默及过表达对MRC-5细胞氧化损伤的影响
王钥 张慧明 刘天睿 范采萧 熊健良 陈珏晓 张鹏霞
(佳木斯大学 1临床医学院,黑龙江 佳木斯 154007;2基础医学院)
衰老是导致人类疾病的最大危险因子,多种慢性病、退行性疾病产生的重要原因就是氧化损伤与氧化应激。随着人体衰老,机体活性氧(ROS)大量积聚,导致氧化应激。因此,找出体内干预氧化应激过程的细胞分子生物学指标,增强细胞抗氧化能力,延缓机体衰老,对于慢性疾病的防治具有十分重要的研究价值。人类脱嘌呤/脱嘧啶核酸内切酶/氧化还原因子(APE/Ref)-1是一类分布广泛的生物大分子蛋白质,可控制细胞分化、凋亡和增殖,调控转录因子和氧化还原状态〔1,2〕;作为核酸内切酶它可以切除修复ROS引起的损伤的DNA碱基,治疗ROS引起的氧化应激损伤。细胞核内该基因的高表达有助于修复并减少DNA损伤。当前,在抗肿瘤药物开发方面对APE/Ref-1的研究已获得了许多新的研究进展〔3〕,而该基因对氧化损伤的人胚肺成纤维细胞MRC-5细胞的影响还未见报道。有文献表明,棉酚对APE/Ref-1基因表达有抑制作用〔4〕,黄芪多糖对APE/Ref-1基因表达有促进作用〔5〕。本研究分别用黄芪多糖和棉酚使MRC-5细胞的APE/Ref-1基因表达上调和下调,验证APE/Ref-1基因对MRC-5细胞氧化损伤的影响。
1 材料和方法
1.1 材料 MRC-5细胞购自中国科学院上海细胞库;DMEM培养基、胎牛血清(FBS)为HyClone公司产品;CCK-8、二甲基亚砜(DMSO)、胰蛋白酶购自Sigma公司;牛血清白蛋白(BSA)、聚偏二氟乙烯膜(PVDF)、四甲基乙二酸(TEMED)、过硫酸铵、十二烷基硫酸钠(SDS)、丙烯酰胺为Amresco公司产品;小鼠抗人 8-羟基-2′脱氧鸟苷(8-OHd G)抗体为Santa Cruz公司产品;FITC标记的山羊抗小鼠免疫球蛋白(Ig)G、β-肌动蛋白(actin)和APE/Ref-1单克隆抗体为武汉博士德生物公司产品。
1.2 方法
1.2.1 细胞培养和处理 在DMEM培养液(含100 μg/ml链霉素、100 ml灭活FBS和100 IU/ml青霉素)中培养MRC-5细胞,于50 ml/L CO2、37℃、湿度适合的孵育箱中常规培养。细胞单层贴壁生长到70%~80%时,用2.5 g/L胰蛋白酶/EDTA消化,按1∶3比例分瓶传代培养,以下实验选取处于对数生长期的MRC-5细胞。
1.2.2 药物浓度的选择 取对数生长期的MRC-5细胞分别设计三组药物浓度,每组设4个复孔,在96孔板中接种,每孔接种5×103个细胞、200 μl培养液。用CCK-8法测细胞活力:丢弃孔内培养液,每孔加入CCK-8培养液(CCK-8液∶培养液=1∶9,实验前配好,现用现配混匀后加入孔中)100 μl,孵育1~4 h,酶标仪测OD值。实验均重复三次,结果取平均值。细胞增殖抑制率=(A对照组-A实验组)/A对照组×100%。选择最适药物浓度用于以下实验。
1.2.2.1 过氧化氢(H2O2)处理MRC-5细胞产生氧化损伤 应用3% H2O2(8.89 mol/L),浓度分别为400、500、600、700、800、900、1 000、1 100、1 200 μmol/L,在孵育24 h后,弃原培养液,磷酸盐缓冲液(PBS)洗2次,换成指定H2O2浓度的培养液(空白对照组和对照组换新培养基),孵育24 h,CCK-8检测细胞活力。
1.2.2.2 棉酚抑制MRC-5细胞APE/Ref-1基因的表达 空白组:无细胞的完全培养基;对照组:完全培养液和细胞;H2O2模型组:细胞用终浓度为 700 μmol/L的H2O2完全培养液;棉酚处理组:将20 mg棉酚溶解,制成浓度40 mg/ml的溶液,设计浓度分别为 30、25、20、15、10 μmol/L,种板孵育24 h后,H2O2模型组和棉酚处理组加700 μmol/L H2O2处理8 h后,棉酚处理组按浓度换培养液,空白组与对照组更换新培养液,H2O2模型组更换700 μmol/L的H2O2完全培养液,孵育24 h。CCK-8检测。
1.2.2.3 黄芪多糖促进MRC-5细胞APE/Ref-1基因表达 空白组、对照组、H2O2模型组处理方法同“1.2.2.2”,黄芪多糖处理组:将20 mg黄芪多糖溶解,制成浓度为20 mg/ml溶液,设计浓度梯度为100、200、400、800 mg/L。种板后孵育24 h,H2O2模型组和黄芪多糖处理组用700 μmol/L的H2O2处理8 h,黄芪多糖处理组按浓度换培养液,其他组同“1.2.2.2”更换新培养液,培养24 h。CCK-8检测。
1.2.3 CCK-8法检测各组细胞活力 对照组:含完全培养液和细胞;H2O2模型组:细胞和完全培养基培养24 h后换为终浓度为700 μmol/L的H2O2;棉酚处理组:细胞和完全培养基培养24 h后换为终浓度为700 μmol/L的H2O2处理8 h后换为终浓度为20 μmol/L的棉酚;黄芪多糖处理组:细胞和完全培养基培养24 h后换为终浓度为700 μmol/L的H2O2处理8 h后换为终浓度为200 μmol/L的黄芪多糖。CCK-8检测。
1.2.4 Western印迹检测APE/Ref-1蛋白表达情况 实验设计细胞分组及内容同“1.2.3”。细胞接种于12孔板中,每组设3复孔,每孔加约105个细胞,500 μl培养液。培养24 h后弃培养液,用预冷的PBS洗3次,加入蛋白裂解液〔含10%苯甲基磺酰氟(PMSF)、10%蛋白抑制剂〕冰上静置10 min后,在冰上反复吹打,用枪头刮下并吸取至做好标记的EP管中,置低温离心机于12 000 r/min、4℃,离心10 min,取上清液至新的EP管,勿吸取白色黏稠物,加入5倍的上样缓冲液,混匀,煮沸10 min,电泳(80 V、30 min,110 V、1 h),按目的蛋白和内参大小截取胶条,转膜。用浓度为5%的脱脂奶粉封闭1 h后,使用β-actin和APE/Ref-1的单克隆抗体,4℃孵育过夜,用TBST洗涤3次取出膜,室温下敷二抗1 h,TBST洗涤3次,ECL化学发光法进行照相。
1.2.5 免疫荧光细胞化学检测8-OHd G表达 实验设计分为对照组、H2O2模型组、棉酚处理组、黄芪多糖处理组,在每组细胞爬片之后,用丙酮处理固定15 min,加 BSA 封闭液,置于37℃ 水浴孵育1 h,加小鼠抗人8-OHd G抗体(1∶1 000),4℃孵育过夜;37℃复温1 h,PBS洗涤3次;加FITC标记的山羊抗小鼠IgG,37℃避光孵育2 h;用PBS冲洗每次5 min,3次,封片镜检计数。
1.3 统计学分析 应用Graphpad统计软件行方差分析,组间比较采用t检验。
2 结 果
2.1 CCK-8测定结果
2.1.1 H2O2对MRC-5细胞的损伤作用 与对照组(抑制率为0)比较,H2O2导致的细胞损伤有浓度依赖性,且呈正比关系。H2O2浓度为400、500、600、700、800、900、1 000、1 100、1 200 μmol/L时,细胞增殖抑制率分别为(5.2±1.1)%,(10.1±2.4)%,(19.9±4.3)%,(30.7±10.7)%,(50.3±1.1)%,(71.8±4.6)%,(81.9±1.2)%,(84.9±0.7)%,(86.9±0.9)%。由此,本实验建立MRC-5氧化损伤细胞模型时H2O2浓度为700 μmol/L。
2.1.2 黄芪多糖对MRC-5细胞增殖的影响 与H2O2模型组〔抑制率为(37.0±1.1)%〕相比,不同浓度的黄芪多糖都可降低细胞的增殖抑制率,100、200、400、800 mg/L黄芪多糖组细胞增殖抑制率分别为(17.4±1.4)%、(7.7±1.4)%、(23.9±1.7)%、(28.4±1.1)%。当黄芪多糖浓度为200 mg/L处理 MRC-5细胞时,细胞活性最高,细胞增殖抑制率最低。由此,本实验以200 mg/L的黄芪多糖建立MRC-5细胞APE/Ref-1基因表达上调模型。
2.1.3 棉酚对MRC-5细胞增殖的影响 与对照组(抑制率为0)和H2O2模型组〔抑制率为(32.9±6.4)%〕相比,不同浓度下的棉酚对 MRC-5细胞生长均有抑制作用,抑制程度随棉酚浓度升高而增强,棉酚浓度为10、15、20、25、30 μmol/L时MRC-5细胞增殖抑制率分别为:(30.4±6.5)%,(38.4±6.4)%,(48.4±3.8)%,(59.2±1.7)%,(66.1±3.8)%。本实验以20 μmol/L的棉酚处理细胞,建立MRC-5细胞APE/Ref-1基因表达下调模型。
2.1.4 各实验组MRC-5细胞存活率 在H2O2处理24 h后,细胞存活率为41.68%,而相同时间下用棉酚处理后,细胞存活率为15.89%,由引说明,棉酚降低了MRC-5细胞存活率(P<0.001)。同理,相同时间下用黄芪多糖处理后,细胞存活率为68.92%,说明黄芪多糖提升了MRC-5细胞存活率(P<0.001)。见表1。
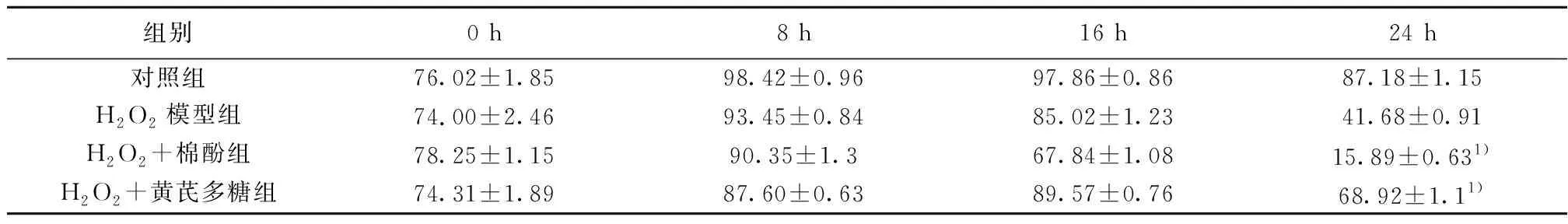
表1 各组MRC-5细胞存活率(%,n=5)
与H2O2模型组比较:1)P<0.000 1
2.2 Western印迹检测 与对照组(0.73±0.05)相比,棉酚处理组APE/Ref-1基因表达量(0.41±0.02)最少,H2O2模型组(0.48±0.03)多于棉酚组,黄芪多糖处理组APE/Ref-1基因表达量(0.77±0.05)接近对照组。见图1。
2.3 免疫荧光细胞化学检测8-OHd G表达 与对照组相比,H2O2模型组8-OHd G的表达明显增高。与H2O2模型组相比,黄芪多糖处理组表达相对减少,棉酚处理组表达相对增多。见图2。
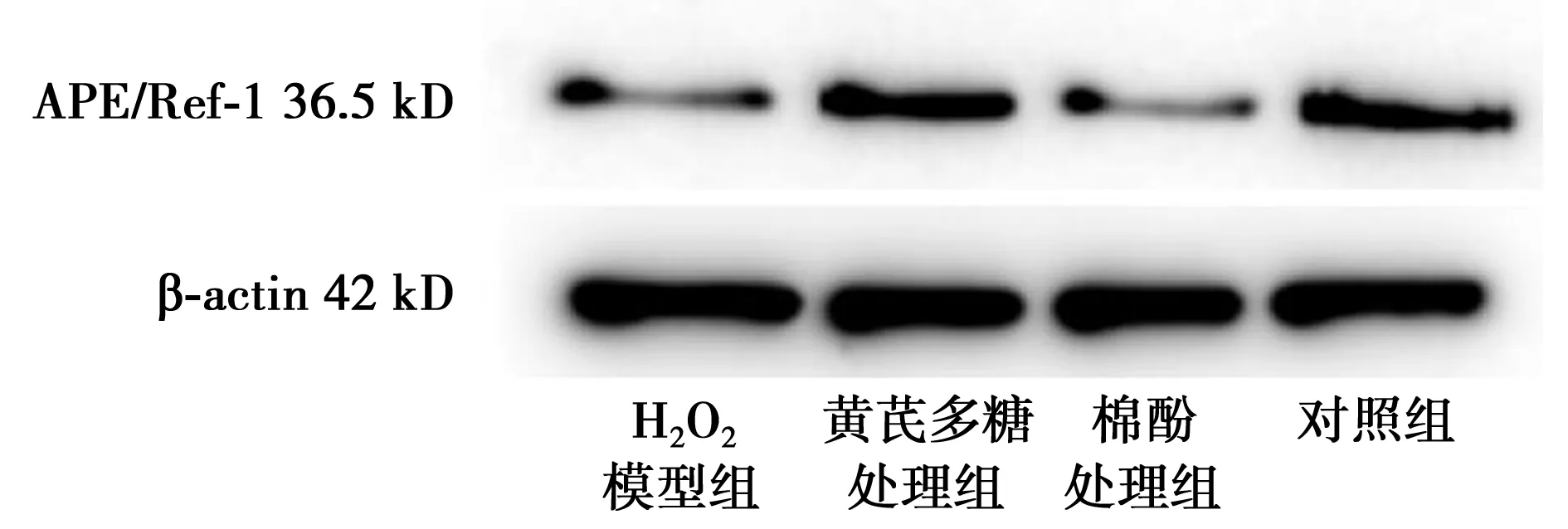
图1 Western印迹法检测MRC-5细胞APE/Ref-1蛋白表达量
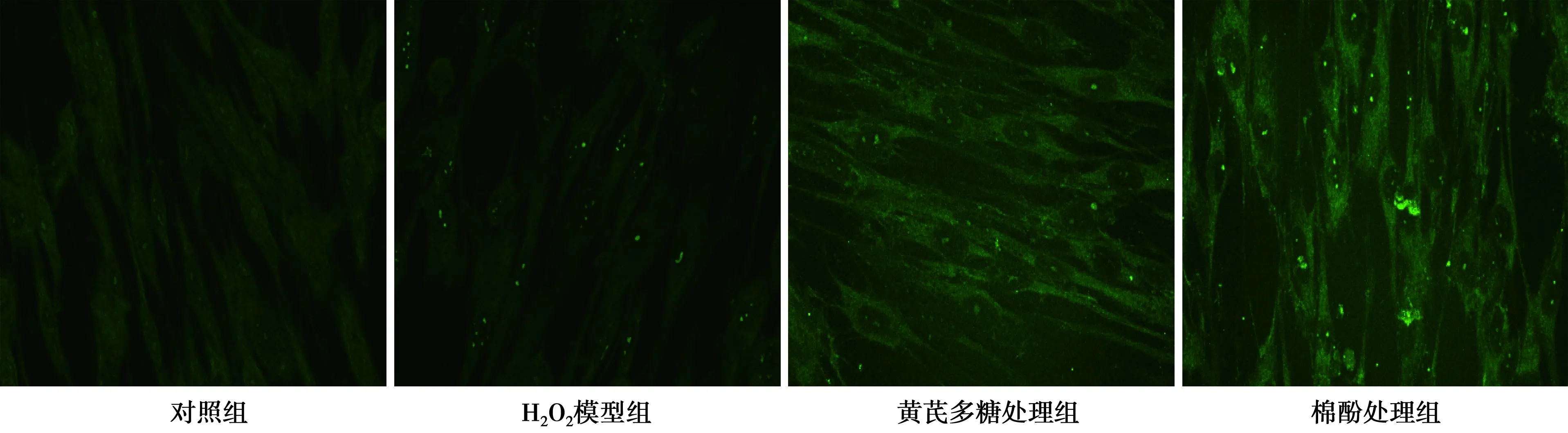
图2 不同处理条件下的MRC-5 细胞 8-OHd G表达(荧光显微镜,×600)
3 讨 论
APE/Ref-1是一类生物大分子蛋白质,存在于各种细胞中,有异质性,可有细胞核、细胞质、细胞核-质三种分布形式〔3〕。在其异常表达或者功能活性改变、分布改变时会导致细胞异常表现,使细胞凋亡,产生肿瘤、衰老等多种疾病反应,因此APE/Ref-1可能是抗氧化药物的潜在靶点〔6,7〕。APE/Ref-1表达的位置变化和(或)高表达与许多恶性肿瘤如肺癌、胰腺癌等癌症的发展和预后有着不可忽视的相关性〔8〕。有文献指出减少细胞APE/Ref-1基因的表达,可以减轻肝细胞的氧化应激反应〔9〕。Biswas等〔10〕证明肿瘤内皮细胞nox-4衍生的H2O2使DNA氧化,诱导APE/Ref-1的表达;抑制APE/Ref-1表达使肿瘤体积减少50%,说明内皮细胞肿瘤的增殖依赖于APE/Ref-1的表达。异常细胞质APE/Ref-1与高级卵巢浆液腺癌的进展和化学抗性有关,预后不良〔11〕。APE/Ref-1介导的SIPR1过表达可能与AngⅡ 引起的血管功能障碍有关〔12〕。Chantre-Justino 等〔13〕发现在膀胱癌晚期患者中,APE/Ref-1等 DNA 修复酶水平高于早期患者,能修复其过剩的氧化应激损伤,促进肿瘤发展。APE/Ref-1基因高表达,能够增强细胞对H2O2、博莱霉素等的抵御能力〔14〕。局灶性脑缺血时存在DNA氧化损伤,且可检测到APE/Ref-1表达下调,导致无法修复损伤DNA,诱导细胞凋亡〔15〕。以上研究都表明,APE/Ref-1高表达可提高细胞活性,抑制细胞凋亡。APE/Ref-1的过表达或其表达部位改变在许多疾病中起着重要的作用。因此,研究机体内APE/Ref-1的表达或探讨其活性的改变可减缓机体内的氧化损伤,也有利于对此类疾病的预防和治疗,在特定部位抑制APE/Ref-1的表达可减缓肿瘤的发生。
机体内自由基的形成会引起氧化损伤从而导致脑动脉粥样硬化、阿尔茨海默病、脑缺血等疾病,这类疾病产生的根本原因是氧化应激与过氧化物的堆积。事实上,身体本身存在去除和修复氧化损伤的能力。如抗氧化酶超氧化物歧化酶(SOD)等可清除体内的自由基;DNA受到损伤时,APE/Ref-1可以作为抗氧化酶起关键作用,切除或修复损伤的DNA片段。有报道表明,大脑暂时性缺血6 h,脑内对缺血有抵抗能力的齿状回颗粒细胞中该基因表达增加〔16〕;APE/Ref-1高水平表达有助于细胞抗缺氧损伤,而低表达APE/Ref-1细胞在缺氧状态下增加了死亡率〔17〕。可见,APE/Ref-1对细胞维持生存及发挥功能有着重要作用。另据报道,APE/Ref-1可能具有减弱H2O2引起大鼠PMVECs产生氧化应激反应的作用〔18〕。APE/Ref-1基因敲除的小鼠在胚胎E3.5 d即死亡〔5〕。以上研究均提示,细胞中的APE/Ref-1表达下降时,细胞产生氧化损伤甚至死亡。但目前以APE/Ref-1为目标靶点研究氧化损伤性疾病的防治却很少。以APE/Ref-1为靶点定向提高其蛋白表达,或者当机体产生氧化损伤时减少、抑制其表达下调可防治氧化损伤性疾病,这对此类疾病的研究将具有重要的科学意义。
大量实验表明,氧化损伤可以导致细胞衰老〔19〕。细胞受到氧化损伤时出现细胞增殖抑制、周期阻滞〔20〕导致细胞衰老及死亡。H2O2是产生ROS的主要形式,H2O2对细胞作用迅速,诱导缺氧效果显著,该效果在一定范围内与浓度呈正比。它易于穿过细胞膜,在短期内引发细胞产生各种ROS,迅速引起细胞内物质过氧化、细胞功能紊乱、膜通透性增加甚至死亡〔21〕。因此,本实验选用H2O2处理细胞,建立衰老损伤模型,模拟细胞氧化损伤。
本研究发现,棉酚可抑制MRC-5细胞APE/Ref-1基因的表达;黄芪多糖可促进MRC-5细胞APE/Ref-1基因的表达;低表达APE/Ref-1基因的MRC-5细胞存活率低,高表达APE/Ref-1基因的MRC-5细胞存活率高;APE/Ref-1表达增加可降低MRC-5细胞 8-OHd G的含量。氧化损伤的MRC-5细胞,APE/Ref-1基因高表达可以减弱MRC-5细胞的氧化损伤并抑制其凋亡。因此,靶向APE/Ref-1可以作为预防和治疗氧化损伤的研究新方向,为氧化损伤性疾病、退行性疾病、肿瘤发生的阶段及预后和治疗提供新的靶点,指出了研究的新思路。

