不同剂量氟伐他汀对急性心梗患者血清高迁移族蛋白B1和超敏C反应蛋白的影响*
常 洁 夏中元 黎 梅 赵 博 雷少青 王雅枫
急性心肌梗死是由于冠状动脉粥样斑块破裂导致血栓形成,是冠状动脉血流急性中断的一种疾病。研究认为在动脉粥样斑块和血栓形成过程中,炎性介质发挥了不可忽视的作用[1]。因此控制炎性介质是预防急性心肌梗死的的有效手段之一。高迁移率族蛋白B1(High Mobility Group Protein B1, HMGB1)可诱导炎性因子及黏附分子转录,促使炎性介质不断形成;并能和炎性因子作为彼此诱生因素导致炎症信号持续放大[2]。而C反应蛋白(C-reactive Protein, CRP)能够在非特异性炎症刺激下迅速增多,可对动脉粥样硬化病变的情况进行准确预测[3]。上述两种蛋白的高表达提示心血管疾病病情加重。他汀类药物在一定程度上可以减少斑块局部炎症水平,同时对内皮功能进行优化,对动脉粥样硬化斑块的调控发挥关键作用[4]。氟伐他汀是否可以通过抑制HMGB1和hs-CRP水平进而发挥其治疗作用,尚未有研究报道。因此,本研究拟观察不同剂量氟伐他汀对急性心肌梗死患者血请HMGB1和hs-CRP水平的影响,探讨氟伐他汀对急性心梗患者的治疗效果。
1 资料与方法
1.1 研究对象与分组
收集我院2014-12-2016-04期间由于胸闷、胸痛等症状入院就诊患者,通过冠脉造影明确诊断,并有急诊心肌酶阳性,心电图改变等的相关实验室检查,最终诊断为急性心肌梗死的患者共63例。排除: (1) 风湿性心脏病、心衰、既往心脏手术史的患者;(2) 半年内有手术史或脑卒中患者;(3)电解质紊乱患者;(4) 贫血,Hb<7.0g/L者;(5) 患者有难以控制的出血;(6) 凝血功能异常患者;(7) 造影剂过敏者。在详细询问病史和经过标准化检查后,将各项要求均符合的患者纳入研究。通过随机数字表法将患者分为三组:常规治疗组(常规组)、氟伐他汀小剂量治疗组(小剂量组)、氟伐他汀大剂量治疗组(大剂量组),每组21例。各组一般情况比较,差异无统计学意义(P>0.05),见表1。

表1 三组各21例患者一般情况比较
1.2 治疗方法
常规组患者给予阿司匹林、氯吡格雷、肝素、血管紧张素转换酶抑制剂及β受体阻滞剂常规治疗,小剂量组在常规组治疗基础上,每晚睡前口服40mg氟伐他汀(商品名:来适可,北京诺华制药有限公司提供);大剂量组在常规组治疗基础上,每晚睡前口服80mg氟伐他汀[5];连续治疗三天后检测相关指标。
1.3 血液指标检测
1.3.1 标本收集:全部受试对象于治疗前和治疗3天后采血,采血前禁食禁饮8h以上,采集肘静脉血5ml,4℃下2 000rpm离心20min,取上清,并转移到EP管标记后,于-80℃冰箱中保存。待标本收集完成之后,进行批量标准化检测。
1.3.2 指标检测:HMGB1、hs-CRP采用ELISA法进行测定。HMGB1试剂盒购置于世诺临床诊断制品公司,hs-CRP试剂盒购置于由R&D System公司,仪器为美国Thermo公司Multiskan Ascent 96孔板全自动酶标仪。血脂指标总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)使用奥林巴斯(Olympus-2700)全自动检测生化分析仪检测,试剂为奥林巴斯原装试剂盒。严格按照仪器和试剂说明书操作使用。
1.4 不良反应观察
观察各组患者治疗期间肝功能变化,以及他汀类药物相关的过敏、肌肉疼痛情况。
1.5 统计学处理
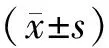
2 结果
2.1 各组患者治疗前后血清HMGB1和hs-CRP水平比较
治疗前,各组患者血清HMGB1和hs-CRP水平差异无统计学意义(P>0.05)。各组患者治疗后血清HMGB1和hs-CRP水平均较同组治疗前降低(P<0.01);与常规组治疗后比较,小剂量组和大剂量组患者治疗后血清HMGB1和hs-CRP水平均降低(t均>6.324,P<0.01);大剂量组治疗后血清HMGB1和hs-CRP水平降低较小剂量组更明显(t均>2.235,P<0.05)。见表2。

表2 各组急性心梗患者治疗前后血清HMGB1和hs-CRP的变化均=21)
注:与同组治疗前比较,1)P<0.01;与常规组治疗后比较,2)P<0.01;与小剂量组治疗后比较,3)P<0.05
2.2 各组患者治疗前后血脂指标水平比较
治疗前,各组患者各血脂水平差异无统计学意义(P>0.05)。治疗后各组患者血脂水平虽较治疗前稍有改善,但差异均无统计学意义(P>0.05)。各组治疗后组间血脂水平差异亦无统计学意义(P>0.05)。见表3。
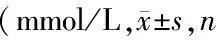
表3 各组患者治疗前后血脂指标水平变化均=21)
2.3 各组患者治疗前后血清HMGB1和hs-CRP与血脂指标水平的相关性分析
三组患者治疗前后血清HMGB1和hs-CRP与血脂指标水平的相关性分析显示,血清HMGB1和hs-CRP与血脂指标TC、TG、LDL-C、HDL-C无明显相关性(P>0.05)。见表4。
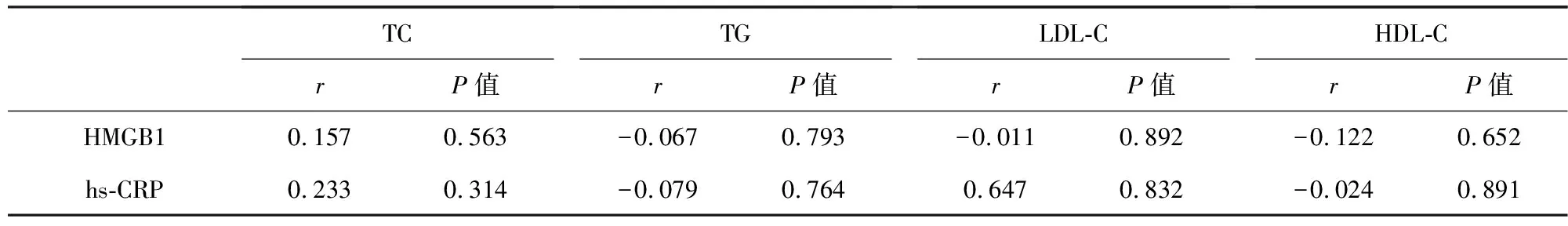
表4 治疗前后血清HMGB1和hs-CRP与血脂指标的相关性分析
2.4 不良反应
观察期间各组患者均未发生肝功能损害,药物过敏以及肌肉疼痛等情况。
3 讨论
动脉粥样硬化是心血管疾病的病理基础,其本质是动脉管壁慢性炎症不断形成的结果[6]。动脉粥样硬化初期主要表现为低密度脂蛋白增加,氧自由基增多,血管内膜功能明显异常,内皮细胞黏附性升高。随着病情不断加重,失活的巨噬细胞和外脂质共同构成纤维帽。研究表明,炎性标志物与患者冠状动脉粥样病情具有非常显著的联系。急性心肌梗死的产生与冠状动脉硬化病情变化具有不可分割的联系,而斑块破裂绝大部分情况下是在冠状动脉粥样硬化的条件下出现的,在这种情况下血小板大量黏附形成继发血栓,导致冠状动脉出现堵塞,进而冠状动脉血供明显降低,心肌缺血失去活力[7]。
HMGB1在人体多个器官表达,一般情况下HMGB1能够对人体内异物进行有效清理,减少异物所造成的损伤,但在趋化因子作用下其可对炎症反应进行应答启动,引起大量炎性细胞浸润,加重损伤[8]。在动脉粥样硬化的初始阶段,多种炎性物质侵入到血管内膜;在晚期,粥样斑块涵盖诸多脂质坏死物质,这些反应均产生了大量HMGB1,其结果是平滑肌细胞不断转移至内膜,导致血管重构[9]。因此,HMGB1逐渐演变为提升动脉粥样硬化速率的关键要素。
CRP是一类急性期反应蛋白,在机体预防体系中发挥关键作用,能与单核细胞、中性粒细胞进行良好的衔接。与此同时,它在动脉粥样硬化的整个历程中起到不可忽视的作用。CRP能够促使巨噬细胞不断吸收LDL,并让单核细胞产生更多炎性因子,在斑块的产生和破坏过程中起到关键作用[10]。对急性心肌梗死的患者而言,CRP提升的速率不断增加。每8h大约增加1倍,在2-4天后达到极限值,2-4周后又回到正常水平。对急性冠脉综合征患者而言,其血hs-CRP>3.0mg/L则死亡率明显提升;若>15.5mg/L其在14天内的死亡率将大幅度增加[11]。
冠心病患者的病情与血清中HMGB1与hs-CRP水平之间存在一定的相关性, 有研究表明, 血清HMGB1 和hs-CRP 在急性心肌梗死患者中有较高的灵敏度和特异度[12]。在治疗冠心病中,他汀类药物的非调脂作用也倍受关注,大量临床研究已证明他汀类药物的应用可减少临床心血管事件的发生率,由于内皮功能失调,使冠心病中的病变斑块由非活动转变为活动状态,引起严重心血管事件[13]。但目前他汀类药物对内皮细胞的作用机制尚未完全明确,大量的随机对照实验发现,他汀类药物具有快速增进内皮功能、抑制损伤部位炎症反应,最终可以稳定动脉粥样斑块、减少血小板血栓形成等作用[14]。也有实验表明他汀类药物可以降低hs-CRP, 降幅达37%, 使心血管事件的发生率降低44%, 显示他汀类药物有较强的抗炎作用, 从而减少心肌梗死的发生[15]。
本研究结果显示急性心肌梗死患者服用不同剂量的氟伐他汀进行治疗之后,40mg治疗组在治疗3天后血清HMGB1和hs-CRP水平较常规治疗组下降,而80mg治疗组治疗后血清HMGB1和hs-CRP水平下降更明显,且其下降水平与血脂成分发生的变化无明显相关性。提示急性心肌梗死患者在使用氟伐他汀之后,在降低血脂水平之前就可以降低血清HMGB1和hs-CRP水平,从而对急性心梗产生一定的治疗效果。
综上所述,氟伐他汀对急性心肌梗死患者在药物使用初期就可能已经获益,其早期治疗作用可能与其抑制炎症反应,提升斑块稳定性有关,与降脂作用不存在明显关联,且80mg剂量疗效更好。

