甲型流感病毒对白细胞介素-35表达的影响*
谢 文 段勇威 鲍腾飞 徐献群
流感病毒能够引发急性上呼吸道感染,由于其传染性强、传播速度快,容易造成局部地区的爆发或全球范围的流行,导致灾难性后果。流感病毒感染激活宿主免疫系统,促进各种炎性细胞因子和其它免疫调节细胞因子的表达[1]。白细胞介素-35(IL-35)是2007年新发现的IL-12家族新成员,是由EB 病毒诱导基因3(EBI3)和IL-12的35kD轻链(p35)两个亚基共价结合形成的异源二聚体,其中EBI3与IL-12的p40亚基同源[2]。本研究拟在临床血清水平和细胞水平探讨流感病毒对IL-35表达的调节作用,为揭示流感病毒致病机理及抗病毒治疗奠定基础。
1 材料与方法
1.1 临床资料
收集本院甲型流感病毒(IAV)感染患者血清标本78例(患者组),其中男33例,女45例,平均32.2±13.5岁,所有IAV感染患者根据临床症状和实验室检测确诊,排除细菌、支原体和其他病毒感染,并且患者此次无用药史。另外选取健康体检人血清标本80例(健康对照组),其中男35例,女45例,平均33.7±14.2岁。患者组与健康对照组间性别、年龄差异无统计学意义(χ2=1.952,t=1.365,P>0.05)。
1.2 病毒株、试剂和仪器
流感病毒株H3N2由中国典型培养物保藏中心提供,M-MLV逆转录酶和Trizol®购自美国Invitrogen公司(批号:15596026);Ficoll淋巴细胞分离液购自上海复申生物科技有限公司(批号:544202),SYBR@GreenER qPCR mix试剂盒购自美国Invitrogen公司(批号:475248),EBI3(批号:14238)和p35(批号:66462)抗体购自美国SantaCruz公司,IL-35检测试剂盒购自上海生工生物工程股份有限公司(批号:099419)。
1.3 方法
1.3.1 细胞分组和处理:细胞实验设置流感病毒感染组和对照组。流感病毒感染组操作如下:采用Ficoll淋巴细胞分离液分离外周血单个核细胞(PBMC),严格按照说明书方法进行,分离后的PBMC用PBS培养液洗涤两次,加入100U/ml 青霉素和100mg/L链霉素,用含10%胎牛血清(FBS)的RPMI 1640培养基培养,待细胞浓度为4×105/ml左右时,用1moi 流感病毒H3N2感染PBMC细胞,置37℃孵箱,5%CO2条件下培养,实验设置3个平行试验。以未感染H3N2的PBMC为对照组,除不以H3N2感染,其余操作同流感病毒感染组。
1.3.2 RT-qPCR检测p35和EBI3 mRNA水平:各组细胞培养24h后,采用TRIzol®试剂提取细胞总RNA, M-MLV在37°C逆转录生成cDNA,再用SYBR@GreenER qPCR mix试剂盒,实时荧光定量PCR检测p35和EBI3 mRNA,GAPDH作为内参。以2-△Ct计算mRNA的相对水平。IL-35检测引物如下:EBI3上游引物:5’-AAG CCC GAC CCT CCA GAA-3’,下游引物:5’-AGC TCC CTG ACG CTT GTA AC-3’。p35上游引物:5’-GCT CCA GAA GGC CAG ACA AA-3’,下游引物:5’-GCC AGG CAA CTC CCA TTA GT-3’。
1.3.3 Western blot 检测p35和EBI3蛋白水平:各组细胞培养24h后RIPA裂解液提取细胞总蛋白质,加入上样缓冲液煮沸。10% SDS-PAGE电泳结束后将蛋白质条带转移至硝酸纤维素膜(NC 膜),用PBST封闭 2h 后,加入EBI3和P35抗体一抗,4℃ 过夜;用 PBST 溶液洗膜,加入辣根过氧化物酶二抗,PBST 溶液洗膜,加入ECL发光液,凝胶成像系统上显影成像。以GAPDH为内参照,目的蛋白与GAPDH蛋白条带灰度值的比值表示目的蛋白的相对表达量。
1.3.4 IL-35水平检测:采用ELISA法检测细胞上清和患者组及健康对照组血清中IL-35含量,操作方法严格按照试剂盒说明书进行,其线性范围为10-500pg/ml,最低检测浓度5.0pg/ml,每个样本重复检测3次,取平均值。
1.4 统计学处理
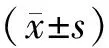
2 结果
2.1 患者组和健康对照组人群血清IL-35表达水平
患者组血清IL-35含量为78.40±28.90pg/ml,明显高于健康对照组(30.60±17.80pg/ml),差异有统计学意义(t=5.264,P<0.05)。
2.2 PBMC细胞IL-35表达水平
RT-qPCR检测结果显示,对照组EBI3和p35 mRNA相对表达量分别为0.75±0.13和0.94±0.17,流感病毒感染组为2.32±0.28和1.83±0.23,明显高于对照组(t均>4.28,P<0.05)。Western blot检测结果显示,对照组EBI3和p35蛋白相对表达量分别为0.56±0.06和0.69±0.10,流感病毒感染组分别为1.25±0.11和1.34±0.13(见图1),明显高于对照组;细胞上清中IL-35含量检测结果显示,与对照组(25.62±6.40pg/ml)相比,流感病毒感染组细胞上清中IL-35含量升高(67.35±9.20 pg/ml),差异有统计学意义(t=4.527,P<0.05)。

图1 Western blot检测IL-35 EBI3和p35 蛋白的表达
3 讨论
流感病毒感染的过程中, 单核/巨噬细胞活化产生众多种类的细胞因子, 它们以网络形式在调节机体的免疫应答和炎症反应中起着重要作用。细胞因子作为天然免疫的一部分, 具有抗病毒和辅助Th1 型免疫应答的作用,同时细胞因子也影响适应性免疫应答和疾病的表现型,流感病毒感染机体过程中会诱导各种炎性因子如环氧化酶-2(COX-2)、诱导型一氧化氮合酶(iNOS)、白细胞介素(IL)-6、IL-27和IL-32的产生[3-5]。 IL-35主要是由 CD4+CD25+Foxp3+Treg 分泌的一种细胞因子,在乙肝患者表达升高,并且抑制乙型肝病病毒(HBV)复制[6]。
本研究探讨了感染对IL-35的调节作用,发现IAV感染的患者IL-35血清学水平明显高于健康体检者,进一步采用体外细胞实验证实了流感病毒感染的PBMC细胞IL-35表达上调。机体感染病毒、细菌和寄生虫等病原微生物后,其免疫系统通过识别入侵的微生物及分泌的细胞因子诱导的免疫应答反应来清除异物,引起局部或全身的炎症反应,在病原微生物致病中发挥了重要作用[7]。
Liu等[3]采用蛋白抗体芯片筛选到流感病毒感染的患者IL-27表达水平升高,证实流感病毒通过COX-2/PGE2-PKA-CREB信号通路来激活IL-27/EBI3启动子,进而诱导IL-27的表达,同时IL-27通过促进抗病毒信号因子信号转导和转录激活因子1(STAT1)/STAT2的磷酸化来激活抗病毒因子蛋白激酶R(PKR),最终反过来抑制流感病毒的复制[3],但流感病毒如何调节IL-35的表达,其具体分子机制有待进一步研究。
最近的研究表明,IL-35通过诱导I型和III型干扰素(IFN)的产生来发挥抗病毒效应[8]。因此,流感病毒感染通过一系列复杂的调控机制来诱导多种白介素如IL-6、IL-27、IL-32和IL-35等细胞因子的表达,而这些细胞因子可以反馈抑制病毒的复制水平,这可能是宿主细胞对抗流感病毒感染时天然免疫保护自己的机制之一。
总之,本研究证实了IAV感染可引起体内IL-35表达升高,为揭示流感病毒的致病机制和抗病毒治疗奠定了一定的基础。

