糖尿病大鼠肾小管间质缺氧诱导因子2α表达变化及氯化钴对其影响*
程 晖 梁 伟 杨英杰 李紫燃 柳 欣
糖尿病肾脏疾病(Diabetic Kidney Disease,DKD)是糖尿病最常见的慢性微血管并发症,也是糖尿病患者致死的主要原因之一[1]。DKD主要病理变化为肾小球基底膜(Glomerular Filtration Barrier,GBM)增厚,肾小球细胞外基质聚集和结节性肾小球硬化[2],还包括肾小管间质损伤,并认为肾小管间质病变是慢性肾脏病预后不良的独立危险因素[3, 4]。
慢性缺氧能诱导肾小管及其间质病变,但机制尚不明确,有研究报道机体缺氧时各组织器官会表达低氧诱导因子(Hypoxia-inducible Factor,HIF),诱导缺氧因子转录,参与细胞低氧应答[5], 其水平变化主要取决于降解速度。HIF由α(1α、2α、3α)亚基和β亚基组成,其中α亚基为调节亚基[6]。HIF部分功能已较明确,如能调节促红细胞生成素(Erythropoietin,EPO)表达而改善贫血[7]。DKD病人通常也会合并贫血,使机体处于慢性缺氧状态[8]。该状态的HIF-1α和肾脏功能变化已见诸报道[9]。而HIF-2α此时在肾组织尤其在肾小管间质的表达情况及对干预糖尿病进展,保护肾功能的作用,所见报道较少。因此,本研究通过制备链脲佐菌素(STZ)2型糖尿病(T2DM)大鼠模型,观察HIF-2α在肾组织及小管间质的表达变化以及同时出现的肾脏间质纤维化、细胞凋亡和EPO水平等的变化,以及HIF降解抑制剂氯化钴(CoCl2)对上述变化的干预作用,为临床进一步探讨DKD治疗新策略提供实验依据。
1 材料与方法
1.1 实验动物、主要试剂及仪器
6周龄雄性SPF级Wistar大鼠(购自湖北省预防医学科学院实验动物中心),体重180-200g。STZ购自美国Sigma公司;水合氯醛和柠檬酸盐溶液购自上海国药公司;兔抗小鼠HIF-2α多克隆抗体购自美国Alpha Diagnostic公司;鼠抗actin单克隆抗体购自美国Santa Cruz公司;HRP-山羊抗兔IgG抗体、HRP-兔抗小鼠IgG抗体、SP免疫组化试剂盒、DAB显色试剂盒均购自北京中杉公司;BCA蛋白浓度测定试剂盒购自美国PIERCE公司;PMSF购自美国Amersco公司;Cocktail tablet购自瑞士Roche公司;光学显微镜购自日本OLYMPUS公司;稳态型血糖仪及血糖试纸购自美国强生公司;低温高速离心机购自美国Beckman公司;Western blot电泳槽、电转槽购自美国Bio-red公司。
1.2 复制T2DM模型及分组处理
24只大鼠按数字随机化原则分为实验组16只和对照组(CON组8只)。实验组每只大鼠均一次性腹腔注射2% STZ溶液2ml(将40mg STZ粉溶于2ml 0.1mol/l柠檬酸盐缓冲液中,将pH调至4.5)诱发T2DM模型,对照组腹腔注射等量柠檬酸盐溶液。72h后取大鼠尾静脉血测血糖,以血糖≥16.7mmol/L确定为T2DM大鼠[10]。16只实验室大鼠均成模。将实验组大鼠随机分为DM组及DM+ CoCl2组(各8只),DM+ CoCl2组采用含0.2mM CoCl2溶液作为饮水进行干预治疗,每只大鼠平均每天摄入1mg CoCl2[11],DM组和CON组用生理盐水替代,共24周。
1.3 检测指标和方法
CoCl2干预结束后,用10%水合氯醛按腹腔注射(300mg/kg)麻醉各组大鼠,剖腹后立即分离肾脏,用4%多聚甲醛固定,常规方法石蜡包埋切片,进行以下指标检测。
1.3.1 免疫组化法检测HIF-2α表达:将石蜡切片脱蜡入水,PBS洗5min×3次;用pH 6.0 柠檬酸盐缓冲液微波修复10min,PBS洗5min×3次;用3%H2O2孵育20min,PBS洗5min×3次;5% BSA封闭30min,甩去BSA后加入对应一抗(HIF-2α多克隆抗体),4℃过夜,PBS清洗5min×3次;加入对应二抗,于37℃湿盒中孵育30min,PBS洗5min×3次;滴加SP免疫组化试剂,37℃湿盒中孵育30min,PBS洗5min×3次;DAB显色、苏木素复染;HIF-2α阳性为棕色,用Image-pro plus 6.0图像分析软件(美国Media cybernetics公司开发)分析,呈色反应平均积分光密度(Mean IOD)值越大,HIF-2α表达越多。
1.3.2 PAS染色观察肾组织病变及肾小球硬化指数(GSI)和间质纤维化指数(IF)评分:取肾组织石蜡切片按常规方法进行PAS染色,观察以下病变:(1)系膜细胞增殖;(2)系膜外基质增多;(3)肾小球节段或全球硬化;(4)间质炎性细胞浸润;(5)肾小管萎缩,细胞外基质增多;(6)蛋白管型。用GSI和IF分别分析肾小球和小管间质病变程度。0分,肾小球和小管间质未见上述病理改变;1分,病变面积<25%,2分,病变面积25%—50%;3分,病变面积50%—75%;4分,病变面积>75%。每张切片分析30个肾小球和20个无肾小球低倍镜视野。
1.3.3 TUNEL法检测细胞凋亡:将石蜡切片脱蜡入水,PBS洗5min×3次;蛋白酶K消化15min,PBS洗5min×3次;3%H2O2阻断30min,PBS洗5min×3次;加入末端核苷酸转移酶和生物素标记脱氧三磷酸尿苷,37℃湿盒内反应1h,PBS洗5min×3次;加入卵白素标记的HRP,在37℃湿盒中反应30min,PBS洗5min×3次;DAB显色,苏木素复染;脱水透明,封片,高倍镜(×200)下观察。胞核呈棕黄色染色者为凋亡细胞。细胞凋亡率=凋亡细胞数/有核细胞总数×100%。每张切片观察30个随机视野。
1.3.4 免疫印迹法检测EPO表达:用RIPA裂解液裂解肾皮质,4℃、13000g离心10min,取上清,BCA法测定蛋白质浓度,取20μg总蛋白进行SDS-PAGE电泳,转膜,5%脱脂奶粉封闭1h,孵育对应一抗,4℃过夜,TBST洗5min×3次,加入对应HRP标记的二抗,室温孵育1h,TBST洗5min×3次,ECL化学发光试剂显色,X光胶片曝光、显影、定影、凝胶成像分析系统行各电泳条带光密度(OD)扫描,采用EPO和β-actin的OD比值表示EPO相对表达量,比值越大,表达水平越高。
1.4 统计学处理
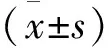
2 结果
2.1 各组大鼠肾小管间质HIF-2α表达
CON组大鼠肾组织无明显HIF-2α表达,DM组大鼠肾组织肾小管间质见散在HIF-2α表达,DM+CoCl2组HIF-2α表达更多(图中棕色区域所示)。Mean IOD比较,DM组较CON组明显增加(0.436±0.106 vs 0.013±0.001,t=3.253,P<0.01),DM+CoCl2组又较DM组显著增加(1.472±0.284 vs 0.436±0.106,t=3.971,P<0.01)。见图1。

图1 各组肾组织间质HIF-2α表达(SP法, ×200)
2.2 各组肾脏病变及肾小球硬化、肾小管纤维化程度比较
CON组肾小球和肾小管及其间质无明显异常,DM组肾小球系膜外基质聚集、系膜细胞轻度增生,肾小管间质区域增宽、细胞外基质聚集;DM+CoCl2组以上变化较DM组明显改善(见图2)。DM组GSI和IF均较CON组显著增高(t=4.34、4.158,P<0.01);而DM+CoCl2组GSI和IF较DM组显著降低(t=3.749、3.172,P<0.01)。见表1。
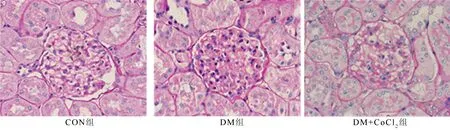
图2 各组肾脏组织学改变及GSI、IF比较(PAS染色,×200)

组别GSIIFCON组0.152±0.0480.184±0.052DM组2.968±0.1591)2.626±0.1641)DM+CoCl2组2.086±0.1712)1.376±0.1352)
注:与CON组比较,1)P<0.01;与DM组比较,2)P<0.01
2.3 各组大鼠肾小管上皮细胞凋亡率比较
CON组未见肾组织细胞明显凋亡,DM组可见部分肾小球周围小管上皮细胞凋亡,DM+CoCl2组凋亡较DM组减少。各组凋亡率比较,DM组较CON组显著增加(15.473±3.064 vs 0.008±0.001,t=5.471,P<0.01);DM+CoCl2组则较DM组显著减少(7.648±2.673 vs 0.008±0.001,t=5.471,P<0.01)。见图3。
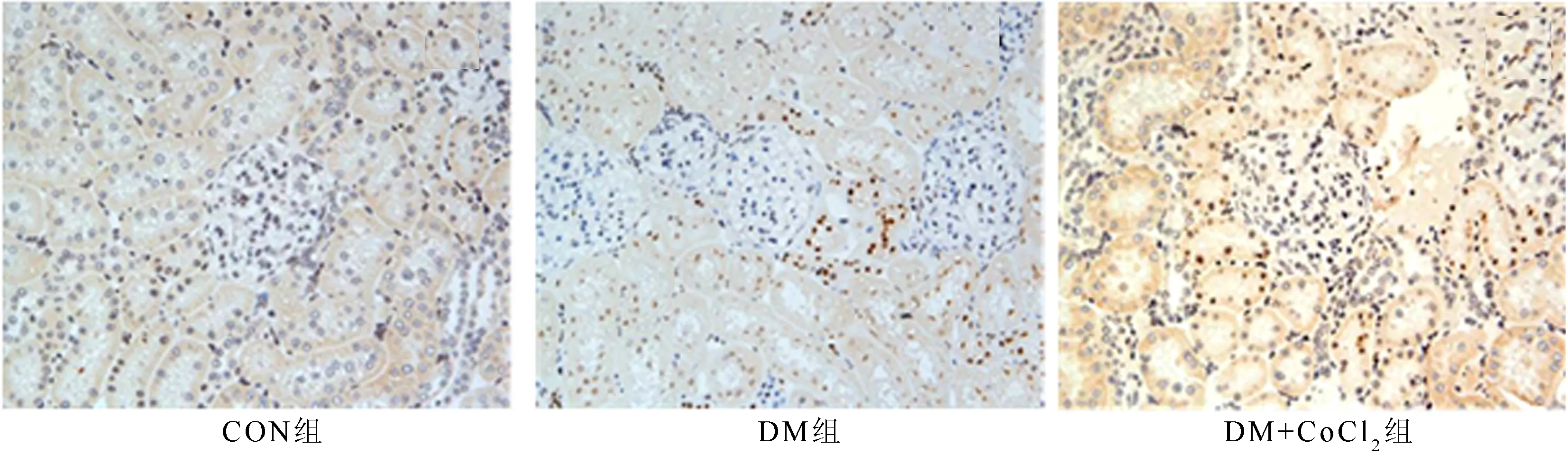
图3 各组大鼠肾小管细胞凋亡率(TUNEL法,×200)
2.4 各组大鼠肾组织内EPO表达水平比较
DM组大鼠肾组织EPO表达水平较CON组显著降低(0.253±0.201 vs 0.741±0.202,t=2.538,P<0.05),DM+CoCl2组EPO水平较DM组显著增加(0.604±0.167 vs 0.253±0.201,t=2.468,P<0.05)。见图4。
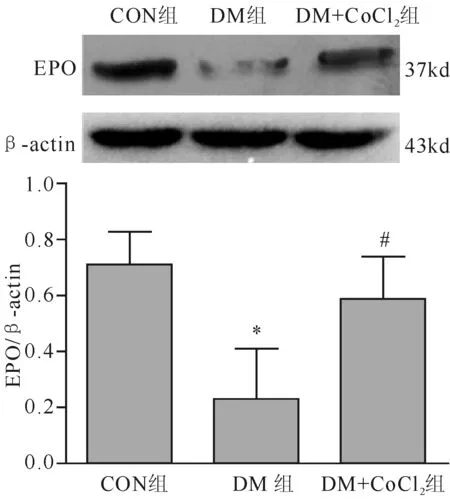
注:与CON组比较,*P<0.05; 与DM组比较,#P<0.05
3 讨论
DKD是导致终末期肾病的主要病因之一,其发病机制尚不明确[12]。传统观点认为其以肾小球损伤为主,但临床观察表明只有近1/3的 T2DM患者表现为典型的肾小球病变,还有1/3的患者不出现或仅有轻微肾小球病变,但这类患者明显存在肾小管间质损伤[13]。因而认为肾脏间质损伤可能参与了DKD的发生与进展。
DM引起的持续慢性缺氧状态对机体多系统均有明显损伤[14],肾脏是主要靶器官之一,HIF作为诱导与缺氧应激反应有关基因表达的主要转录因子,由α亚基与β亚基组成,其中α亚基既是调节亚基,又是活性亚基。HIF-1α在肾脏广泛表达于肾小管上皮细胞,也表达于髓质乳头和内髓部位的内皮细胞和成纤维细胞,其功能作用研究已见诸较多报道。HIF-2α主要表达于肾小球内皮细胞、管周毛细血管内皮细胞和肾间质成纤维细胞[15],其干预慢性低氧肾损伤、保护肾功能作用研究相对较少。本文通过构建T2DM大鼠模型,首先观察T2DM可诱导肾组织表达HIF-2α,使用HIF降解抑制剂CoCl2后发现,HIF-2α的表达显著增加;进一步观察肾组织的病理变化及肾小管细胞凋亡结果,显示DM组大鼠在24周时肾小球区出现系膜外基质聚集、系膜细胞轻度增生以及肾小管间质区轻度细胞外基质聚集,GSI和IF升高,肾小球周围小管上皮细胞明显凋亡,而CoCl2处理组上述病理改变减轻,GSI和IF较DM组降低,肾小管细胞凋亡减少。因此认为,T2DM大鼠肾组织HIF-2α表达增高对机体可能有一定保护作用。
以往研究发现EPO受HIF-1α调节,可促进骨髓造血功能,还可减轻缺氧和毒性物质对肾脏细胞的损伤,从而延缓肾病进展[16]。还有报道采用肾大部切除方法建立慢性肾衰动物模型,给予0.1 mg/kg失效EPO(DPO),6周后观察到肾组织病理变化的改善明显优于生理盐水对照组;且在缺血—再灌注损伤模型的再灌注早期和晚期(再灌注6h后)使用EPO或DPO,均可减少再灌注损伤和肾髓质小管细胞凋亡[17]。表明HIF-1α可能通过上调EPO表达改善肾组织缺血缺氧而对肾脏疾病起到治疗作用。本研究进一步探讨了HIF-2α对T2DM大鼠肾组织EPO表达的调节作用,结果显示DM大鼠肾脏EPO较CON组减少,而CoCl2处理能显著增加肾组织EPO表达。因此认为HIF-2α与HIF-1α作用相似,亦能诱导EPO高表达,增加病变组织的血供和氧供,从而改善和保护肾脏功能。
本实验仅在动物水平进行了研究探讨,其初步结论尚需完善有关实验条件,进一步研究HIF-2α表达变化对T2DM肾小管间质的调节作用及其机制,为临床探讨DKD治疗方法提供理论依据。

