Bobs技术在胎儿染色体异常产前诊断中的应用
刘晓丹 宋勤浩 苗正友 王路明 姜湖铃 杨 莉
浙江省嘉兴市妇幼保健院产前诊断中心(314000)
传统细胞遗传学分析方法是产前诊断的“金标准”,可检测出胎儿染色体数目异常及大片段的缺失、重复、倒位和易位等结构异常,但存在以下不足[1]:需要细胞培养,质控难度大;分辨率有限,无法检出小于5 Mb且有显著临床意义的染色体微缺失综合征;操作要求高,需专业人员进行分析,工作量受限;报告周期长。近几年新推出的细菌人工染色体标记微球阵列(Bobs)技术,可同时诊断5种临床上最常见的染色体非整倍体和9种染色体微缺失/微重复综合征,是一种高特异性的高通量快速产前诊断技术[2]。本文应用Bobs技术对7864份羊水样本进行检测,评估Bobs检测技术在产前诊断中的应用价值。
1 对象与方法
1.1 研究对象
收集2014年8月—2017年9月在本中心进行产前诊断的单胎妊娠孕妇7864例,其指征包括高龄、唐氏血清学筛查高风险、胎儿无创DNA检测结果高风险、不良生育史、胎儿超声结构或软指标异常、染色体病家族史等,孕周为18~24周。本课题经院伦理委员会批准。所有孕妇或家属均签署知情同意书。
1.2 实验室检测
在B超引导下进行羊膜腔穿刺术,抽取羊水25~30 ml,其中20 ml用于细胞培养及G显带染色体核型分析;10 ml用于产前Bobs检测。
1.2.1 Bobs检测 取羊水10ml,2000rpm 离心5min,弃上清,使用QIAamp DNA Blood Mini Kit(美国Qiagen公司)提取胎儿羊水细胞的基因组DNA;以NANO DROP 2000(美国Thermo公司)测定样本基因组DNA的纯度与浓度。按Bobs Assay试剂盒(芬兰Perkin Elmer公司)对基因组DNA进行标记及纯化,与Bobs探针杂交,DNA洗涤以及与报告分子链霉亲和素-藻红蛋白孵育结合,随后根据Luminex200(美国Luminex公司)检测杂交分子的荧光强度,用Bobsoft 2.0版分析软件进行计算分析,生成结果数据。判断标准:正常比值为1.0±0.2,>正常比值提示片段重复,<正常比值提示片段缺失。
1.2.2 G显带染色体核型分析 取20ml羊水,进行离心接种,置于37℃、5%CO2恒温培养箱中培养7d,换液,24h后收获、制片、G显带后核型分析。分析5个以上细胞核型,计数≥10个克隆分裂相,按照人类细胞遗传学国际命名标准2009(ISCN2009)诊断。
1.2.3 全基因组SNP微阵列检测 选用美国Affymetrix Genome cytoScan 750K基因芯片,按操作手册进行DNA的消化、扩增、纯化、片段化、标记信号、杂交、洗片染色及扫描。经Chromosome Analysis Suite(Ch AS)软件对数据进行分析和判断,拷贝数变异的报告阈值缺失为200 kb,重复为500 kb。
1.3 统计学处理
将所有数据输入SPSS20.0软件,染色体非整倍体数目异常及微缺失、微重复异常等计数资料采用例数及百分比表示,组间比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同检测方法对胎儿染色体异常检出效果比较
7864例羊水标本中各类异常(包括染色体非整倍体数目异常及微缺失、微重复异常)共计302例。Bobs检测染色体数目异常256例(含3例嵌合体及2例47,XXY合并 Yq11.223、Yq11.23微重复),与羊水细胞染色体核型分析结果一致(P>0.05);基因芯片未检出数目异常及嵌合体。Bobs检出46例微缺失及微重复异常(含1例等臂X染色体),检出高于羊水细胞染色体核型分析(P<0.05),与基因芯片检出结果一致(P>0.05)。Bobs在检测数目异常+嵌合体及结构异常的灵敏度、特异性和准确性均为100.00%。见表1。

表1 不同检测方法对胎儿染色体异常检出效果比较[例(%)]
2.2 不同检测方法对胎儿染色体异常检出结果比较
染色体核型分析共检出261例异常,其中包括256例数目异常(包括3例嵌合体),均与Bobs结果一致;Bobs检出结构异常47例,基因芯片检测结构异常39例,染色体核型分析检出结构异常5例(包括2例4p-,1例5p-,1例47,XX,+mar及1例等臂X染色体),3种方法比较Bobs和基因芯片方法对染色体异常检出较多。见表2。
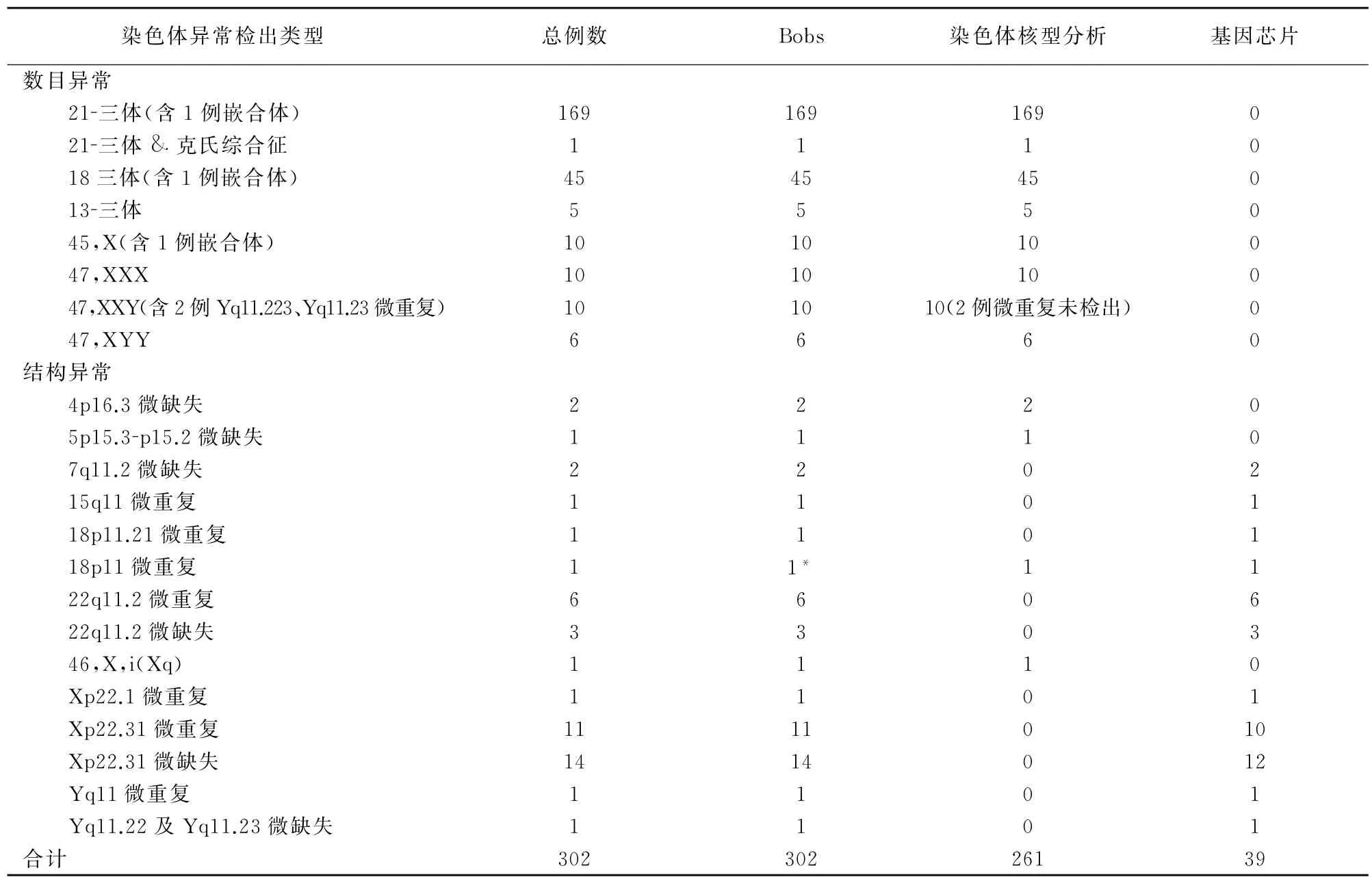
表2 不同检测方法对染色体异常检出情况比较(例)
3 讨论
3.1 G显带染色体核型分析的局限性
G显带核型分析是目前临床最常用的人类染色体核型分析技术,但该方法受到地域、玻片制作、标本年龄和胰酶处理时间等实验条件影响,致使处理显带的效果存在差异,严重者可造成培养失败,一定程度影响了结果的准确性。文献报道,约有16%的病例在G显带染色体核型分析中未检出异常,其中10%可能与胎儿多发畸形相关[3]。本文结果显示,G显带染色体核型分析在分析染色体数目异常及嵌合体方面有较高的准确性、灵敏度和特异性,但难以检测染色体插入结构异常,在46例结构异常中仅检出5例,假阴性率较高。另一方面,G显带染色体核型分析虽然检出异常“微小片段”,但难以判定断裂点,需要复检。近年来,G显带染色体核型分析的改良版即高分辨G显带也应用于临床,虽然该方法可以显示超过2000条的条带,但对检验人员的技术要求较高,实验条件苛刻,难以广泛普及,限制了高分辨G显带的应用[4-5]。
3.2 基因芯片检测的优点
如本文结果显示,基因芯片在检测染色体微缺失、微重复方面具有较高的准确性、灵敏度和特异性,但该方法不能检测平衡易位,难以检出“低比例”嵌合体。同时因其检测成本较高,影响了临床应用[6-7]。
3.3 Bobs技术的优势
通过检测羊水、绒毛和脐带血中提取的DNA样本来诊断13、18、21、X和Y染色体非整倍体数目异常以及9种染色体微缺失综合征。该方法是一种基于微珠的多重检测,目标区域代表基因座,与现有的快速产前诊断方法相比其拥有更大的疾病覆盖区域。
2017年,Gross等[8]前瞻性104例进行了产前Bobs技术临床验证研究,检测成功率达97%。Vialard等[9]应用Bobs技术检测了616例DNA标本,经染色体核型分析比较发现Bobs技术成功率>90%,且具有较高的敏感度、特异度及准确度,嵌合比例>20%时可被检测出[10]。2012年,Vialard等[11]对5家欧洲产前诊断实验室1653例产前诊断样本进行了分析,总体异常检出率为1/10,其中常见的非整倍体异常(21-三体所占比例最高,其次是18-三体)占到了被检测异常的85%,其假阳性率及假阴性率均<1%。2015年,胡珺洁等[12]通过检测10例已知染色体非整倍体异常标本,以及对401例羊水样本进行前瞻性研究,指出Bobs技术是一种可选择的产前诊断新技术。
本研究中各类异常检出率为3.8%,Bobs技术全部检出,对染色体非整倍体数目、微缺失及微重复异常检测的准确性、灵敏度和特异性均为100.0%。其中非整倍体数目异常者均经染色体核型分析比对,结果一致。本研究中有2例核型分析结果为4p-和1例5p-的病例,Bobs结果提示为微缺失综合征,两种检测方法互相印证,充分告知孕妇后接受终止妊娠。由此可见,Bobs技术在检测胎儿染色体异常的产前诊断具有较高的准确性、灵敏度和特异性。在实际工作中发现Bobs技术对探针覆盖范围内的微重复病例亦可检出。本研究中共检出46例不同染色体的微缺失、微重复,这是羊水细胞染色体核型分析无法检测的。充分显示了Bobs技术的优势。有1例核型分析提示47,XX,+mar,Bobs结果为18p11微重复,基因芯片检测结果为18p11.32q11.1(136,227-18,534,784)x4,父母双方外周血染色体正常,孕妇选择终止妊娠。
但Bobs有其技术瓶颈性,不能检测多倍体,对于低比例(<20%)染色体异常嵌合的检出能力有限[13]。本研究中共检出3例嵌合型染色体非整倍体数目异常,而染色体核型分析嵌合比例均>30%。
综上,与G显带核型分析及基因芯片技术相比,Bobs作为一种新的快速产前诊断方法,其检测技术的优点在于其高效性、高通量、快速及覆盖疾病区域广。同时该技术亦有其不足之处,不能检测平衡易位、低比例嵌合,需结合G显带核型分析技术,提高产前诊断染色体非整倍体数目异常及常见微缺失、微重复综合征的检出率。

