不同指征患者胚胎植入前非整倍体筛查的比较
王林玉,施文韬,黄梦楠,师娟子
(1.西北妇女儿童医院转化医学中心,陕西 西安 710061;2.宁夏药品检验研究院,宁夏 银川 750004;3.亿康基因,上海 201499;4.西北妇女儿童医院辅助生殖中心,陕西 西安 710003)
染色体非整倍体是指染色体数目异常。染色体非整倍体是导致胎儿严重智力低下及先天畸形的主要原因之一,在活产新生儿中的发生率约为0.5%[1-2]。目前,尚无有效的治疗方法,一旦患儿出生将给家庭和社会带来沉重的精神和经济负担。植入前遗传学筛查(preimplantation genetic screening,PGS),是在胚胎植入着床之前对早期胚胎进行染色体数目和结构异常的检测,挑选正常的胚胎植入子宫,以期获得正常的妊娠,提高患者的临床妊娠率,降低流产率,预防出生缺陷。同时,由于多次退火环状循环扩增技术—二代测序技术(MALBAC-NGS)的出现,推动染色体异常的诊断技术不断向更精确、更快速的方向发展[3-5]。近年来,有文章报道了双亲染色体异常、反复种植失败和复发性流产(RSA)患者与胚胎非整倍体发生率有关,对此类患者实施PGS均能达到满意的治疗效果,减少了流产率,减少了无效移植次数,提高了妊娠率[6]。基于此,本文就易位、罗氏易位、倒位、非整倍体、Y染色体微缺失、衍生染色体、不良孕产史等其他PGS指征与胚胎非整倍体的关系作初步研究,以期找到更多可以预测非整倍体的指标来辅助临床工作,并提供正确的临床咨询,以使更多患者可以从PGS技术最大获益。
1资料与方法
1.1研究对象与分组
2018年6月1日至2018年11月30日收集西北妇女儿童医院生殖中心288例行PGS患者的胚胎,胚胎培养至囊胚期进行活检,PGS检测采用MALBAC-NGS方法,比较不同年龄段和不同PGS指征胚胎染色体异常率。PGS检测在西北妇女儿童医院转化医学中心完成,所有进入临床PGS周期的患者均签署知情同意书。最终有效检出结果的胚胎数为275枚,以女性年龄为分组依据,分为≤27岁(79例)、28~30岁(82例)、31~33岁(62例)、34~36岁(31例)、≥37岁(21例)共5组。
1.2方法
1.2.1囊胚活检
当囊胚达到活检标准时,在内细胞团对侧用非接触式激光仪在透明带上打孔。完毕后继续将囊胚培养4~6h,使部分滋养层形成疝。活检时,使内细胞团位于固定针一侧,活检针靠近形成疝的外滋养层细胞缓慢回吸,发射激光,直至活检的外滋养层细胞(10个左右)全部脱离囊胚。活检的细胞组织培养液洗涤后放入装有5μL细胞裂解液的PCR管内,离心后在-40℃冻存待检。活检后囊胚冷冻保存。
1.2.2 PGS检测
采用MALBAC方法将待测样本进行单细胞全基因组扩增,向待测样本和对照品的PCR管中分别加入裂解酶,放入设定好参数的PCR仪中,裂解细胞,随后经过预扩增将微量初始模板进行线性扩增,最后经过指数扩增即完成文库构建。将构建好的文库纯化后定量,随后测序文库与引物、dNTPs、DNA聚合酶、引物载体构建“油包水”PCR反应单元后在DA8600测序平台完成NGS测序工作。
1.3统计学方法
所有统计分析采用SPSS 23.0进行。计数资料采用率(%)进行统计学描述,组间率的比较采用χ2检验,不满足χ2检验条件,则采用Fisher确切概率法检验。检验水准α设定为0.05。
2结果
2.1基本数据
PGS共活检288枚胚胎,其中13枚胚胎因质控数据不合格未检出结果,因此有效检出结果的胚胎数为275枚。在这275枚胚胎中,整倍体胚胎数目为141(51.27%),非整倍体胚胎数目为134(48.73%)。在染色体异常的胚胎中以异常染色体数目为1条[57/134(42.54%)]和2条[50/134(37.31%)]最为常见,见图1。若夫妻双方中仅女方染色体异常,则其产生非整倍体胚胎数目为43(59.72%),若夫妻双方中仅男方染色体异常,则其产生非整倍体胚胎数目为59(49.17%),见表1。
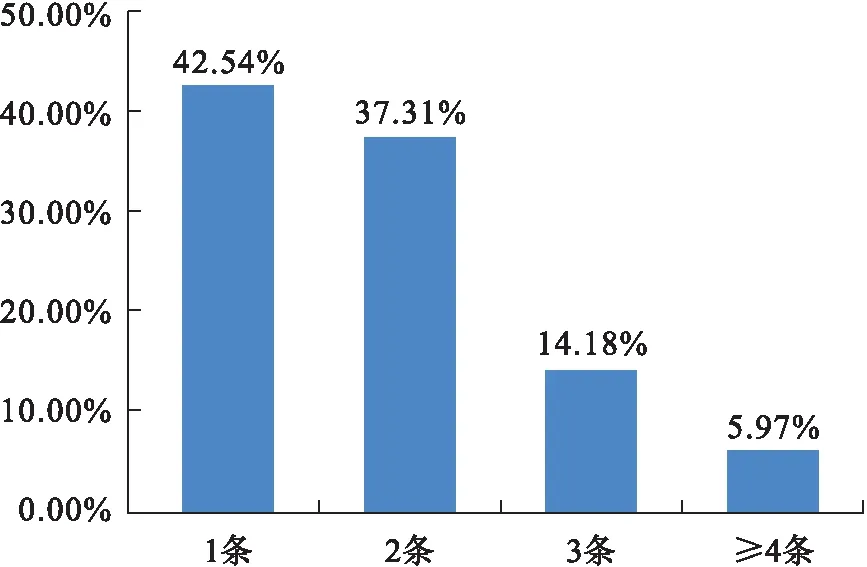
图1 异常染色体数目的发生频率Fig.1 The frequency of abnormal chromosome numbers

表1 不同性别的染色体异常患者胚胎整倍体率和非整倍体率的比较 [n(%)]Table 1 Comparison of the rate of euploid and aneuploidy in patients with chromosomal abnormalities of different genders [n(%)]
2.2不同年龄段女性胚胎整倍体率和非整倍体率的比较
以女性年龄为分组依据,分为≤27岁、28~30岁、31~33岁、34~36岁、≥37岁共5组。总体上看,随着女方年龄的增加,胚胎非整倍体率也随之增加。然而,不同年龄女性患者的胚胎整倍体率与非整倍体率比较无统计学差异(P>0.05),见表2。
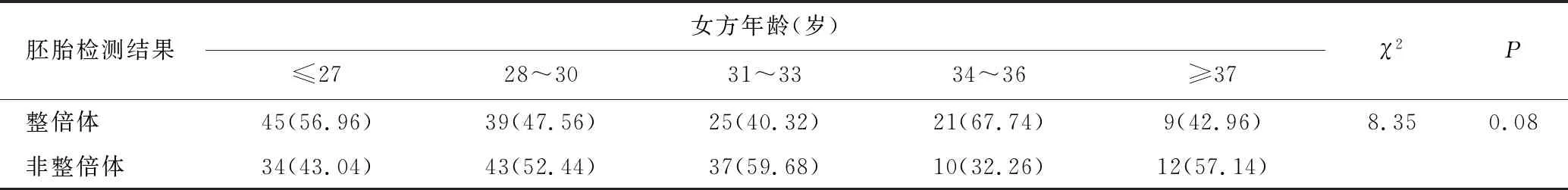
表2 不同年龄段女性胚胎整倍体率和非整倍体率的比较 [n(%)]Table 2 Comparison of the rate of euploid and aneuploidy in different age groups of female [n(%)]
2.3不同PGS指征胚胎整倍体率和非整倍体率的比较
不同PGS指征中,以相互易位(36.84%)和RSA(18.60%)最为常见。PGS指征为染色体相互易位共有105例,其中非整倍体胚胎数目为71个(非整倍体率67.62%);PGS指征为染色体倒位共有3例,其中非整倍体胚胎数目为2个(非整倍体率66.67%);PGS指征为衍生染色体共有9例,其中非整倍体胚胎数目为7个(非整倍体率77.78%);PGS指征为不良孕产史、反复种植失败、RSA分别有28例、9例、53例,其中非整倍体胚胎数目分别为11个(非整倍体率39.29%)、2个(非整倍体率22.22%)、24个(非整倍体率45.28%)。总体上看,平衡易位、倒位、衍生染色体等双亲染色体异常可能更易导致胚胎非整倍体的发生,见表3。
2.4不同PGS指征单个胚胎各染色体数目或结构异常的发生频率
胚胎染色体异常中11、13、14、22号染色体及性染色体异常发生率较高(分别占9.19%、10.95%、6.71%、6.01%、8.83%)。发生染色体相互易位的患者胚胎的11、13、14、22、5号染色体异常率较高(分别占9.52%、16.67%、7.14%、6.55%、6.55%);染色体非整倍体患者胚胎的14、2号染色体异常率较高(分别占19.05%、14.29%);不良孕产史患者胚胎的8、21号染色体异常率较高(分别占17.65%、17.65%);RSA患者胚胎的7、11、16号染色体及性染色体异常率较高(分别占7.90%、13.16%、7.90%、15.79%),见表4。
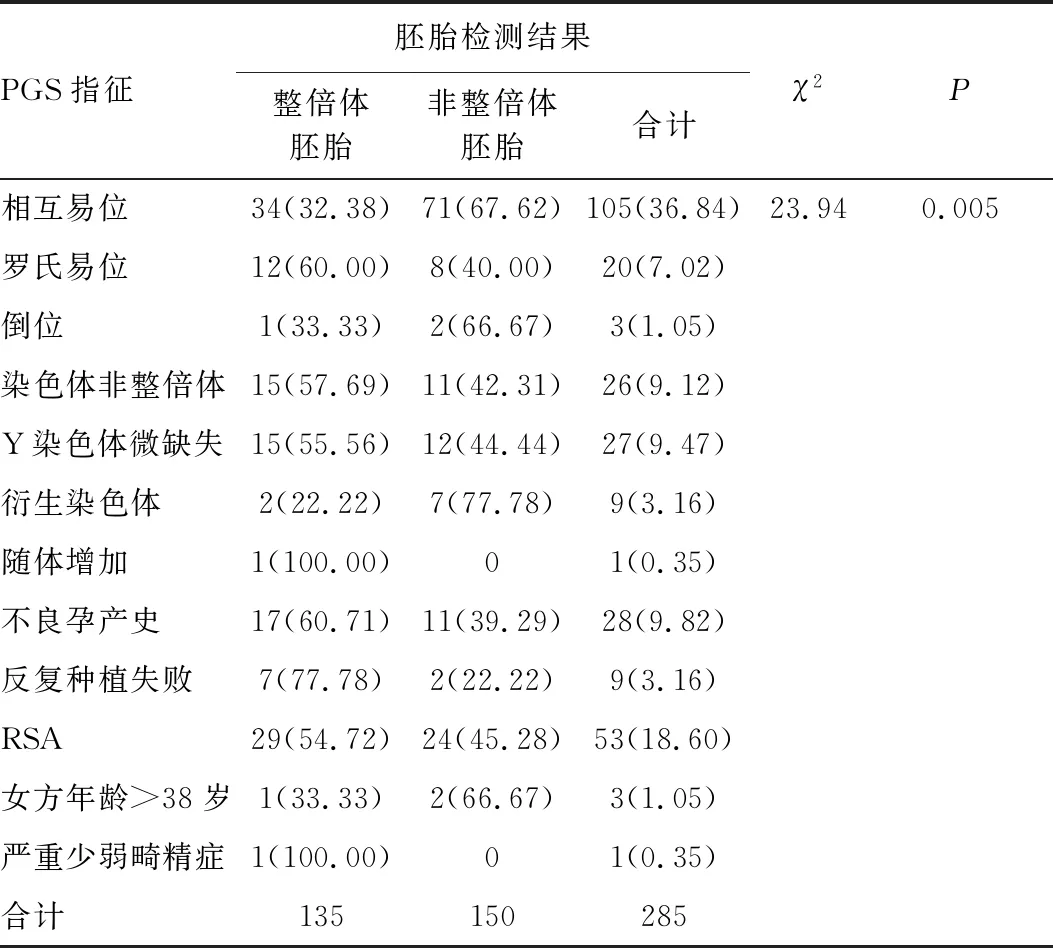
表3 不同PGS指征胚胎整倍体率和非整倍体率的比较 [n(%)]Table 3 Comparison of the rate of euploid and aneuploidy with different PGS indications [n(%)]
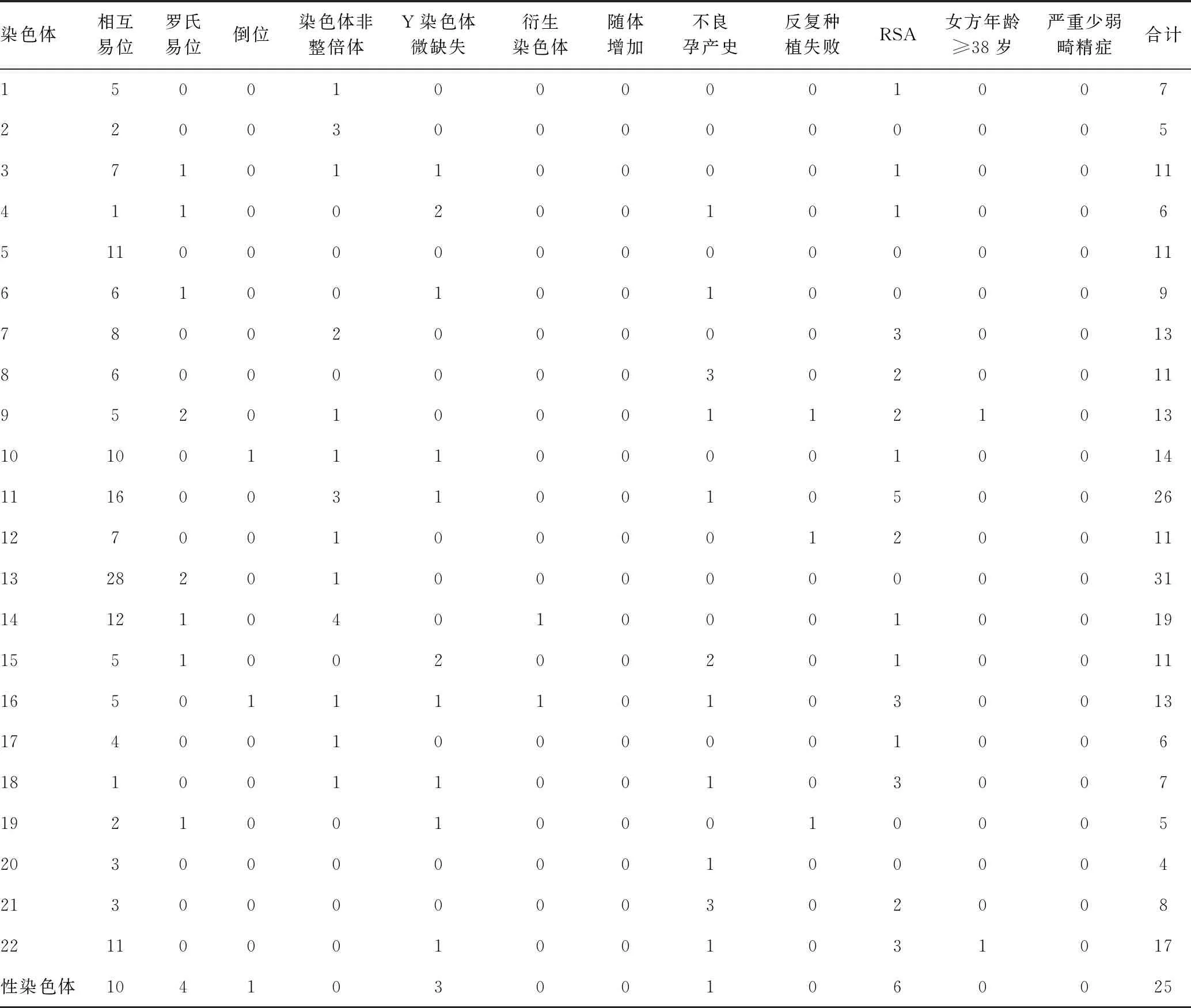
表4 不同PGS指征单个胚胎各染色体数目或结构异常的发生情况 (n)Table 4 Frequency of chromosome numbers or structure abnormal with different PGS indications (n)
3讨论
3.1胚胎的非整倍体
非整倍体是最常见的染色体数目异常,发生于卵母细胞或胚胎,可导致胚胎种植失败、自发性流产和新生儿出生缺陷。据欧洲人类生殖与胚胎学会(ESHRE)10年PGS数据统计,共活检89 373枚胚胎,仅有33%的胚胎染色体正常,适合移植[7]。有研究报道早期自然流产是健康育龄妇女常见的妊娠并发症,占临床妊娠的10%~15%,其病因众多,以遗传因素(尤其是胎儿染色体数目异常)最多见,孕妇年龄是迄今唯一被证实的与胚胎非整倍体的发生密切相关的流行病学因素。此外,研究表明反复种植失败患者可通过PGS获得临床妊娠[8-9]。大约50%的RSA患者没有明确的原因,对流产物的妊娠分析表明染色体非整倍性率很高[10-11]。在向此类夫妇普遍推荐这种治疗之前,需要进行研究以确定哪些患者最有可能从PGS中受益。然而相关的研究很少。因此本文就不同PGS指征的患者与胚胎非整倍体之间的关系作横向比较,以期为临床工作提供一些帮助。
3.2女性年龄与胚胎非整倍体的相关性
本文共检测288枚胚胎,有效检出结果的胚胎数为275枚,其中整倍体胚胎数目为141(51.27%),非整倍体胚胎数目为134(48.73%)。在染色体异常的胚胎中以异常染色体数目为1条(42.54%)和2条(37.31%)最为常见。女方染色体异常者胚胎非整倍体率较高(59.72%),这提示我们,女方染色体异常可能更易引起胚胎染色体异常。
以女方年龄分组后,总体上看,随着年龄的增加,胚胎非整倍体率也随之增加。34~36岁及≥37岁组的样本数相对较少(分别为31、21例),这可能也是造成其非整倍体率较低的原因。
3.3不同PGS指征与胚胎非整倍体的相关性
在不同PGS指征中,以相互易位和RSA最为常见。不良孕产史、反复种植失败、RSA患者产生的非整倍体胚胎数目分别为11个(45.16%)、2个(22.22%)、24个(45.28%);平衡易位、罗氏易位、倒位、非整倍体及衍生染色体患者产生的非整倍体胚胎数分别为71个(67.72%)、8个(40.00%)、2个(66.67%)、11个(42.31%)和7个(77.78%)。双亲染色体异常可能更易导致胚胎染色体异常,不良孕产史、RSA、Y染色体微缺失患者的胚胎非整倍体率也近乎50.00%。这提示我们在临床上遇到此类患者要尽可能推荐其做PGS,筛选出正常的胚胎,进而获得较好的妊娠结局。
同时,由于现代分子生物学的发展,运用于PGS的遗传学分析技术也在不断更新。本文所采用的MALBAC-NGS技术,对单细胞全基因组扩增采用的是多次退火环状循环扩增技术(multiple annealing and looping-based amplification cycles,MALBAC)这一全新的全基因组扩增(whole genome amplification,WGA)方法,采用特殊设计的引物,对整个基因组实现高效而又均衡的全扩增[12-13]。且其作为一项高通量、高度自动化的可用于染色体非整倍体筛查的技术,在精确度、灵敏度、特异性、分辨率等方面都有表现不凡的优势。

