牛乳酪蛋白体外模拟消化液的ACE抑制活性及其肠道吸收
薛海燕,薛丽欢,贺宝元,王战勇,许淼,白文卿
(1.陕西科技大学食品与生物工程学院,陕西西安 710021)(2.陕西科技大学轻工科学与工程学院,陕西西安710021)(3.中央储备粮西安大明宫直属库,陕西西安 710016)
近年食源性活性肽成为食品功能因子研究的热点,主要研究经过体外可控酶解是否会产生活性肽及活性肽在体外的生理功能。酪蛋白是牛乳中主要的蛋白质,而牛乳酪蛋白中包含多种人体必需的氨基酸[1]。据报道,酪蛋白经水解可产生如 ACE抑制肽、抗氧化肽、抗疲劳肽等功能肽段[2],在众多的生物活性肽中,具有降血压活性的血管紧张素转化酶抑制剂(Angiotensin I-converting enzyme inhibitor,ACEI)已经成为研究热点[3]。人体胃肠道存在丰富的胃蛋白酶和胰蛋白酶,对酪蛋白具有消化作用,如张艳等[4]采用胃蛋白酶水解酪蛋白发现可获得多种 ACE抑制肽片段,且具有较强的 ACE抑制活性,可发挥较好的抗血压升高作用;夏镇波[5]采用胃蛋白酶、胰蛋白酶分别在各自最适条件下水解酪蛋白,均可获得 ACE抑制肽;Maruyama等[6]使用胰蛋白酶水解牛乳酪蛋白,在水解液中得到三种降血压的二肽其肽段分别为:PP、RP及AH;在胃肠生理环境下,其水解物中是否存在 ACE抑制肽,使酪蛋白除营养功能外也具有降血压的功能有待研究;另外酪蛋白胃肠水解产生的ACE抑制肽要能被人体肠道以完整的形式吸收,才能发挥其相应的生理功能,Annamaria Perna等[7]通过体外胃肠模拟水解酪蛋白对抗氧化和血管紧张素转换酶(ACE)抑制能力进行研究,表征 ACE抑制和抗氧化能力在体外胃肠消化期间活性增强。本文采用荧光标记对其肠道吸收进行了初探。
本研究通过体外模拟胃肠消化牛乳酪蛋白,检测不同水解时间水解液的ACE抑制率,并对ACE抑制率最高的样品进行二级质谱分析,鉴定水解液中存在的多肽片段,和已经报道的 ACE抑制肽进行对比,得出牛乳酪蛋白的体外模拟消化液中是否存在 ACE抑制肽;再通过荧光标记牛乳酪蛋白,并对其荧光标记酪蛋白进行模拟消化,通过电泳验证消化物的荧光标记是否稳定;最后利用肠非翻转模型验证荧光标记消化物在肠道的主要吸收部位。
1 材料与方法
1.1 材料与试剂
牛乳酪蛋白、胃蛋白酶、胰蛋白酶、ACE、HHL均为美国sigma公司;乙腈,美国Fisher公司;FITC;SD实验大鼠,西安交通大学医学院动物饲养中心;96孔板,美国康宁公司;透析袋,上海源叶生物科技有限公司;三甲基甘氨酸(Tricine),Fluka进口包装;低分子量标准蛋白质,美国Amresco公司;生理盐水,辰欣药业股份有限公司;N,N-甲叉双丙烯酰胺、丙烯酰胺,汕头光华化学试剂公司。
1.2 实验仪器
高效液相色谱仪,美国Agilent公司;二级质谱仪,美国Thermo fisher公司;冷冻干燥机,北京松源华兴生物科技有限公司;全波长功能读数仪,赛默飞世尔科技有限公司;超滤仪,美国millipore公司。
1.3 实验方法
1.3.1 体外模拟消化牛乳酪蛋白
参照中国药典[8]配制人工胃液及人工肠液,两种消化液均现配现用,在使用之前置于37 ℃的水浴中预热。
1.3.1.1 体外模拟人工胃液消化
准确称取20 g酪蛋白,将其充分溶解于1000 mL pH 9.5的PBS中,用4 mol/L的HCl调节溶液的pH至2.0,置于37 ℃水浴振荡器中10 min。按照E/S=1:50加入40 mL人工胃液,分别在0 min、15 min、30 min、45 min、1 h、2 h、3 h、4 h、5 h取样50 mL,2 h 取样500 mL,在沸水中加热10 min后调节消化液的pH至7.0,将酶灭活,所得样品置于-20 ℃的冰箱中备用。
1.3.1.2 体外模拟人工肠液消化
配制500 mL 20 mg/mL酪蛋白溶液,置于37 ℃水浴振荡器中10 min。按照E/S=1:50加入20 mL的人工肠液进行消化,分别在0 min、15 min、30 min、45 min、1 h、2 h、3 h、4 h、5 h取样50 mL,沸水中加热10 min,储存条件同上a。
1.3.1.3 体外模拟胃肠联合消化
取经过体外模拟胃消化2 h的样品450 mL置于37 ℃水浴振荡器10 min,加入人工肠液20 mL,其余操作同上b[9]。
1.3.2 酪蛋白水解度(DH)的测定
采用茚三酮法[10]测定酪蛋白模拟胃肠消化过程中水解度变化,水解度的计算公式如下:

式中,h:水解后每 g蛋白被裂解的肽键的毫摩尔数(mmol/g);htot:为原料蛋白质肽键(mmol/g),牛乳酪蛋白 htot为8.3 mmol/g。
1.3.3 水解液ACE抑制活性的测定
由于动物实验测定 ACE抑制率的可操作性和重复性较差,本实验采用ACE体外活性的检测方法[4]。将200 μL 5 mmol/L的HHL与100 mL酪蛋白水解液进行混匀,在37 ℃预热3 min后加入20 μL 0.1 U/mL ACE溶液,在37 ℃下反应30 min后加入250 μL的HCl终止反应。然后再加入1.7 mL的乙酸乙酯,手动振荡15 s后,静置5 min,然后用移液枪吸取1 mL上层乙酸乙酯到指定试管中,并在120 ℃的烘箱中烘干,取出后加入3 mL的超纯水,并于228 nm处测定其吸光度,ACE抑制率计算公式为如下:

式中:A为反应中ACE抑制剂和ACE同时存在的吸光度;B为反应中不加抑制剂的吸光度,即对照;C为ACE和HHL空白反应的吸光度,即空白。
1.3.4 水解液的LC-MS/MS检测
从BL侧收集到的样品,通过0.45 μm的滤膜过滤,用Spe柱对样本进行除盐处理,用80%乙腈洗脱,然后真空抽干;最后再用30 μL 30%乙腈重溶,进行质谱鉴定。
1.3.4.1 液相参数
色谱柱信息:(300 μm i.d.×5 mm,5 μm) RSLC C18;流动相A:0.1%甲酸,流动相B:0.1%甲酸,80%乙腈;流速:300 nL/min;每个组分分析时间:60 min。洗脱条件如下:0 min:B相5%;5 min:5%;50 min,B相90%;55 min,B相90%;58 min,B相5%;60 min,B相5%。
1.3.4.2 质谱参数
分离后的肽段进入质谱仪 Thermo Scientific Q Exactive进行在线检测,具体参数如下:一级质谱参数Resolution:70000;AGC target:3e6;Maximum IT:40 ms;Scan range:50 to 750m/z(3号样本),50 to 1800m/z(1号样本)。二级质谱参数;Resolution:17500;AGC target:1e5;Maximum IT:60 ms;TopN:20;NCE/stepped NCE:27。
1.3.4.3 数据库检索
质谱原始文件经过MM File Conversion软件处理转换,得到MGF格式文件,然后用Mascot软件检索。
1.3.5 荧光标记牛乳酪蛋白[11]
称取牛乳酪蛋白20.0 g,溶于1000 mL pH 9.5的PBS缓冲液中,超声30 min后于磁力搅拌器上搅拌1 h至酪蛋白完全溶解,向酪蛋白溶液中添加0.2 mg的FITC,超声30 min后于磁力搅拌器上搅拌1 h,静置于4 ℃冰箱中反应24 h,调节其pH至4.6,5000 r/min离心弃去上清液,除去没有与酪蛋白结合FITC,将样品再次溶解,通过 1 ku的超滤膜超滤再次去除残留FITC,此过程重复三次,使用透析袋透析24 h,每4 h换一次透析液,宽度36 mm,MW:8000~14000,将所得样品进行冷冻干燥后,保存于4 ℃的冰箱中。
1.3.6 SDS-PAGE分析FITC-酪蛋白水解液
FITC-酪蛋白的体外模拟消化具体过程见 1.3.1。取 200 μL不同消化时间水解液与同体积样品缓冲液进行混匀,在100 ℃加热3 min后置于离心机上离心5 min,备用。
1.3.6.1 水解液SDS-PAGE电泳检测[12]
分别配制12.5%和15%的分离胶,以及3%的浓缩胶,分析单胃和单肠的水解样品。上样量为10 μL。溴酚蓝进入上层胶时电压设置为50 V,待溴酚蓝到达下层胶时电压设置为150 V,当溴酚蓝到达距胶底1 cm时结束电泳,使用考马斯R-250染色1 h,最后脱色至背景干净。
1.3.6.2 水解液Tricine-SDS-PAGE电泳检测[13,14]
经过胃肠联合水解后样品的分子量在7 ku以下,用SDS-PAGE已不能分辨水解样品,因此采用分辨率更高 Tricine-SDS-PAGE电泳进行分析,胶的浓度为16.5%分离胶,10%夹层胶,4%浓缩胶。溴酚蓝在上层胶和夹层胶时电压设置 60 V,到达分离胶时设置140 V,当溴酚蓝到达距胶底1 cm时结束电泳,剥胶后浸泡在固定液(50%乙醇和 10%乙酸)中固定 30min,考马斯R-250染色1 h,脱色液脱色至背景干净。
1.3.7 FITC-酪蛋白水解液在肠非翻转模型中的通透性检测
台氏液配制见参考文献[15]。
将购得6只SD雄性大鼠适应性饲养一周,体重250 kg±20 kg,实验前禁食24 h,可自由饮水,向腹腔注射10%的水合氯醛1.5 mL进行麻醉,3 min后夹住老鼠脚趾,没有知觉方可进行解剖,打开腹腔,取出小肠,剥离小肠上的粘附物,分别取十二指肠、空肠、回肠、结肠各5 cm,用针管吸取台氏液缓慢冲洗四节肠段,直到没有内容物流出,一端扎口,向肠囊内添加0.5 mL 20 mg/mL的FITC-酪蛋白,放入小烧杯中,加入10 mL的台氏液,此过程快速进行,避免肠道失去活性[16]。实验过程在 CO2细胞培养箱中进行,保持37 ℃恒温,并通入95%O2和5%CO2。分别在0 min、30 min、60 min、90 min、120 min取样200 μL,并补加相同体积的台氏液。吸取100 μL的各个样品于96孔板中,使用全波长功能读数仪于最佳波长处检测样品的荧光强度。待实验结束时,测量所用各个肠段的长度,用剪刀将肠道剪开,测定其宽度后,计算出肠道的面积。
肠囊非翻转模型中 FITC-酪蛋白的表观渗透系数Papp[17]用如下公式计算:
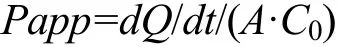
式中:dQ/dt为以FITC-酪蛋白累积吸收量对时间作积分;A为肠段的面积;C0为肠囊外FITC-酪蛋白的初始浓度。
1.3.8 数据统计分析
用Origin软件作图并用SPSS 9.0进行统计学分析。
2 结果与讨论
2.1 酪蛋白水解度(DH)的变化
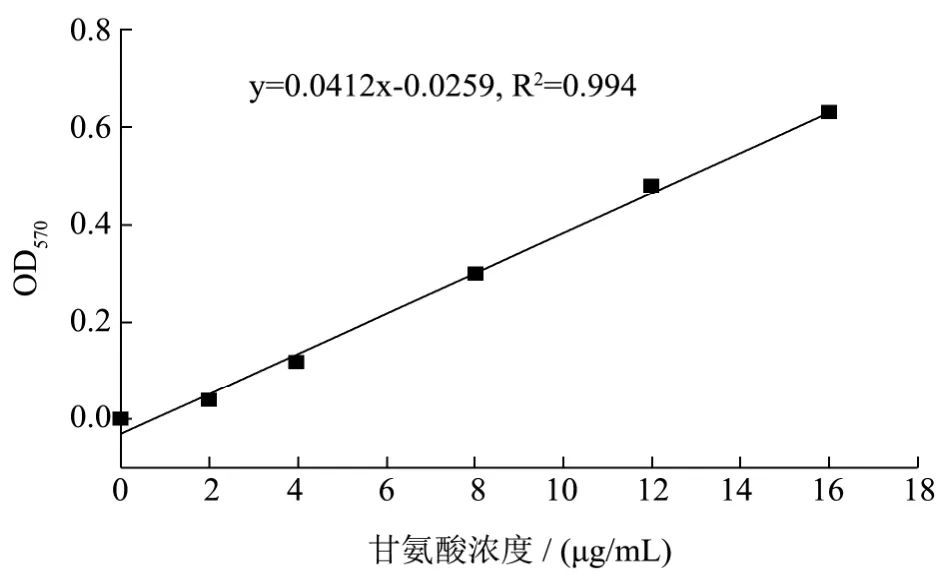
图1 甘氨酸的标准曲线Fig.1 The standard curve of glycine

图2 消化时间对水解度影响Fig.2 Effects of digestion time on the degree of hydrolysis
从图2中可知,随着水解时间的延长,三种消化液的水解度均明显增加,在反应开始1 h内,酶切位点较多,酪蛋白被很快水解,水解度迅速增加,胃消化、肠消化和胃肠联合消化分别增加了5.19%、12.85%和19.15%。1 h后随着酶切位点减少,蛋白酶的活性达到饱和,水解度增加缓慢。三种消化方式中,胃肠联合消化产生水解度最高为25.51%,其原因是两种酶消化使得酪蛋白的酶切位点增加,因此其水解度最高。庞广昌等人研究表明:蛋白经过人体消化不仅可以产生氨基酸为人体提供营养,还会产生小分子的功能肽,这些功能肽进入人体,可对发挥其相应的生理功能[18]。因此将水解液的生理活性进行进一步的分析。
2.2 酪蛋白水解物的ACE抑制率分析
由图3可知,单胃和单肠消化的ACE抑制率均随着水解时间的延长先快速增加,随后逐渐降低;而胃肠联合的ACE抑制率则是先降低再增加,在2 h时,ACE抑制活性达到最高值68.03%,其ACE抑制率明显高于两种单独消化方式,说明联合消化有利于产生更多具有 ACE抑制活性的肽段,并且经过联合消化后也可使消化物中活性肽的分子量大大降低,这有利于活性肽进入体内发挥其降血压的功效。人工胃液消化物的 ACE抑制活性明显高于人工肠液的消化物,这是由于人工胃液主要作用于 Phe-,Glu-,Leu-疏水氨基酸,而C末端为Phe-,Glu-,Leu-,Pro-等时具有较高的 ACE抑制活性[19]。李东平[20]等人通过酶解水牛乳蛋白制备 ACE抑制肽也得出胃蛋白酶酶解产物ACE抑制率较胰蛋白酶等五种酶的酶解产物高。

图3 消化时间对ACE抑制率的影响Fig.3 Effects of digestion time on the ACE inhibition rate
2.3 酪蛋白水解物的LC-MS/MS结果分析

表1 2 h胃肠消化液与αs1-酪蛋白的二级质谱检测结果Table 1 Detection results of 2 h gastrointestinal digestive juices with αs1-casein by LC-MS/MS

9.57 HPIKHQGLPQEVLNENL 6.96 PMIGVNQELAYFYPEL 8.12 HPIKHQGLPQEVLNEENLL 5.66 FVAPFPEVF 5.53 FYPELFR 9.33 APFPEVFGK 6.16 RYLGYLEQL 7.07 AYFYPELFR 7.56 FVAPFPEVFGK 4.73 YPELFRQFY 4.86 RYLGYEQLLR 5.34 HIQKEDVPSER 6.15 HQGLPQEVLNENLL 6.34 HPIKHQGLPQEVNENL 6.96 EPMIGVNQELAYFYPEL 5.91 HPIKHQGLPQEVLNENLLR

表2 2 h胃肠消化液与β-酪蛋白的二级质谱检测结果Table 2 Detection results of 2 h gastrointestinal digestive juices with β-casein by LC-MS/MS
通过对2 h胃肠模拟消化酪蛋白的消化液进行二级质谱分析,其结果见表1~表4,从表中可知牛乳酪蛋白中αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白及κ-酪蛋白被胃肠消化后分别产生的多肽片段数目为32个、6个、24个及7个,其中最短的有6个氨基酸,最长的有20个氨基酸。
从β-酪蛋白的表中分析发现这四个多肽片段LHLPLPL、YPVEPFTESQ、VIPPFLQPEVM、SLVYPFPGPIPN是水解后的主要存在形式。αs1-酪蛋白水解后的主要片段有 LGYLEQL、APFPEVFGK、AYFYPELFR、HQGLPQEVLNENL。

表3 2 h胃肠消化液与αs2-酪蛋白的二级质谱检测结果Table 3 Detection results of 2 h gastrointestinal digestive juices with αs2-casein by LC-MS/MS

表4 2 h胃肠消化液与κ-酪蛋白二级质谱检测结果Table 4 Detection results of 2 h gastrointestinal digestive juices with κ-casein by LC-MS/MS
αs2-酪蛋白和κ-酪蛋白水解后的主要片段如上表3和表4。通过分析上面的主要片段与已经报道的ACE抑制肽[21]做比对发现,模拟消化后可能产生的 ACE抑制肽有 IPP、RYLGY、LHLPLP、AYFYPEL、RPKHPIKHQ及WQVLPNAVPAK。
2.4 FITC标记酪蛋白的标记率检测
FITC可于酪蛋白中的氨基结合形成稳定的共价键,从而实现对酪蛋白的荧光标记。
由图4可进一步知道计算出酪蛋白的荧光标记率为 13.91%,据报道 FITC标记抗体的最大标记率为17.44%[22],对比分析可知本实验的荧光标记率比较高。

图4 FITC的标准曲线Fig.4 The standard curve of FITC
2.5 FITC-酪蛋白在人工胃液及人工肠液中的稳定性分析
由于动物胃肠消化体系比较复杂,酪蛋白经动物空腹胃肠水解后,以多肽形式在肠道内的吸收情况难以检测。因此采取对酪蛋白进行FITC标记后,追踪酪蛋白水解物的吸收,而在动物体内是否能稳定标记就需通过体外实验进行初步验证。体外模拟胃肠消化FITC-酪蛋白,对其水解液用SDS-PAGE电泳进行分析。电泳分析的条件如下:人工胃液和人工肠液消化1 h以内样品采用12.5%的分离胶进行分离,2~5 h时采用15%的分离胶进行分离,胃肠联合消化后由于分子量太小,用一般的电泳条件已经不能检测出条带,因此使用Tricine电泳进行分离。
2.5.1 胃液消化物的电泳分析
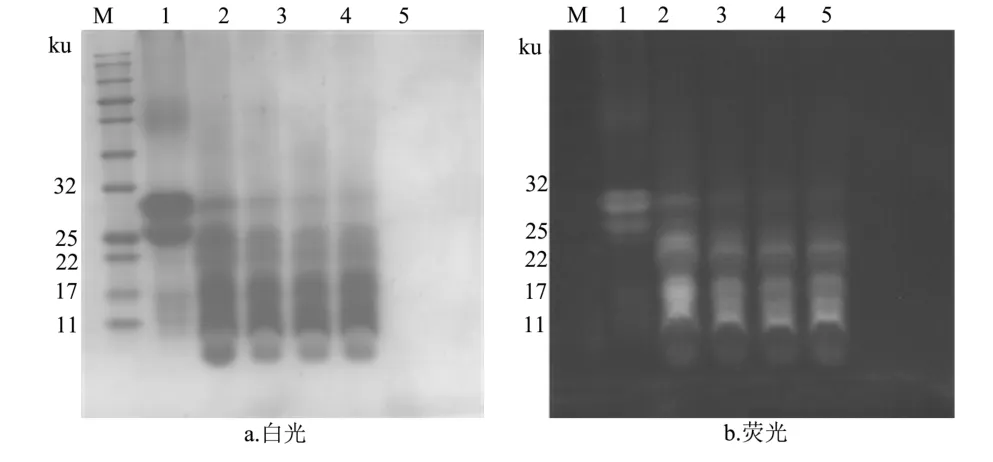
图5 人工胃液消化1 h样品SDS-PAGE电泳图Fig.5 SDS-PAGE electrophoretograms of artificial gastric juice sample digested within 1 h
由图5可知,a图中FITC-酪蛋白的分子量分布于25~32 ku之间,经胃液水解15 min后,大部分的FITC-酪蛋白被迅速分解,蛋白条带的分子量主要集中在25 ku以下,荧光条带在相同位置出现。随着水解时间的延长,分子量在22~25 ku的条带逐渐模糊,而分子量在17 ku条带颜色逐渐加深,且荧光条带随着蛋白条带的迁移而变化。由此说明随着消化时间的延长,FITC-酪蛋白被消化成小分子的蛋白质或多肽,但荧光的标记却依然存在。

图6 人工胃液消化1~5 h样品SDS-PAGE电泳图Fig.6 SDS-PAGE electrophoretograms of artificial gastric juice sample digested from 1 h to 5 h
由图6可知,在胃水解2 h时蛋白条带主要集中在17 ku左右,随着水解的时间的延长,5 h时分子量为17 ku的蛋白条带逐渐变浅,11 ku的蛋白条带逐渐加深,在此过程中,对应的荧光条带也一直清晰,由此说明经过人工胃液消化,FITC-酪蛋白被水解为分子量稍小的蛋白质或多肽且荧光标记依然存在。
2.5.2 肠液消化物的电泳分析
由图7可知,经人工肠液水解15 min后,大部分的 FITC-酪蛋白被水解,蛋白条带主要分布于 17 ku左右,且荧光条带依然清晰。
由图8可知,水解2 h后,蛋白条带主要的分布于11 ku以下,荧光条带在相同的位置出现,随着水解时间的延长,5 h后蛋白条带和荧光条带逐渐变得模糊。由人工胃液和人工肠液电泳结果对比可知,在相同的消化时间内 FITC-酪蛋白更容易被人工肠液所消化。
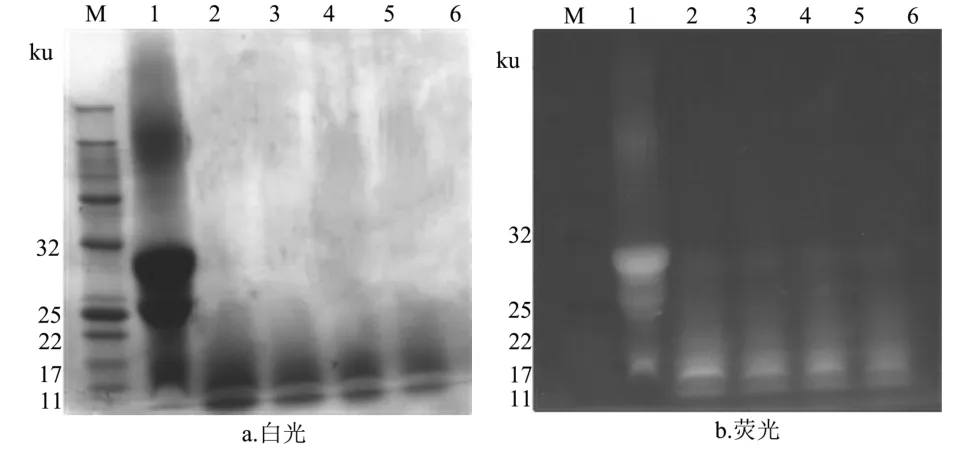
图7 人工肠液消化1 h样品SDS-PAGE电泳图Fig.7 SDS-PAGE electrophoretogram of artificial intestinal juice sample digested within 1 h
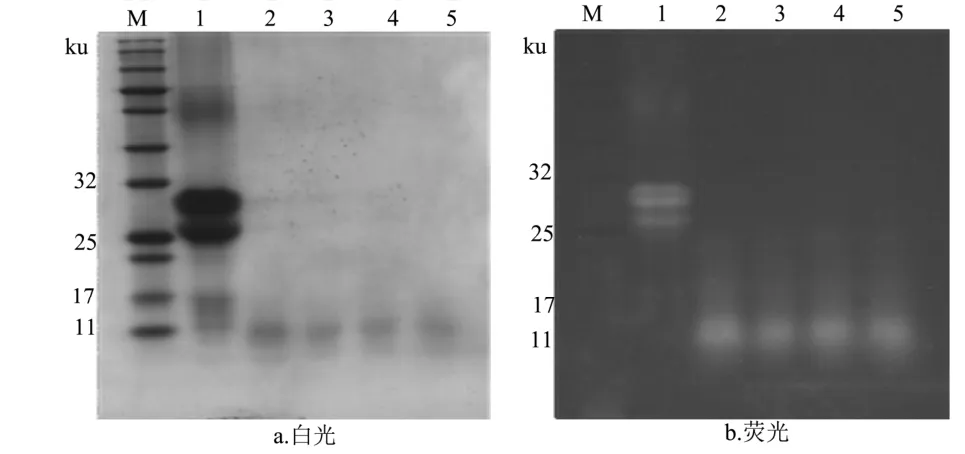
图8 人工肠液消化2~5 h样品SDS-PAGE电泳图Fig.8 SDS-PAGE electrophoretograms of artificial intestinal juice sample digested from 2 h to 5 h
2.5.3 胃肠联合消化物的电泳分析

图9 人工胃肠联合消化15 min~5 h样品Tricine-SDS-PAGE电泳图Fig.9 Tricine-SDS-PAGE electrophoretograms of artificial gastrointestinal juice sample digested from 15 min to 5 h
由图9可知,经过胃肠液消化15 min后,FITC-酪蛋白的分子量主要分布于5 ku左右,经水解2 h后,蛋白条带主要集中于5 ku以下,随着时间的延长,蛋白条带和荧光条带都逐渐变得模糊,且更小分子量的条带没有观察到,可能原因是由于水解产生了分子量太小,难于固定在凝胶中;也可能是因为分子量变小,在染色的过程中不易于染料结合,再经过脱色很容易发生逸散,所以不容易看到条带出现。综合以上电泳结果可知,FITC-酪蛋白经胃肠水解2 h仍保持有较强的荧光强度,可用于动物实验对小分子多肽的肠吸收追踪。
2.6 不同肠段对FITC-酪蛋白水解液的通透性分析
图 10是不同肠段肠囊外液中的荧光强度,在Em=520 nm处均有最大的荧光强度,因此选择520 nm处的荧光强度进行下面实验的分析。由于不同肠段外液中均检测出荧光,可以初步判断,不同肠段均可吸收胃肠消化2 h FITC-酪蛋白水解液,但在不同肠段外液的荧光强度均存在一定的差异。结合图 3~13可知在 2 h时,十二指肠的肠囊外液荧光强度最强为216.12,显著高于回肠和结肠两个肠段(p<0.05),由此说明在2 h时十二指肠对FITC-酪蛋白水解液具有最大吸收作用。而整个吸收过程看荧光强度的变化可知,十二指肠吸收>空肠吸收>回肠吸收>结肠吸收,而该结果与一般药物或食物在小肠的吸收情况基本一致[23]。出现该结果的原因可能是因为P-糖蛋白在十二指肠、空肠、回肠及结肠中的含量依次增加,从而降低了食物在肠道的转运量[24]。张倩利用肠翻转模型检测 FITC-鹿茸蛋白是否可以透过肠道,检测结果为小于45 ku的分子可透过肠粘膜吸收,而酪蛋白水解液的分子量均在5 ku以下,因此也完全有可能通过肠道粘膜被吸收[25]。

图10 胃肠水解液在不同肠段外液的荧光强度Fig.10 Fluorescence intensity of gastrointestinal digestive juices in the different intestines truncation outside liquid

图11 2 h胃肠消化液在不同肠段外液的表观渗透系数Fig.11 Apparent permeability coefficient of 2 h gastrointestinal digestive juices in the different intestines truncation outside liquid
由图11可知,120 min时十二指肠Papp显著高于其它三个肠段(p<0.05),表明FITC-酪蛋白水解液主要在十二指肠被吸收,下来依次为空肠、回肠和结肠,再次验证了 FITC-酪蛋白水解液在整个肠道都能被吸收,且在小肠可能存在特定吸收的部位。FITC-酪蛋白水解液在各个肠段的表观渗透系数均小于Papp<1.8×10-4cm/min,而低于该值表示化合物在体内较难吸收[26],由此推断,与一般化学药物相比,FITC-酪蛋白水解液不易被人体吸收,其原因可能是因为酪蛋白水解液中多肽的分子量太大,受到肠道的屏障作用。
3 结论
综上所述,研究结果表明,通过体外模拟胃肠消化牛乳酪蛋白,随着水解时间的延长,人工胃液消化、人工肠液消化、胃肠联合消化三种消化方式的水解度均随时间的延长而增大,单胃和单肠消化的 ACE抑制率均随着水解时间的延长先快速增加,随后逐渐降低,而胃肠联合的 ACE抑制率则是先降低再增加,胃肠联合消化产生水解度和 ACE抑制率均为最高,使用二级质谱对多肽进行片段鉴定,得出确实存在ACE抑制肽,其多肽片段为IPP、RYLGY、LHLPLP、AYFYPEL、RPKHPIKHQ及WQVLPNAVPAK;体外模拟消化荧光标记酪蛋白,SDS-PAGE和Tricine-SDS-PAGE都表明FITC-酪蛋白经过胃肠消化后荧光标记稳定存在,且水解物的分子量在5 ku以下,并可被大鼠肠道吸收,由肠非翻转模型结果得出酪蛋白消化液主要在十二指肠被吸收,下来,依次为空肠、回肠和结肠。牛乳酪蛋白消化后具有ACE抑制活性,可能发挥一定的生理作用。

