发酵大麦提取物抑制秀丽隐杆线虫的脂肪沉积
程珂,肖香,赵延胜,周兴华,董英
(江苏大学食品与生物工程学院,江苏镇江 212013)
大麦是一种营养丰富并含有多种功能活性成分的谷物,全大麦食品是公认的人类“健康食品”[1]。发酵作为一种传统的食品加工及贮藏方法,在降解食品原料中的有害物质、控制致病菌生长的同时,还通过生物转化产生如维生素﹑多肽、氨基酸﹑有机酸和脂肪酸等多种营养素和功能活性物质[2~4]。大麦是乳酸菌发酵的良好基质,经过乳酸菌发酵后,大麦中多肽、游离酚、可溶性膳食纤维等营养活性成分含量显著提高[5]。Hole等[6]发现不同乳酸菌发酵大麦粉后游离酚酸含量与生物利用率提高,Hong等[7]研究发现乳酸菌发酵大麦饮料可以抑制白色脂肪组织增加,降低血脂及与食欲有关的激素水平,并改善胰岛素敏感性。伍静等[8]发现大麦乳酸菌发酵提取物抑制人结肠癌 HT-29细胞增殖。
秀丽隐杆线虫(Caenorhabditis elegans)是一种重要的模式生物,成虫长度约为 1 mm,身体透明,以大肠杆菌OP50为食。它具有结构简单、繁殖量大且周期短、易于人工培养、方便观察等优点,且脂肪代谢通路比较明确,与人类脂肪代谢通路相似,各关键代谢步骤的酶相似度较高[9]。近年来,食品领域很多研究者也使用该模式生物研究食物成分或提取物的功能活性[10,11],尤其是在调节脂代谢及抗衰老等方面。Gao等[12,13]发现摄入大麦膳食纤维及燕麦制品后秀丽隐杆线虫肥胖模型体脂减少,胰岛素敏感性提高;Finleya等[14]也通过秀丽隐杆线虫模型研究发现了不同豆类减少肠道脂肪沉积的功能。然而,国内外尚未见利用秀丽隐杆线虫肥胖模型研究发酵大麦提取物功能活性的报道。
本文建立秀丽隐杆线虫肥胖模型以研究LFBE的功能活性。通过研究LFBE及其中各组分对肥胖秀丽隐杆线虫脂肪沉积的影响,为进一步研究LFBE干预脂代谢的机制增添佐证,为发酵大麦健康功能食品的研发提供试验依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料
脱壳大麦购自盐城市双增农化科技有限公司;植物乳杆菌(Lactobacillus plantarumdy-1;菌株编号:CGMCCNo.601)实验室自行分离鉴定;秀丽隐杆线虫N2野生型,由东南大学王大勇教授实验室惠赠。
1.1.2 主要仪器与设备
冷冻离心机BR-4,法国JOUAN公司;真空冷冻干燥器,德国Marin Christ公司;体视显微镜,南京江南永新光学有限公司;多功能酶标仪,帝肯(上海)贸易有限公司;正置显微镜Ci-L,尼康光学仪器(中国)有限公司。
1.1.3 试剂
染色液:油红O储备液(购自国药集团化学试剂有限公司)与蒸馏水3:2混合,过0.45 μm膜,现配现用;蛋白质提取缓冲液:10 mmol/L Tris-HCl,pH=7.5,2 mmol/L CaC12;M9缓冲液,NGM培养基,曲拉通X-100(Triton X-100)Sigma-Aldrich公司;其他生化试剂均为分析纯,购自国药集团上海化学试剂有限公司。
1.2 实验方法
1.2.1 样品制备
植物乳杆菌发酵大麦提取物(LFBE)的制备:称取筛分除杂后的新鲜大麦,粉碎后过100目筛,按大麦(m):水(V)=1:7的比例在锥形瓶中混合均匀。每克大麦加入0.25 mL第二次活化后的菌液后再次混匀,密封,32 ℃、150 r/min发酵24 h。4 ℃下8000 r/min离心15 min,取上清液-56 ℃冻干备用。
未发酵大麦提取物(RBE)的制备:大麦与水的比例同大麦乳酸菌发酵液的制备,但不加入植物乳杆菌,密封后处理同LFBE制备。
其中,LFBE与RBE主要活性成分含量分别为:蛋白质含量 34.93%,13.93%;总糖含量 35.44%,64.94%;酚类化合物含量1.10%,0.91%。
1.2.2 总蛋白质制备
采用缓冲液法,称取一定量LFBE,4 ℃下缓冲液(VTris-HCI:V氯化钙=1:1)提取30 min,4000 r/min离心10 min取上清液,重复两次,合并上清液真空冷冻干燥,即得到发酵大麦提取物中总蛋白质。
1.2.3 总糖制备
准确称取LFBE 1 g,溶于25 mL蒸馏水后沸水浴1 h,冷却至室温,4000 r/min下离心10 min收集上清液,定容至50 mL。加入4倍体积无水乙醇,混匀后4 ℃静置过夜,4000 r/min下离心10 min弃上清液,沉淀用数毫升80%乙醇润洗,反复操作3~4次,最后将沉淀用水充分溶解备用。
将上述所得总糖溶液与 Sevage液[V(氯仿):V(正丁醇)=4:1]按1:1体积比混合,振摇10 min,分液漏斗中静置2 h,收集上层溶液,重复操作8~10次,将收集的溶液真空冷冻干燥,得到发酵大麦提取物的总糖备用。
1.2.4 酚类化合物制备
准确称取0.5 g LFBE溶于10 mL水,用6 M的盐酸溶液将pH调至1.3~1.5,再用20 mL乙酸乙酯萃取,重复四次,取有机相合并后旋转蒸发,收集残渣溶于甲醇/水(25:75,V/V)。
1.2.5 平板涂布
配制NGM固体培养基,包括正常固体培养基及含1 mmol/L葡萄糖的培养基。
分别配制3.2 mg/mL的RBE和LFBE溶液为母液。将母液分别稀释0、2、4、8倍,并与活化后的大肠杆菌OP50菌液1:1混合,涂布于含1 mmol/L葡萄糖的培养基上,20 ℃恒温培养箱培养24 h待用。
分别配制960 μg/mL,960 μg/mL 及32 μg/mL 的蛋白质,总糖及酚类化合物溶液(即相当于浓度为3.2 mg/mL的LFBE溶液中三种成分含量的浓度),稀释0,2,4倍后与菌液混合涂布并培养待用。
1.2.6 线虫培养
线虫培养至板上有大量产卵期的成虫,进行同步化,缓冲液M9中孵育至L1期,离心弃上清液,留下约100 μL液体,转移至正常平板,培养至L4期,转入加样平板中培养至成虫。
1.2.7 油红O染色
培养皿中加入S液2 mL,移取线虫至离心管中,3000 r/min离心1 min 30 s,弃上清,重复至少两遍,加入500 μL 60%异丙醇,4000 r/min离心3 min,弃上清,加入500 μL油红O染色液,室温(25 ℃)避光静置6~18 h,离心弃上清。S液洗一遍,离心弃上清,加入0.01% Triton-X100 250 μL,正置显微镜下拍照,得到油红O染色图。
离心后加入M9缓冲液,转移至新的离心管,5000 r/min离心1 min,去除M9;加入200 μL无水乙醇,混合摇晃5 min,5000 r/min离心1 min,取上清液测510 nm下的吸光值。
1.2.8 数据处理与统计分析
采用专业图像处理软件image-J处理染色图,用spss进行显著性分析,OriginPro进行统计学分析并作图,结果以平均值±标准方差表示,显著性以p<0.05计。
2 结果与讨论
2.1 RBE与LFBE对秀丽隐杆线虫脂肪含量的影响

图1 油红O染色图Fig.1 oil red O staining figure
秀丽线虫的脂肪主要以脂滴形式储存于肠道及皮下组织,而油红O为脂溶性染料,可特异性的附着在中性脂肪分子上形成醒目的红色,故可用来观察秀丽隐杆线虫体内的脂肪沉积情况。如图1所示,与正常组相比,模型组与RBE组红色较深且染色面积较大,而LFBE组的红色较浅且面积较小,与正常组更接近,说明摄入 LFBE能降低线虫体内脂肪含量,而摄入RBE则没有显著效果。
定量分析(图2,图3)则反映了油红O染色处理的吸光值与脂肪含量的关系,测得值越大说明线虫体内脂肪沉积的越多。结果显示,RBE组脂肪沉积量高于模型组,说明其在试验的范围内,RBE不仅没有降低脂肪沉积量,反而促进了脂肪的积累。而 LFBE在浓度较低时,对线虫体内脂肪沉积量无明显影响,但当浓度为800 μg/mL、1600 μg/mL时,LFBE显著降低线虫体内脂肪沉积量,与模型组相比,分别降低了13%和26%。

图2 RBE浓度对秀丽隐杆线虫脂肪沉积量的影响Fig.2 Effects of different concentrations of RBE on fat deposition of C.elegans

图3 LFBE浓度对秀丽隐杆线虫脂肪沉积量的影响Fig.3 Effects of different concentrations of LFBE on fat deposition of C.elegans
乳酸菌发酵后谷物中蛋白质相对分子质量下降,多肽含量提高,游离酚酸,尤其是阿魏酸的含量有显著提高,这可能是导致LFBE具有更显著降脂活性的主要原因。史腊妮等[15]发现 LFBE有效抑制 3T3-L1前脂肪细胞的增殖,并能显著抑制脂代谢关键基因C/EBPα、PPAR-γ、SREBP-1c、PTP1B和aP2的mRNA表达水平,上调GLUT4的mRNA表达水平,张家艳等[16]发现LFBE具有调节肥胖大鼠脂代谢及改善胰岛素抵抗的作用,与本研究LFBE对秀丽隐杆线虫的降脂试验结果相一致。
2.2 LFBE中总蛋白质对秀丽隐杆线虫脂肪沉积的影响

图4 不同浓度蛋白质对秀丽隐杆线虫脂肪沉积量的影响Fig.4 Effects of different concentrations of protein on fat deposition of C.elegans
如图4所示,LFBE中总蛋白质能显著降低秀丽线虫体内脂肪沉积量,且随着蛋白质浓度升高,秀丽线虫脂肪沉积量下降。当蛋白质浓度为120、240、480 μg/mL时,线虫脂肪沉积量与模型组相比分别下降了12%、14%和26%。这说明蛋白质是LFBE中抑制秀丽线虫脂肪沉积的活性组分。
研究表明,大麦经发酵后,其蛋白质分子量减小,多肽含量升高,具有更显著的生物活性。目前探讨蛋白质对秀丽线虫脂肪沉积影响的报道较少,但在动物与细胞模型中,发酵谷物中蛋白质或多肽的降脂功能已经得到了验证。史腊妮等[15]研究发现,LFBE中总蛋白能显著抑制 3T3-L1前脂肪细胞的增殖与分化,并能够通过调控相关基因的表达对脂肪细胞胰岛素通路进行调节,与本试验结果相吻合,表明LFBE中的蛋白质具有降脂效果。
2.3 LFBE中总糖对秀丽隐杆线虫脂肪沉积的影响
如图5所示,当总糖浓度为120 μg/mL时,线虫脂肪沉积量与模型组接近,基本不具有降脂效果;而浓度为240 μg/mL时,脂肪沉积量降低9%,但不具有显著性;当总糖浓度达到480 μg/mL时,秀丽线虫体内脂肪沉积量与模型组相比下降12%,接近正常组水平。这一结果表明LFBE中的总糖在一定浓度下也具有降低秀丽隐杆线虫脂肪沉积的效果。
研究表明,谷物中的多糖尤其是膳食纤维具有降脂作用,而膳食纤维的降脂作用与其在肠道中的发酵产物相关。Jolene等[17]通过尼罗红染色发现,摄入抗性淀粉后,秀丽线虫的脂肪含量与对照组相比下降至76.5%,而经过小鼠肠道发酵的抗性淀粉产物能使秀丽线虫的脂肪沉积量下降至78.8%。Abdeltawab等[18]通过临床试验证实添加大麦β-葡聚糖的主食可以降低餐后血糖与体重,且另有研究发现β-葡聚糖需要达到一定浓度才能抑制前脂肪细胞分化[19]。本研究中,总糖达到一定的浓度才具有显著的降脂作用,可能与其中β-葡聚糖含量是否达到产生降脂活性的浓度有关。
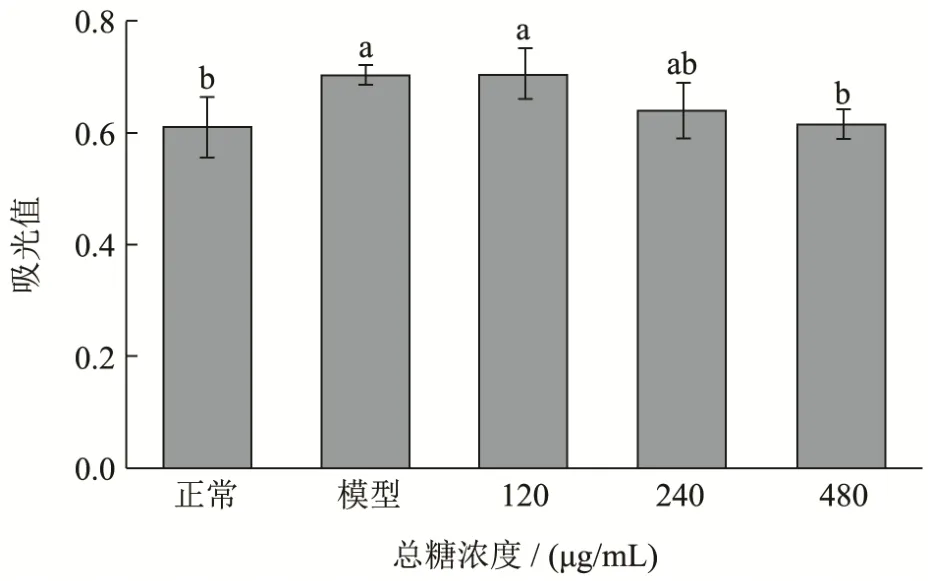
图5 不同浓度总糖对秀丽隐杆线虫脂肪沉积量的影响Fig.5 Effects of different concentrations of polysaccharide on fat deposition of C.elegans
2.4 LFBE中酚类化合物对秀丽隐杆线虫脂肪沉积的影响

图6 不同浓度酚类化合物对秀丽隐杆线虫脂肪沉积量的影响Fig.6 Effects of different concentrations of polyphenol compounds on fat deposition of C.elegans
如图6所示,LFBE中酚类化合物能显著降低秀丽线虫体内脂肪沉积量,且随着酚类化合物浓度升高,秀丽线虫脂肪沉积量下降。当酚类化合物浓度为4、8、16 μg/mL时,线虫脂肪沉积量与模型组相比分别下降了21%、24%和39%。相同浓度LFBE中含有的酚类化合物与蛋白质和总糖相比降脂作用更加明显,说明酚类化合物是LFBE中主要的降脂功能活性组分。
研究表明,谷物中的酚类化合物能降低大鼠脂肪含量,有效抑制 3T3-L1脂肪细胞分化,且经过发酵后,谷物多酚的降脂作用更加显著。
同时,利用线虫模型对酚类化合物的研究也表明了其对线虫脂肪沉积的抑制作用。Sun等[20]发现含有大量酚类化合物的蔓越莓提取物作用于线虫,可使其脂肪沉积量显著下降,且通过不同突变型线虫的研究,认为酚类化合物的降脂效果可能是源于对sbp-1,cebp及nhr-49等基因的表达量的调控。因此,可以推测酚类化合物在LFBE抑制秀丽线虫脂肪沉积的过程中起主要作用,但其发挥作用的分子机制有待进一步的研究。
3 结论
LFBE具有减少秀丽隐杆线虫肥胖模型脂肪沉积量的功能,且以其中的酚类化合物作用最为明显,总蛋白质次之。当LFBE浓度达到800 μg/mL以上时,显著抑制秀丽线虫肥胖模型脂肪的沉积。其中,总蛋白浓度为120 μg/mL,酚类化合物浓度为4 μg/mL时,即具有显著的降脂活性,而总糖浓度需达到 480 μg/mL,方能显现其降低脂肪沉积的作用。

