金线莲苷促进骨骼肌细胞摄取葡萄糖的分子机制研究
朱碧丽,吴序栎,辛启航,王孟环,胡小鹏,贺震旦,刘立忠
(1.深圳大学医学部基础医学院,广东深圳 518060)(2.深圳大学医学部药学院,广东深圳 518060)(3.深圳新型天然保健品重点实验室,广东深圳 518060)
随着生活水平的提高,越来越多的人患有肥胖[1],代谢综合征[2]、心脏病[3]和Ⅱ型糖尿病[4],这些疾病的发生机制都与胰岛素抵抗(Insulin Resistance,IR)[5]有关。2型糖尿病状态下脂肪酸和甘油三酯在骨骼肌细胞内的累积,导致骨骼肌对胰岛素的敏感性降低,是引起胰岛素抵抗的重要原因[6]。由于在胰岛素刺激下,体内超过 70%的葡萄糖可被骨骼肌细胞摄取并利用[7],所以骨骼肌是摄取葡萄糖的最主要组织。胰岛素主要通过磷脂酰肌醇3-激酶(PI3K)信号通路进行代谢调节[8],磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路是胰岛素抵抗相关的一条信号通路,与胰岛素抵抗相关的2型糖尿病有着不可分割的联系[8~11]。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)作为能量调控器,在调节肝脏、脂肪和骨骼肌的糖脂代谢方面发挥着重要的作用,并且维持着能量供需平衡[12]。AMPK参与了体内葡萄糖、脂肪酸和蛋白质代谢的调节,因此在肥胖、糖尿病、代谢综合征患者的代谢调节中,AMPK是关键靶点之一[13,14]。骨骼肌的胰岛素敏感性降低是机体胰岛素抵抗的主要原因,因此临床上仍然需要能够促进骨骼肌摄取葡萄糖,降低血糖浓度,恢复机体的正常胰岛素水平,并且副作用小的药物治疗胰岛素抵抗及 2型糖尿病。
金线莲苷(kinsenoside)是葡萄糖与五元内酯环的手性碳以糖苷键形式连接形成的葡萄糖苷,是金线莲的特质性成分[15]。金线莲(Anoectochilus roxburghii)即花叶开唇兰,又名金蚕、金线兰等,是兰科开唇兰属的一种多年生的草本植物[16],我国南方福建、台湾、广西、广东、四川和云南等省都有丰富的资源[17],它是我国传统的珍贵药材,有清热解毒、滋补养阴降火和消炎减轻疼痛等功效[18]。在现代中药研究中,金线莲多用于糖尿病、高血脂、高血压和肿瘤等疾病的治疗[19]。据文献报道该属植物含金线莲苷的水提物有降血糖、降血脂、保护肝脏、止痛和消炎等广泛的药理活性[20,21]。随着研究的深入,金线莲的药用价值日益凸显,其治疗效果引起广泛的关注,有良好的开发前景。
本课题以大鼠骨骼肌细胞为模型,研究在正常及胰岛素抵抗情况下,金线莲苷对细胞摄取葡萄糖的促进作用。结果显示金线莲苷可通过激活Akt和AMPK来增加细胞对葡萄糖的摄取,进而改善胰岛素抵抗的情况。
1 材料与方法
1.1 主要材料与试剂
大鼠骨骼肌细胞系L6myc,由Dr.Amira Klip友情提供;金线莲苷,深圳大学贺震旦教授课题组提供;必需基本培养(简称α-MEM),Gibco公司;磷酸盐缓冲液(Phosphate Buffered Saline,简称PBS),Notlas公司;胰蛋白酶,Gibco公司;双抗,Cell Signaling Technology公司;葡萄糖(Glucose),Sigma公司;胰岛素(insulin),诺和诺德公司;抗体,Cell Signaling Technology公司;ECL发光液试剂盒(Enhanced Chemiluminescence),Bio-Rad公司;分离胶缓冲液(Resolving Gel Buffer pH 8.8),Bio-Rad公司;积沉胶缓冲液(Stacking Gel Buffer pH 6.8),Bio-Rad公司;十二烷基磺酸钠(Sodium Dodecyl Sulphate,简称SDS),Bio-Rad公司;过硫酸铵(Ammonium Persulphate,简称 APS),Amresco公司;四甲基乙二胺(tetramethylethylenediamine,简称TEMED),Amresco公司;Trizma碱(Trizma Base,简称Triz),Vetec公司;吐温20(Tween-20),Sangon Biotech公司。
1.2 仪器与设备
Purelab Ultra超纯水仪,ELGA公司;小型垂直电泳仪,美国Bio-Rad公司;CO2培养箱,广东丹利科技有限公司;超净工作台,浩瀚技术有限公司;小型台式高速冷冻离心机,德国Eppendorf公司;化学发光成像仪,Clinx Science Instruments公司;摇床,海门市其林贝尔仪器制造有限公司;紫外分光光度计,Thermo Fisher Scientific公司;漩涡混合器,江苏金怡仪器科技有限公司;水浴锅,上海精宏实验设备有限公司。
1.3 实验方法
1.3.1 L6骨骼肌细胞培养
将 L6myc肌母细胞从液氮中取出后,迅速置于37 ℃水浴中,充分融化。转移至含 10%的血清和含1%双抗的α-MEM培养瓶中,充分分散细胞并将培养瓶放入培养箱中(37 ℃、5%CO2)培养。过夜后,更换新鲜的培养基。根据细胞的生长情况,一般每两天传一次代。L6myc肌母细胞在培养瓶中的密度达到60%~70%后,消化传代(104cells/mL),并置于诱导培养基中(α-MEM,2%胎牛血清,l%双抗),每两天换一次培养基。6~7 d后90%以上的细胞融合为多核、长树枝状或手状的肌管细胞时,可用于实验。
1.3.2 细胞处理
L6myc肌母细胞诱导分化为成熟肌管细胞后,用于实验。金线莲苷(kinsenoside)以不同浓度(10 nM,100 nM,1 μM)分别作用细胞1 h和24 h,以胰岛素和黄连素小檗碱为对照,确定金线莲苷对骨骼肌细胞的最适浓度和时间。采用高糖高胰岛素(HGI)诱导细胞产生胰岛素抵抗。
1.3.3 蛋白免疫印迹分析
于细胞中加入 RIPA(使用前加入 1%protease inhibitor cocktail,2‰NaF和2‰PMSF)裂解液,刮取细胞至冰上裂解30 min后4 ℃,14000 r/min高速离心15 min,将上清液吸取至EP管中。进行BCA蛋白定量,各取20 μg蛋白样品于SDS-PAGE凝胶上进行电泳,电泳结束后进行电转。5%BSA封闭1 h后分别加入一抗4 ℃孵育过夜。第二天TBST洗膜三次后二抗孵育1 h,TBST洗膜三次后进行ECL法学发光液显影,曝光。结果用ImageJ软件对图像进行灰度扫描处理并进行量化分析,以GAPDH作为内参,用灰度值的比值表示相应样品所检测蛋白质的相对含量。
1.3.4 2-NBDG法检测葡萄糖摄取
2-脱氧葡萄糖(2-DG)是天然D型葡萄糖衍生物,通过葡萄糖转运体蛋白进入细胞。2-DG第2位氧原子被荧光基团NBD取代即形成2-DG的荧光类似物,即荧光标记2-脱氧葡萄糖(2-NBDG)。2-NBDG激发波长为460 nm,发射波长为540 nm,能够被荧光酶标仪、荧光显微镜及流式细胞仪等仪器探测。细胞根据实验条件处理后,用常温PBS润洗后以2-NBDG于培养箱中孵育30 min。PBS润洗两次后进行读数。
1.4 统计分析
采用 ImageJ软件对图像进行灰度扫描处理并进行量化分析和GraphPad Prism 5软件对所得的数据进行显著性分析。与对照组相比较,显著水平设定为*p<0.05 和#p<0.05。
2 结果与讨论
2.1 L6骨骼肌细胞诱导分化的形态学观察

图1 骨骼肌细胞形态学观察Fig.1 Morphological observation of skeletal muscle cells
细胞复苏后对细胞进行培养和诱导分化,观察细胞形态。L6骨骼肌细胞在接种的6~8 h会轻微贴壁,此时细胞还未完全展开,呈单个圆形或梭形,见图1(a)。24 h后细胞完全展开,细胞数有所增加,见图1(b)。48 h后细胞密度增加,细胞出现排列现象,见图1(c)。在2%FBS诱导分化培养基的作用下,第3~4 d细胞有规律地平行排列,细胞与细胞之间相互融合,见图1(d)。第6 d时85%以上的细胞融合成肌管细胞。肌管为光滑长条形,许多细胞核聚集在一起,位于肌管的中央,肌管之间多呈平行排列,见图1(e)。肌管细胞为成熟的骨骼肌细胞,所以本研究以分化好的肌管细胞为模型进行各种实验。
2.2 金线莲苷作用细胞可显著激活 Akt和AMPK
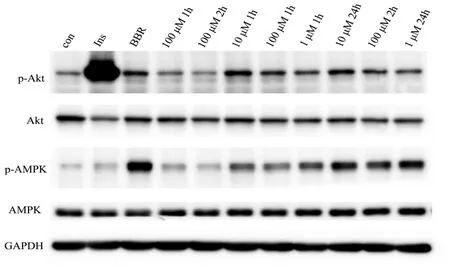
图2 金线莲苷对Akt和AMPK活性和表达的影响Fig.2 Effects of kinsenoside on the activity and expression of Akt and AMPK
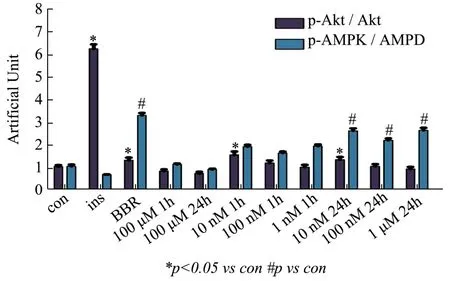
图3 Western Blot图像量化分析Fig.3 Quantitative analysis of Western Blot
Akt与AMPK是胰岛素信号通路和AMPK信号通路中的重要靶点,参与细胞对葡萄糖的摄取,它们的活性高低与细胞摄取葡萄糖密切相关。金线莲苷(kinsenoside,Kin)以不同浓度(10 nM,100 nM,1 μM,100 μM)分别作用细胞1 h和24 h,同时以胰岛素(insulin,Ins)作用 10 min和黄连素小檗碱(berberine,BBR)作用1 h作为对照组。结果显示,与对照组相比,金线莲苷浓度为100 μM,作用1 h和24 h对Akt(与对照组相比,1 h降低15.50%,p>0.05;24 h降低26.55%,p>0.05)和AMPK(与对照组相比,1 h增加24.37%,p>0.05;24 h降低2.79%,p>0.05)均无显著激活作用,说明高浓度的金线莲苷可能会对细胞产生毒性作用。当10 nM、100 nM和1 μM金线莲苷作用细胞1 h后,与对照组相比,Akt活性分别增加了 56.46%(p<0.05)、19.79%(p>0.05)、1.88%(p>0.05)。说明只有10 nM金线莲苷显著激活了Akt;10 nM、100 nM和1 μM金线莲苷作用1 h后,与对照组相比,AMPK 活性分别增加了 15.54%(p>0.05)、71.39%(p<0.05)、94.70%(p<0.05),说明100 nM 和1 μM的金线莲苷激活AMPK作用较好;当10 nM、100 nM金线莲苷作用细胞24 h后,与对照组相比,Akt的活性分别增加了 34.53%(p<0.05)、5.53%(p>0.05),而 1μM金线莲苷作用后Akt活性降低了6.20%(p>0.05),说明10 nM激活Akt的效果最好。当10 nM、100 nM和1 μM金线莲苷作用24 h后,与对照组相比,AMPK的活性分别增加了 149.92%(p<0.05)、114.26%(p<0.05)、147.84%(p<0.05),说明三个浓度的金线莲苷都可显著激活AMPK,见图2和图3(图3是对图2中各蛋白条带的定量分析结果)。结果显示,10 nM金线莲苷作用细胞24 h后对Akt和AMPK同时激活的作用最为显著,以后的试验中均采用此条件处理细胞。
2.3 正常情况下金线莲苷促进细胞对葡萄糖的摄取
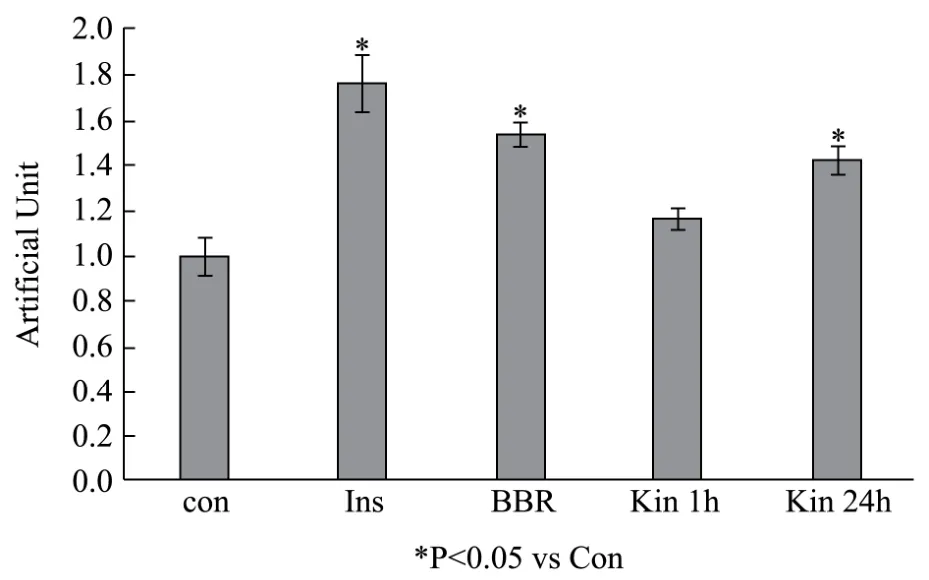
图4 金线莲苷对细胞摄取葡萄糖的作用Fig.4 The effect of kinsenoside on the glucose uptake of cells
与蛋白检测结果相对应,葡萄糖吸收实验显示,以胰岛素(Ins)和黄连素小檗碱(BBR)为参照,10 nM金线莲苷(Kin)作用细胞1 h即可增加细胞对葡萄糖的吸收(与对照组相比,增加19.32%,p>0.05),但不显著;作用24 h后可显著增加细胞对葡萄糖的摄取(与对照组相比,增加43.35%,p<0.05),见图4。结合图2的结果,我们发现10 nM金线莲苷短期作用(1 h)只能显著激活Akt(与对照组相比,增加54.46%,p<0.05),虽然 AMPK 的活性也有增加的趋势,但不显著,此时金线莲苷引发的细胞对葡萄糖的摄取有轻微的增加(与对照组相比,增加 19.32%,p>0.05)。当10 nM金线莲苷作用24 h后,可有效激活Akt和AMPK,同时显著增加细胞对葡萄糖的摄取(与对照组相比,增加 43.35%,p<0.05)。这说明金线莲苷促进细胞摄取葡萄糖需要同时激活Akt和AMPK,但是以AMPK活化为主,以Akt活化为辅。
2.4 胰岛素抵抗情况下金线莲苷对 Akt和AMPK的作用
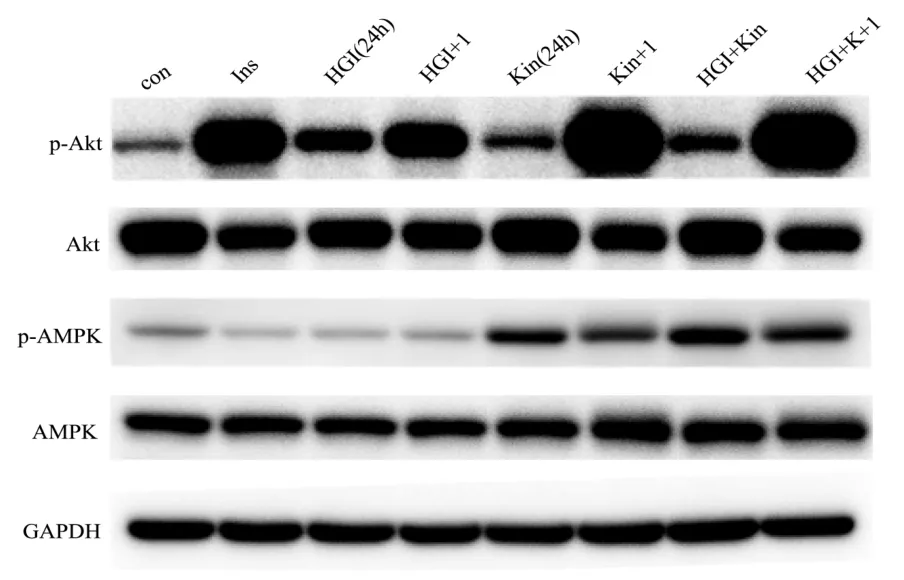
图5 不同处理条件下Akt和AMPK活性与表达Fig.5 Activity and expression of Akt and AMPK under different treatments
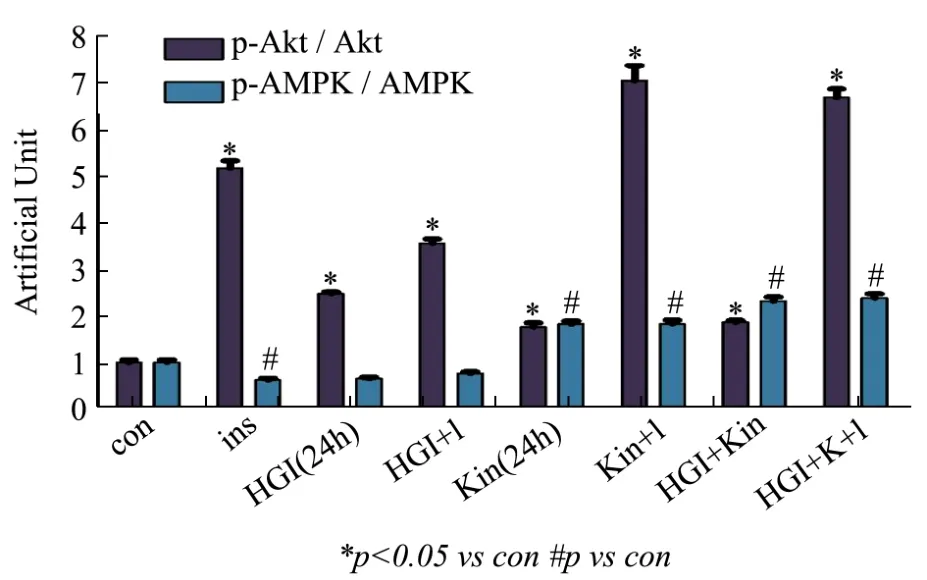
图6 Western Blot图像量化分析结果Fig.6 Quantitative analysis of Western Blot
正常情况下,胰岛素(Ins,I)可激活 Akt(与对照组相比,增加 434.73%,p<0.05)。高糖高胰岛素(High glucose high insulin,HGI)诱导细胞胰岛素抵抗后,与对照组比较,虽然经胰岛素长时间处理后Akt本底活性较高,但是胰岛素再刺激不能显著激活 Akt,与对照组相比,对胰岛素的敏感性(胰岛素加入后 Akt的活性变化/胰岛素加入前 Akt的活性变化)降低了2.84倍,p<0.05。说明胰岛素抵抗的细胞模型诱导成功。但金线莲苷(Kin,K)在正常和胰岛素抵抗情况下都可激活Akt(与对照组相比,分别增加了59.77%,p<0.05 和79.05%,p<0.05)和AMPK(与对照组相比,分别增加了91.48%,p<0.05和128.35%,p<0.05)。更为重要的是,金线莲苷可以改善胰岛素抵抗的情况,恢复了胰岛素对Akt的激活作用,与胰岛素抵抗组相比,细胞对胰岛素敏感性增加了1.17倍,p<0.05。见图5和图6(图6是对图5中各蛋白条带的定量分析结果)。结合图2和图5的Western Blot结果,发现胰岛素不但不能激活AMPK,甚至对AMPK的活性有下调的作用。因为胰岛素引发的是合成代谢,促进糖原、脂肪和蛋白的合成。而AMPK激活的是分解代谢,促进糖原、脂肪和蛋白的分解。因此在正常情况下,胰岛素刺激细胞后所引发的合成代谢占据优势,对AMPK的活性有一定的抑制作用。但是在胰岛素抵抗的情况下,胰岛素信号通路受阻,而AMPK的激活不受影响,这时激活AMPK后不但促进葡萄糖摄取,还可在一定程度上改善胰岛素抵抗的作用[22]。
2.5 金线莲苷可改善胰岛素引发的细胞对葡萄糖的摄取
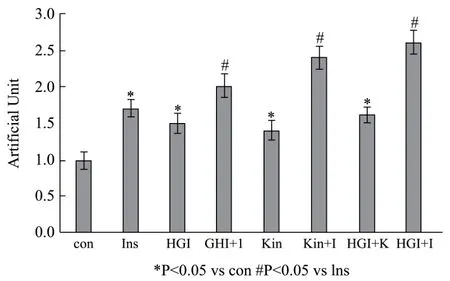
图7 各个处理因素下葡萄糖的摄取情况Fig.7 Glucose uptake under various treatment factors
对于正常细胞来说,胰岛素(Ins,I)和金线莲苷(Kin,K)都可促进细胞对葡萄糖的摄取(与对照组相比,分别增加72.30%,p<0.05、39.03%,p<0.05)。金线莲苷与胰岛素共同作用细胞后,可引发更多的葡萄糖吸收,并且实验结果显示金线莲苷与胰岛素共同作用细胞时展示的是协同效应(与胰岛素促进细胞对葡萄糖摄取相比,增加 64.70%,p<0.05)。高糖高胰岛素(HGI)诱导胰岛素抵抗后,胰岛素促进葡萄糖摄取的作用明显减弱(与胰岛素促进细胞对葡萄糖摄取相比,增加 25.70%,p>0.05),但是金线莲苷仍然可以很好地促进葡萄糖摄取(与对照组相比,增加59.00%,p<0.05),并且金线莲苷与胰岛素共同作用后,可进一步增强胰岛素的作用(与胰岛素促进细胞对葡萄糖摄取相比,增加88.70%,p<0.05),见图7。这里,葡萄糖摄取实验与上述的蛋白检测结果相一致。高糖高胰岛素诱导胰岛素抵抗后,本底的Akt活性增加,所以导致胰岛素抵抗细胞比正常细胞在基础水平上具有较多的葡萄糖吸收。金线莲苷处理胰岛素抵抗的细胞后,不但增强了Akt的活性,还进一步增加了胰岛素对Akt的活化作用,同时还显著地激活了AMPK,所以无论正常细胞还是胰岛素抵抗细胞,经金线莲苷处理后都可显著增加对葡萄糖的摄取。
3 结论
胰岛素抵抗会导致糖脂代谢紊乱,进而引发全身性的代谢紊乱[23]。骨骼肌的胰岛素敏感性受损是机体胰岛素抵抗的主要原因。金线莲苷是金线莲的主要成分之一,已被证明具有增强胰岛素敏感性的作用,但其具体的分子机制尚不清楚。在本研究中,利用金线莲提取物金线莲苷作用骨骼肌细胞。实验结果显示,在细胞正常情况下,金线莲苷可以增加AMPK和Akt的活性,并且可促进骨骼肌细胞对葡萄糖的摄取;在胰岛素抵抗的细胞中,金线莲苷可显著改善胰岛素对Akt的激活作用。在正常及胰岛素抵抗情况下,金线莲苷都可显著激活 AMPK,从而促进细胞摄取葡萄糖。推测体内金线莲苷降糖机制如下:金线莲苷作用细胞后,细胞内蛋白激酶Akt与AMPK被激活,进而促进葡萄糖转运蛋白 4(GLUT4)向细胞膜迁移,并镶嵌在细胞膜上,协助葡萄糖从细胞外转运至细胞内,这样就降低了血糖浓度,减少了糖毒性,从而改善了胰岛素抵抗。本研究为应用金线莲苷治疗胰岛素抵抗和Ⅱ型糖尿病提供了理论基础。

