经培养基优化所得牛樟芝及其功能饮料的护肝和降血糖作用
吴黉坦,吴晓露,陈煜沛,庞海月,黄立森,王贵弘,郭钟达
(1.厦门医学院医学技术系,福建厦门 361023)(2.天然化妆品福建省高校应用技术工程中心,福建厦门 361023)(3.中华科技大学生物科技系,台湾台北 11581)
酒精性肝病是由于长期大量饮酒所导致的肝脏损伤性疾病。研究表明,过度饮酒会增加高血压、高血脂症和冠状动脉硬化的风险,还会引起心脏、肝脏和肠胃等人体重要脏器损伤,造成心脏负担加剧、肝硬化以及胃溃疡等疾患。其中酒精代谢失调所导致的脂毒性、氧化应激和炎症等是酒精性肝病发生的重要原因[1,2]。调查显示,我国酒精消费人群中过量饮酒的比例高达49.1%,男性、女性分别为51.5%和32.1%,近年来酒精性肝病发病率逐年升高,已成为我国常见的肝脏疾病之一,严重危害人民的健康[3,4]。
糖尿病是一种以持续高血糖为主要特征,由遗传和环境等多种因素造成的内分泌代谢性疾病,且并发症多,可以造成各种组织、脏器(如眼、肾、心脏、血管和神经等)的长期损害、功能紊乱或衰竭。糖尿病治疗时间长,费用大,已成为世界上继肿瘤和心脑血管疾病后第三位的慢性疾病[5,6]。据统计,中国是全球糖尿病患者第一大国,2015年病患人数高达1.096亿人,且约有130万人死于糖尿病及其并发症。同时据IDF预测,如果不加干预,2040年全球糖尿病患者将达6.42亿,糖尿病前期人群4.81亿,我国患者数量将上升至1.54亿。
牛樟芝(Antrodia camphorata)又名牛樟菇,是一种原产于我国台湾的珍稀药用真菌。牛樟芝仅生长在台湾特有百年以上的牛樟树树干腐朽的内壁,或枯死倒伏的牛樟树木材潮湿表面,因其异常珍贵,素有“台湾森林中的红宝石”、“灵芝之王”的美誉。现代研究表明,牛樟芝含有三萜类、多糖类和不饱和脂肪酸等多种生理活性物质,具有抗氧化、抗炎、抑制肿瘤、降糖、护肝和增强免疫力等多种功效[7~11]。鉴于牛樟木这一宿主的稀缺性,再加上野生牛樟芝生长极其缓慢,造成目前市场上牛樟芝资源严重短缺且价格昂贵,制约了其药用价值的开发和应用,因此急需建立一种高质、量产且培养周期较短的牛樟芝培养方法。目前,较为成功的牛樟芝人工培养方法有椴木栽培和液态发酵,前者以牛樟树椴木为培养基,培养周期长(1~2年),成本高,生产效率低,难以大规模推广;后者以液体发酵槽进行菌种液体发酵,生产效率高,周期短,易于扩大化培养,但难以取得野生牛樟芝特有的麦角甾烷型三萜类化合物[12]。针对以上两种方法的不足,本文以MEA培养基为基础,建立了一种经培养基优化的牛樟芝固态发酵法,并已取得较好的研究结果。本文对经培养基优化所得牛樟芝微粉的主要功效性成分进行含量分析,以评估其品质;同时通过乙醇诱导的急性酒精肝损伤小鼠模型和链脲佐菌素(STZ)诱导的糖尿病小鼠模型,评价该牛樟芝微粉及其功能饮料护肝、降血糖及改善血脂代谢的功效,论证该牛樟芝固态发酵法的可行性,也为其进一步的研究、应用和推广奠定了基础。
1 材料与方法
1.1 材料与试剂
牛樟芝微粉及其功能饮料,由台湾中华科技大学生物科技系郭钟达副教授提供;C57BL/6雄性小鼠,体重(20±2)g,SPF级,由厦门大学实验动物中心提供,生产许可证号:SCXK(闽)-2013-0001;丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、过氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)试剂盒均购买自南京建成生物工程研究所;AMPKα、p-AMPKα(T172)、AKT、p-AKT(S473)和 GAPDH抗体均购自美国 Cell Signaling Technology公司;血糖测定试纸和血糖测定仪,德国Roche公司;链脲佐菌素(STZ)购自美国Sigma-Aldrich公司。其余试剂均为国产化学分析纯。
1.2 仪器与设备
5417R台式高速冷冻离心机,德国Eppendorf公司;SpectraMax® I3多功能酶标仪,美国 Molecular Devices公司;GZX-DH.500-BS-II电热恒温干燥箱,上海跃进医疗器械有限公司;GNP-9080隔水式电热恒温培养箱,上海精宏实验设备有限公司;TS-200脱色摇床,海门市其林贝尔仪器制造有限公司;VE186转移电泳槽、VE180微型垂直电泳槽和EPS600电泳仪,上海天能科技有限公司;ChemiDoc™ XRS+化学发光成像系统,美国Bio-Rad公司。
1.3 实验方法
1.3.1 牛樟芝微粉的制备
本实验所用培养基以MEA培养基为基础,经优化后确定为:葡萄糖40 g/L,麦芽浸膏20 g/L,大豆蛋白胨5 g/L,紫米粉1 g/L和琼脂20 g/L。固态发酵牛樟芝2 m后,干燥、粉碎制成牛樟芝微粉。
1.3.2 牛樟芝微粉中多糖含量的测定
采用热水浸提法制备多糖:温度80 ℃,时间4 h,料液比40(mL:g)。离心(8000 r/min,10 min)后取上清,采用苯酚-硫酸法测定多糖含量[13]。
1.3.3 牛樟芝微粉中三萜类化合物含量的测定
采用醇提法制备三萜类化合物:75%乙醇,温度80 ℃,时间 1.5 h,料液比 40(mL:g)。离心(4000 r/min,10 min)后取上清,采用香草醛-高氯酸法测定三萜类化合物含量[13]。
1.3.4 牛樟芝功能饮料的配方
本实验以经培养基优化所得牛樟芝微粉为基本原料,调配了一款牛樟芝功能饮料,其配方为:牛樟芝微粉10%,灵芝萃取物5%,绿茶萃取物3%,综合蔬果酵素22%,其余部分为水。
1.3.5 急性酒精肝损伤小鼠模型的建立及分组给药方案
选取50只C57BL/6雄性小鼠,体重(20±2)g,随机分为5组:空白对照组、模型组、牛樟芝微粉低、中和高剂量组,每组10只。牛樟芝微粉低、中和高剂量组每天分别灌胃给予0.2、1和2 g/kg·bw牛樟芝微粉悬液,空白对照组和模型组以等体积生理盐水代替,连续灌胃30 d。末次给药后1 h,模型组和牛樟芝微粉各剂量组按12 mL/kg·bw剂量一次性灌胃给予60%乙醇,空白对照组以等体积生理盐水代替,禁食12 h后处死小鼠并取样:对小鼠进行心脏穿刺取血,离心(13500 r/min,10 min)制备血清;同时收集小鼠肝脏组织,并冻于-80 ℃冰箱用后续各项指标检测分析。
1.3.6 糖尿病小鼠模型的建立及分组给药方案
选取若干C57BL/6雄性小鼠,体重(20±2)g,禁食12 h后按照80 mg/kg·bw剂量一次性腹腔注射STZ,继续喂养3 d后,禁食12 h,取小鼠尾静脉血测定其空腹血糖值,当血糖值≥11.1 mmol/L时判定建模成功。选取未经处理的小鼠作为空白对照组,建模成功的小鼠随机分为4组:模型组、牛樟芝微粉低、中和高剂量组,每组10只。牛樟芝微粉低、中和高剂量组每天分别灌胃给予0.2、1和2 g/kg·bw牛樟芝微粉悬液或其功能饮料,空白对照组和模型组以等体积生理盐水代替,连续灌胃35 d。实验结束后处死小鼠并取样:对小鼠进行心脏穿刺取血,离心(13500 r/min,10 min)制备血清;同时收集小鼠肝脏组织,并冻于-80 ℃冰箱用于后续各项指标的检测分析。
1.3.7 糖尿病小鼠降低空腹血糖值实验
给药后第1、7、14、21、28和35 d,取小鼠尾静脉血测定其空腹血糖值,每次测定前禁食12 h,比较各组小鼠空腹血糖值的变化情况并根据以下公式计算末次血糖下降率:
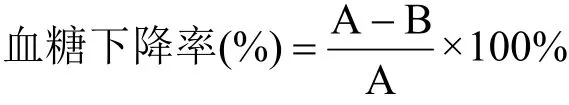
注:式中,A和B分别代表实验前和实验后血糖值。
1.3.8 糖尿病小鼠糖耐量实验
牛樟芝微粉低、中和高剂量组每天分别灌胃给予0.2、1和2 g/kg·bw牛樟芝微粉悬液或其功能饮料,空白对照组和模型组以等体积生理盐水代替,连续灌胃35 d。灌胃35 d后,各组禁食12 h,进行末次给药。在给药30 min后按2 g/kg·bw剂量灌胃给予葡萄糖,并测定给予葡萄糖后0、0.5、1和2 h的血糖值,观察各组在给予葡萄糖后不同时间点血糖值的变化情况。血糖曲线下面积(AUC)根据以下公式计算:
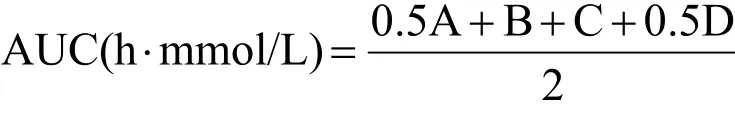
注:式中,A、B、C和D分别代表给予葡萄糖后0、0.5、1和2 h的血糖值。
1.3.9 血清及肝脏相关指标测定
参照试剂盒操作说明检测ALT、AST、SOD、CAT、GSH-Px、MDA、TC、TG、LDL和HDL活性或含量。
1.3.10 免疫印迹法分析蛋白质表达
从-80 ℃冰箱中取出小鼠肝脏组织,按比例加入预冷的裂解液后在冰上充分研磨,离心(13500 r/min,10 min)收集上清,测定蛋白质浓度。蛋白质经变形后,按30 μg/well的上样量进行SDS-PAGE电泳。用湿转法将蛋白质转印至PVDF膜后,5%BSA室温封闭1 h,加入一抗(稀释比例为1:1000)4 ℃孵育过夜。TBST缓冲液洗涤5次,每次3 min,再加入辣根过氧化物酶标记的二抗(稀释比例为1:5000)室温孵育1 h,TBST缓冲液洗涤5次,每次3 min。加入适量ECL试剂后,PVDF膜用ChemiDoc™ XRS+化学发光成像系统采集图像,分析结果。
1.3.11 数据分析
采用Graph Pad Prism 6软件进行数据统计分析,数据以¯x±s表示;显著性检测采用单因素方差分析,p<0.05说明差异有统计学意义;采用 PhotoshopCS6软件进行图片处理。
2 结果与讨论
2.1 经培养基优化所得牛樟芝功效性成分的含量分析
三萜类和多糖类等化合物是牛樟芝的主要功效性成分[7]。由表1可知,经2 m固态发酵所得牛樟芝中麦角甾烷型和羊毛甾烷型三萜类化合物及多糖类化合物含量均超过台湾牛樟芝产业协会给出的参考标准,分别提高了6.1%、24%和40%,表明该经培养基优化后的牛樟芝固态发酵法能产出高质且培养周期较短的牛樟芝。在后续实验中,牛樟芝经干燥、粉碎后制成牛樟芝微粉,并通过乙醇诱导的急性酒精肝损伤小鼠模型和 STZ诱导的糖尿病小鼠模型对其功效进行评 估,以论证该固态发酵法的可行性。
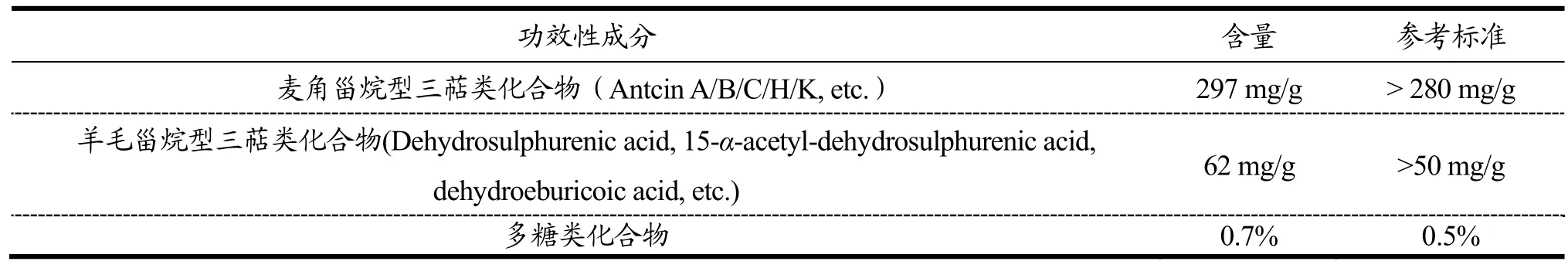
表1 经培养基优化所得牛樟芝功效性成分的含量分析Table 1 Analysis of the functional components of Antrodia camphorata obtained by medium optimization
2.2 牛樟芝微粉对急性酒精肝损伤小鼠血清中ALT和AST活性的影响
ALT和AST作为肝细胞标志性酶类,是诊断肝脏受损伤程度最敏感指标。当肝脏损伤后,血清中这两种酶的活性会显著升高,进而反映肝脏受损程度[2]。
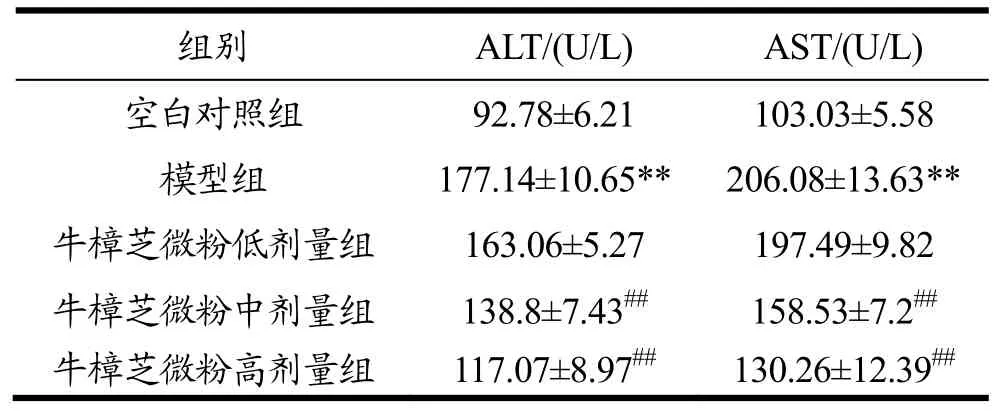
表2 牛樟芝微粉对急性酒精肝损伤小鼠血清中ALT和AST活性的影响Table 2 Effects of Antrodia camphorata powder on serum activities of ALT and AST in mice with alcohol-induced acute liver injury(¯x±s,n=10)
由表2可知,与空白对照组相比,模型组小鼠血清中ALT和AST活性分别提高了90.92%(p<0.01)和 99.83%(p<0.01),说明急性酒精肝损伤小鼠模型构建成功。与模型组相比,牛樟芝微粉中剂量组小鼠血清中ALT和AST活性分别降低了21.64%(p<0.01)和 23.07%(p<0.01),牛樟芝微粉高剂量组小鼠血清中ALT和AST活性则分别降低33.91%(p<0.01)和36.79%(p<0.01),呈一定量效关系。结果表明,牛樟芝微粉能改善过量酒精摄入导致小鼠急性肝损伤。
2.3 牛樟芝微粉对急性酒精肝损伤小鼠SOD、CAT、GSH-Px和MDA水平的影响
人体摄入的酒精绝大部分会在肝脏被分解代谢,并产生大量的自由基。长期或大量饮酒会导致自由基过量生成,并对肝脏组织造成氧化性损伤[1,14]。SOD、CAT和GSH-Px是机体清除自由基,抵御氧化应激的关键酶类,其活性大小直接反映了机体清除自由基的能力[15,16]。而MDA则是自由基作用于脂质所生成的脂质过氧化产物,其含量高低也间接反映了机体受自由基攻击的严重程度[17]。由表3可知,与空白对照组相比,模型组小鼠SOD、CAT和GSH-Px活性分别降低了35%(p<0.01)、30.99%(p<0.01)和35.23(p<0.01),MDA含量提高了121.43%(p<0.01),说明过量摄入酒精使小鼠肝脏处于严重的氧化应激状态,细胞抵御氧化性损伤的能力大幅降低。而与模型组相比,牛樟芝微粉中剂量组小鼠SOD、CAT和GSH-Px活性分别提高了27.48%(p<0.01)、24.91%(p<0.01)和29.91%(p<0.05),MDA 含量降低了 28.67%(p<0.01),牛樟芝微粉高剂量组小鼠SOD、CAT和GSH-Px活性则分别提高 31.25%(p<0.01)、33.32%(p<0.01)和 30.51%(p<0.05),MDA 含量降低37.87%(p<0.01),说明,该牛樟芝微粉能增强机体的抗氧化能力并改善其氧化应激机制,而发挥对急性酒精肝损伤小鼠保护作用。

表3 牛樟芝微粉对急性酒精肝损伤小鼠SOD、CAT、GSH-Px和MDA水平的影响Table 3 Effects of Antrodia camphorata powder on the levels of SOD, CAT, GSH-Px, and MDA in mice with alcohol-induced acute liver injury(¯x±s,n=10)
2.4 牛樟芝微粉对糖尿病小鼠空腹血糖值的影响
由表4可知,35 d给药期间,模型组小鼠的空腹血糖值较为稳定,且显著高于空白对照组(p<0.01)。中、高剂量牛樟芝微粉灌胃均可明显降低糖尿病小鼠的空腹血糖值,第14 d时两组小鼠的空腹血糖值与给药前相比已显著减小(p<0.05或p<0.01),且从第14 d开始,与模型组相比存在显著差异(p<0.05或p<0.01),但牛樟芝微粉低剂量组小鼠的空腹血糖值却无明显变化。此外,牛樟芝微粉中、高剂量组小鼠末次测定的血糖下降率分别为25.03%和38.24%。以上结果说明,该牛樟芝微粉具有较好的降血糖作用。
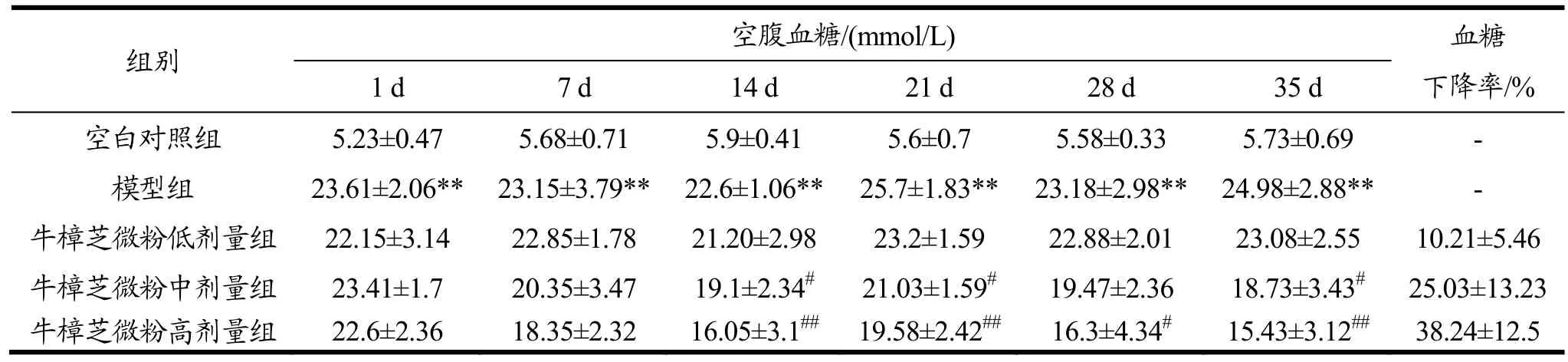
表4 牛樟芝微粉对糖尿病小鼠空腹血糖值的影响Table 4 Effects of Antrodia camphorata powder on fasting glucose in diabetic mice (¯x±s,n=10)
2.5 牛樟芝微粉对糖尿病小鼠糖耐量的影响
AUC值的大小可反映机体血糖水平的恢复能力,AUC值越小则恢复能力越强,表明治疗药物具有较好的降血糖作用。
由表5可知,35 d给药后,与模型组相比,牛樟芝微粉中、高剂量组小鼠的AUC值分别降低了14.4%(p<0.05)和27.67%(p<0.01),但牛樟芝微粉低剂量组小鼠的AUC值并无明显改变。
糖耐量实验结果表明,该牛樟芝微粉能有效控制糖尿病小鼠的餐后血糖,改善其糖耐量,提高其对葡萄糖的耐受力。
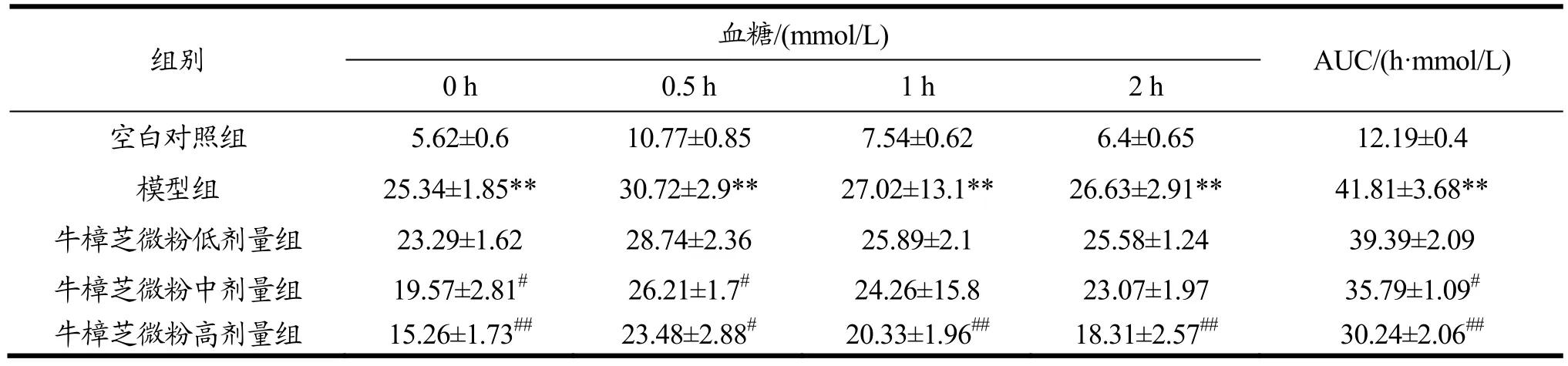
表5 牛樟芝微粉对糖尿病小鼠糖耐量的影响Table 5 Effects of Antrodia camphorata powder on glucose tolerance in diabetic mice (¯x±s,n=10)
2.6 牛樟芝微粉对糖尿病小鼠血清中TG、TC、LDL和HDL水平的影响
血脂代谢紊乱是糖尿病并发症的一种,其变化可反映机体脂质代谢的情况。由表6可知,与空白对照组相比,模型组小鼠血清中TC、TG和LDL含量分别提高了 97.47%(p<0.01)、93.27%(p<0.01)和175.61%(p<0.01),HDL 含量降低了33.33%(p<0.01),表明体内血脂代谢已出现紊乱
与模型组相比,牛樟芝微粉中剂量组小鼠血清中TC、TG和LDL含量分别降低了11.94%(p<0.05)、20.97%和30.53%,HDL含量提高了26.83%(p<0.05),牛樟芝微粉高剂量组小鼠血清中TC、TG和LDL含量则分别降低了28.36%(p<0.01)、25.32%(p<0.05)和 41.15%(p<0.05),HDL 含量提高了 25.61%(p<0.01),但低剂量牛樟芝微粉灌胃处理并无明显效果。上述结果说明,该牛樟芝微粉能在一定程度上改善糖尿病小鼠体内血脂代谢紊乱的情况。
2.7 牛樟芝功能饮料对糖尿病小鼠空腹血糖值、糖耐量和血脂代谢的影响
在验证牛樟芝微粉的功效后,以其为基本原料调配了牛樟芝功能饮料,并探讨其对糖尿病小鼠空腹血糖值、糖耐量和血脂代谢的影响。由表7~9可知,与牛樟芝微粉一致,该功能饮料能有效改善糖尿病小鼠的血糖调节能力以及由血糖代谢异常引起的血脂代谢紊乱,发挥对糖尿病小鼠的保护作用。
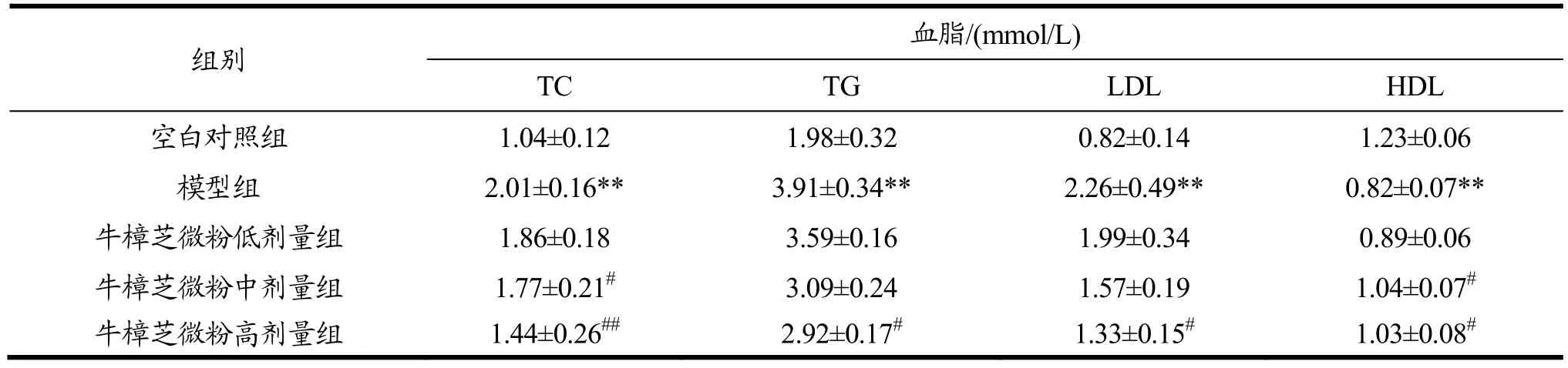
表6 牛樟芝微粉对糖尿病小鼠血清中TG、TC、LDL和HDL水平的影响Table 6 Effects of Antrodia camphorata powder on serum levels of TG, TC, LDL, and HDL in diabetic mice(¯x±s,n=10)
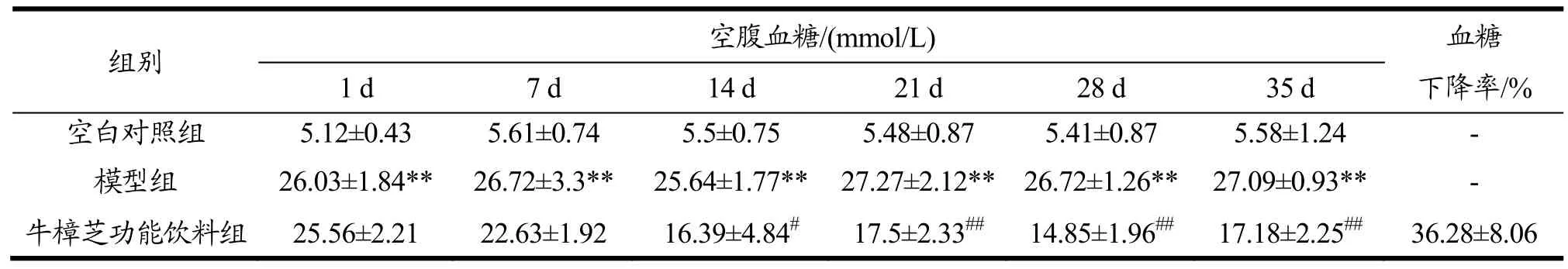
表7 牛樟芝功能饮料对糖尿病小鼠空腹血糖值的影响Table 7 Effects of Antrodia camphorata functional beverage on fasting glucose in diabetic mice (¯x±s,n=10)

表8 牛樟芝功能饮料对糖尿病小鼠糖耐量的影响Table 8 Effects of Antrodia camphorata functional beverage on glucose tolerance in diabetic mice (¯x ± s, n=10)
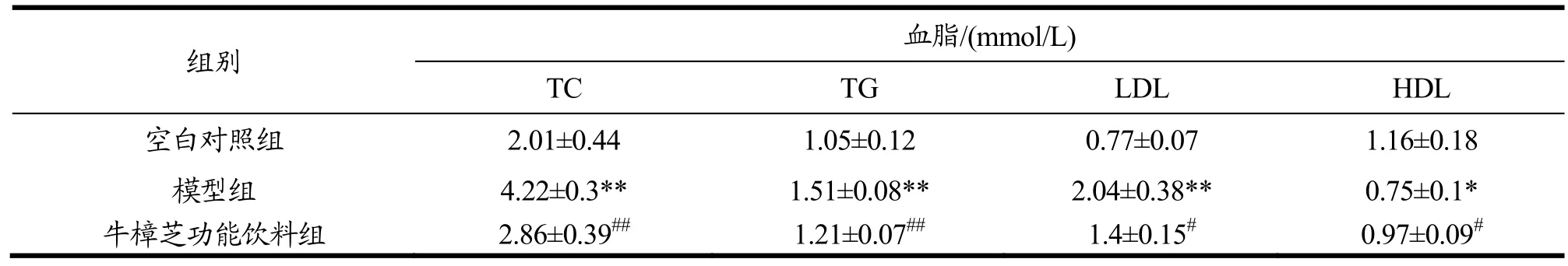
表9 牛樟芝功能饮料对糖尿病小鼠血清中TG、TC、LDL和HDL水平的影响Table 9 Effects of Antrodia camphorata functional beverage on the levels of TG, TC, LDL, and HDL in serum of diabetic mice (¯x±s,n=10)
2.8 牛樟芝微粉及其功能饮料对糖尿病小鼠肝脏中AMPK和AKT磷酸化水平的影响
AMPK是动物体内能量代谢的关键调控因素。在肝脏和肌肉中,AMPK的活化能增强脂肪酸的氧化作用以及对胰岛素的敏感性,抑制甘油三酯和胆固醇的生成,减少能量代谢[18,19]。而AKT也被报道与葡萄糖代谢以及糖尿病的发生和发展密切相关[20,21]。从图1可知,与空白对照组相比,模型组小鼠肝脏中AMPKα和AKT磷酸化水平显著降低。而与模型组相比,牛樟芝微粉(高剂量)及其功能饮料灌胃均可使小鼠肝脏中AMPKα和AKT磷酸化水平基本恢复到正常状态,由此推测,该牛樟芝微粉及其功能饮料可能通过激活AMPKα和AKT的方式来发挥降血糖以及改善血脂代谢的作用。
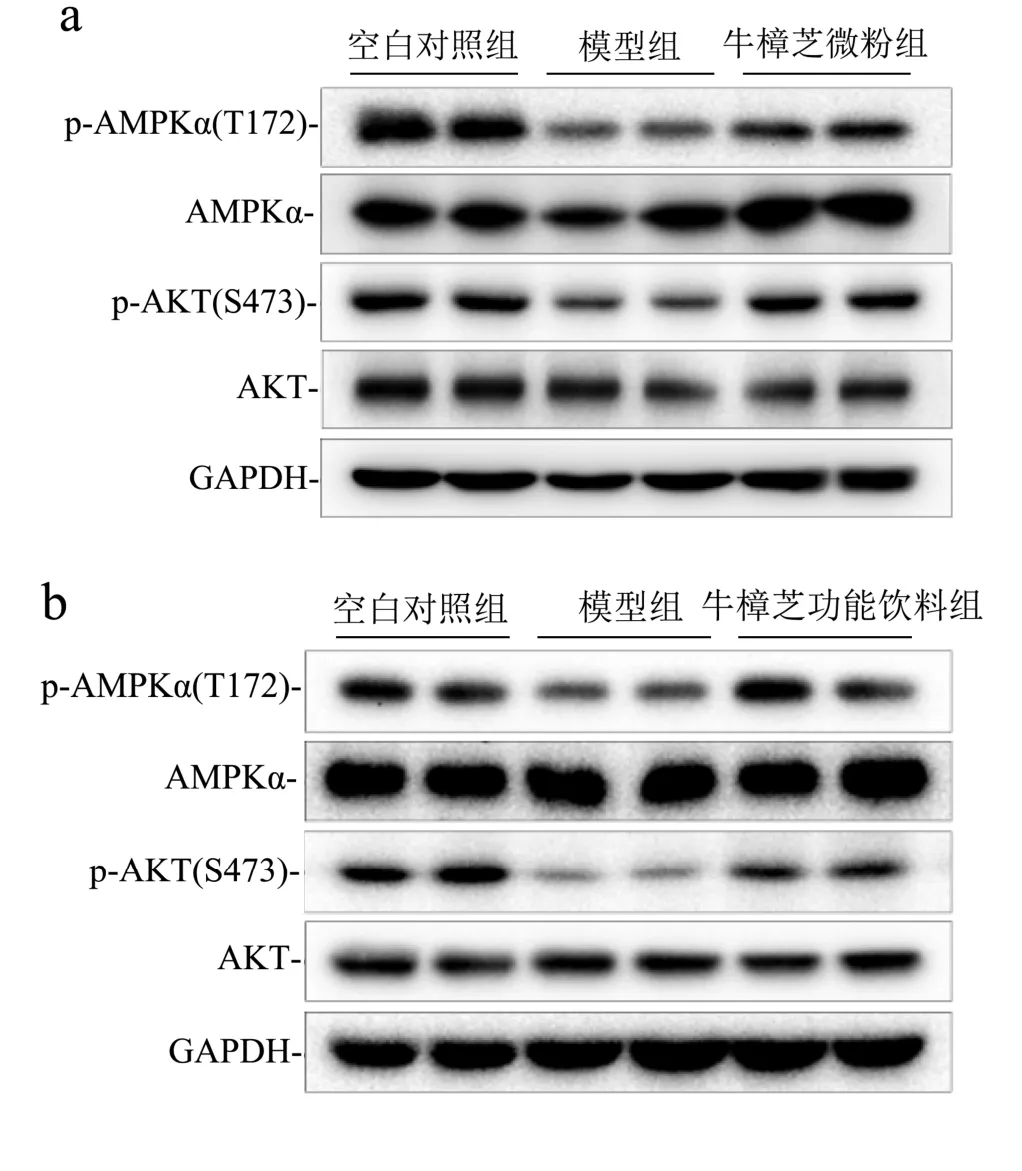
图1 牛樟芝微粉(a)及其功能饮料(b)对糖尿病小鼠肝脏中AMPKα和AKT磷酸化水平的影响Fig.1 Effects of Antrodia camphorata powder (a) and its functional beverage (b) on the phosphorylation levels of hepatic AMPKα and AKT in diabetic mice
3 结论
3.1 目前,牛樟芝固态发酵的研究和开发还处于初步阶段。固态发酵具有用水少,成本低廉,低能源消耗以及高产出等优点。与椴木栽培相比,固态发酵培养周期短且能获得具有接近野生牛樟芝功效的牛樟芝菌丝体,而与液态发酵相比,其在次级代谢产物,尤其是三萜类化合物的产生和累积方面有着明显的优势[12]。本文建立了一种牛樟芝固态发酵法,并对培养所得牛樟芝的主要功效性成分进行含量分析,结果显示,该牛樟芝富含三萜类和多糖类化合物。此外,该固态发酵法生产成本低,培养周期较短,且对环境友好,故具有潜在的开发和应用前景。
3.2 酒精代谢失调所导致的氧化应激以及炎症等是造成酒精性肝病的重要原因[1,14]。本文通过乙醇诱导的急性酒精肝损伤小鼠模型,探讨经培养基优化所得牛樟芝微粉的抗氧化及肝保护功效。由实验结果可知,乙醇诱导的急性肝损伤小鼠血清中ALT和AST活性以及MDA含量明显高于空白对照组小鼠,而SOD、CAT和GSH-Px活性则显著降低,表明模型组小鼠的肝脏已发生严重的氧化性损伤,而中、高剂量牛樟芝微粉灌胃处理可降低ALT和AST活性,抑制MDA含量增加,同时提高SOD、CAT和GSH-Px活性,说明通过该固态发酵法所得牛樟芝微粉对过量摄入乙醇所致的小鼠急性肝损伤具有一定的预防保护作用,且是通过增强机体抗氧化能力,缓解氧化性损伤而实现。
3.3 糖尿病主要临床表征是持续性的高血糖状态,如不加以控制会导致多种急、慢性并发症的产生,因此,能否有效控制血糖水平与糖尿病并发症的发生密切相关[6,22]。此外,血脂代谢紊乱在糖尿病患者中较为常见,具体表现为过高甘油三酯、总胆固醇以及低密度脂蛋白[23]。STZ是一种特异性的胰岛β细胞毒剂,可选择性破坏小鼠的胰岛β细胞,诱发小鼠高血糖,形成实验性糖尿病模型[24]。从STZ诱导糖尿病小鼠的相关实验结果可以看到,中、高剂量牛樟芝微粉及其功能饮料均能有效降低糖尿病小鼠的空腹血糖值和糖耐量,同时抑制血清中TC、TG和LDL含量升高以及HDL含量降低,表明通过该固态发酵法所得牛樟芝微粉及其功能饮料具有辅助降血糖以及改善血脂代谢的功效。进一步的免疫印迹结果显示,该牛樟芝微粉及其功能饮料均能显著上调糖尿病小鼠肝脏中 AMPKα和 AKT磷酸化水平,揭示该牛樟芝微粉及其功能饮料可能是通过调控机体能量代谢相关因子的表达进而发挥对糖尿病小鼠保护作用。综上所述,本文建立并验证了一种能产出高质且培养周期较短牛樟芝的固态发酵法,且经该固态发酵法所得牛樟芝微粉具有护肝、降血糖以及改善血脂代谢紊乱功效,其作用机制可能与其能提高机体抗氧化能力、调控能量代谢相关因子的表达有关。同时,本文还为牛樟芝固态发酵研发做一定补充,也为相关功能产品的研发奠定了重要基础。

