紫芜菁乙醇提物对Caco-2细胞氧化损伤的保护作用
宋家乐,钱波,王程强,曾榛,桂中玉,周燕园
(1.桂林医学院公共卫生学院,广西桂林 541100)(2.东南大学公共卫生学院,江苏南京 210009)(3.广西高校预防医学重点实验室,广西桂林 541100)(4.桂林医学院药学院,广西桂林 541100)
紫芜菁(Brassica rapavarL)又称蔓菁、大头菜、卜留克或恰玛古(维吾尔语),属十字花科芸苔属芜菁种两年生植物,主产地为我国新疆、西藏和东北地区,目前全国范围内都有种植。芜菁是传统的药食同源植物,其食用部分为地下肉质根。研究发现,芜菁含有丰富的多糖、皂苷、酚类、硫代葡萄糖苷类化合物及挥发油等功能性成分[1],具有抗衰老[2]、抗缺氧[3,4]、体内抗氧化[5]、抗肿瘤[6]和降血糖功效[7,8]等功效。
过度的氧化应激所导致的各种组织和细胞中细胞膜结构的改变,细胞代谢酶类和功能蛋白失活、遗传物质的损伤以及细胞发生脂质过氧化反应都是各种退行性疾病发生的主要原因[9]。在人体中,肠道不仅仅担负有消化功能,同时也是氧化应激损伤的主要靶器官之一。氧化应激会扰乱小肠上皮细胞的正常生理功能,造成其所构成的物理性肠道屏障功能丧失,并导致肠腔内细菌、毒素及其他有害物质进入血液系统引发肠道溃疡,结肠炎并直接造成结-直肠癌等重大疾病的发生[10]。
目前,就紫芜菁对于肠道上皮细胞氧化应激损伤后的保护作用的研究鲜见报道。人结肠癌Caco-2细胞因其存在有与正常小肠上皮细胞类似的紧密连接、微绒毛等相关结构,并具有相关代谢酶系和分泌功能等特点而被认为是一株用于研究肠道屏障损伤与修复机制的经典细胞系[11]。因此,本实验拟利用 H2O2处理Caco-2人结肠癌上皮细胞制备细胞氧化损伤模型,研究紫芜菁乙醇提取物对细胞氧化损伤的保护并探讨可能的机制。
1 材料与方法
1.1 材料与试剂
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、脱氧核糖、硫代巴比妥酸(thiobarbituric acid,TBA)、三氯乙酸(trichloroacetic acid,TCA)、二甲基亚砜(dimethyl sulfoxide,DMSO)、过氧化氢(H2O2)、抗坏血酸、脱氧核糖和叔丁基对苯二酚(tertiary butylhydroquinone,TBHQ):美国Sigma公司;DMEM 高糖型细胞培养液、青霉素-链霉素双抗、胰蛋白酶-EDTA消化液、胎牛血清(fetal bovine serum,FBS)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、2’,7’-二氢二氯荧光黄双乙酸钠(dichloro-dihydro-fluorescein diacetate,DCFH-DA)、磷酸盐缓冲液(phosphate buffered saline,PBS):美国Thermo Scientific公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)和乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒:南京建成生物工程研究所;IL-1β与IL-8试剂盒:美国Cloud colon公司;Bio-Rad Quick Start Bradford试剂盒:美国Bio-Rad公司。其他化学试剂均为国产分析纯。新鲜紫芜菁样品购自桂林市蔬菜科学研究所。
1.2 仪器与设备
EYELA N-1001S真空旋转蒸发仪:东京理化器械株式会社;Biotek Elx808酶标仪:美国伯腾仪器有限公司;756S紫外可见光分光光度计:上海棱光技术有限公司;Thermo 3110二氧化碳细胞培养箱:美国Thermo公司;AL204电子分析天平:梅特勒-托利多公司上海有限公司;电热恒温水浴锅HWS-28:上海一恒科学仪器有限公司;FLUOstar OPTIMA荧光酶标仪:德国BMG公司。
1.3 实验细胞株
Caco-2人结肠腺癌细胞系(源自中国科学院上海细胞资源中心)由桂林医学院生物技术学院邹先琼教授馈赠。
1.4 紫芜菁乙醇提取物的制备
新鲜紫芜菁可食部去除杂叶后,以双蒸水冲洗并行真空冷冻干燥。冻干的紫芜菁经粉碎后过60目筛备用。取紫芜菁粉(100 g)中加入500 mL乙醇后在室温条件下搅拌浸提6 h。滤液经3000 r/min离心15 min后弃渣收集上清,50 ℃真空减压旋转蒸发后,制成紫芜菁乙醇提取物(收率为41.2%),-80 ℃储存待用。
1.5 紫芜菁乙醇提取物的体外抗氧化能力
1.5.1 DPPH自由基清除能力测定
在 100 μL不同浓度的紫芜菁乙醇提取物中加入等量的DPPH标准液(150 μmol/L)后混匀,室温避光处反应30 min,酶标仪测定517 nm处值并计算清除率。清除率(%)=[1-(A样品组-A样品空白组)/A空白组]×100%。
1.5.2 ·OH自由基清除能力测定
不同浓度的紫芜菁乙醇提取物(200 μL)中,分别加入脱氧核糖(60 mmol/L),H2O2(10 mmol/L),PBS(50 mmol/L,pH 7.5),氯化铁溶液(1 mmol/L),EDTA溶液(1.04 mmol/L)和抗坏血酸溶液(4 mmol/L)各 200 μL。37 ℃水浴1 h后,加入1% TBA溶液(1 mL)和2.8%TCA 溶液(1 mL)并继续在 90 ℃水浴条件下反应 30 min后用分光光度计测定 OD532nm值计算清除率。清除率(%)=[1-(A样品组-A样品空白组)/A空白组]×100%。
1.5.3 总还原力测定
适量样品用PBS(20 mmol/L,pH 6.6)配成1 mL的样品液后,加入1 mL铁氰化钾溶液(10 mg/mL)混匀。50 ℃水浴中孵育20 min后加入200 μL的TCA溶液(100 mg/mL),3000 r/min条件下离心10 min。上清液(0.5 mL)中加入等量蒸馏水和0.1 mL的氯化铁溶液(1 mg/mL)混匀,分光光度计测定OD700nm值。
1.6 紫芜菁乙醇提取物对细胞氧化损伤的保护效果
1.6.1 细胞培养及分组
Caco-2细胞用DMEM细胞培养液(含10%FBS与1%青-链霉素双抗液)置于37 ℃、5% CO2环境下湿化培养。细胞贴壁长至培养皿80%时,胰蛋白酶-EDTA液按比例消化传代,取指数期细胞用于实验。以DMEM培养液(含150 μmol/L的H2O2)处理细胞4 h制备损伤细胞模型。模型细胞以不同质量浓度的紫芜菁乙醇提取物(10 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL)继续培养24 h并进行后续实验。正常组为未经过任何处理的正常Caco-2细胞。
1.6.2 MTT法测定细胞存活率及LDH脱氢酶水平
细胞按前述分组处理并进行24 h培养后,弃孔内培养基并加入终质量浓度为0.5 mg/mL的MTT试剂(100 μL)继续培养4 h。培养结束后弃上清液,每孔加入DMSO(100 μL)避光振荡30 min,测定OD490nm后按公式:细胞生存率(%)=OD样品组/OD正常组×100来计算细胞生存率。
1.6.3 样品对细胞内MDA生成量的测定
细胞用预冷的PBS冲洗3次,细胞刮刀收集细胞后,加入细胞裂解液在冰上裂解细胞。细胞裂解液(500 μL)与反应液(15%的TCA与0.67%TBA混合液,400 μL)充分混匀后在95 ℃水浴中孵育20 min。待冷却后,加入异丙醇(3 mL)提取色素并测定OD532nm,试剂盒定量细胞总蛋白量。按照公式 MDA 生成量/(μmol/mg protein)=[MDA含量(μmol/mL)×1.5 mL]/总蛋白质含量(mg)计算MDA生成量。
1.6.4 样品对细胞内ROS水平的测定
依前述处理细胞后,加入 DMEM 培养液(DCFH-DA,20 μmol/L)在 37 ℃条件下孵育 20 min,PBS冲洗细胞2次后收集细胞。在激发波长为485 nm,发射波长为530 nm的条件下用FLUOstar OPTIMA荧光酶标仪测定荧光强度,按照公式:相对ROS水平/%=荧光强度样品处理组/荧光强度正常组×100 进行计算。
1.6.5 样品对细胞内抗氧化物酶(SOD、CAT和GSH-Px)活力的测定
取适量经过处理的细胞裂解液按照SOD、CAT和GSH-Px测定试剂盒说明书步骤操作。细胞内总蛋白用Bio-Rad蛋白质定量试剂盒测定。细胞内抗氧化物酶活力用细胞内总蛋白量进行校正并以酶比活力单位(U/mg pro)表示。
1.6.6 样品对细胞内炎性细胞因子 IL-1β与IL-8分泌水平的测定
细胞接种到培养板并依前述方法处理后,4 ℃下收集细胞培养上清液。取适量培养上清液按照 IL-1β与 IL-8测定试剂盒说明书步骤操作并用细胞总蛋白质含量作校正。
1.7 数据处理与统计分析
本研究中,所有实验均重复 3次,结果以均值(means)±标准偏差(SD)表示。所得实验数据运用SPSS 20.0统计软件进行单因素方差分析与统计处理,p<0.05为具有统计差异。
2 结果与讨论
2.1 紫芜菁乙醇提取物的体外抗氧化能力


图1 紫芜菁乙醇提取物的体外DPPH(a)和·OH(b)自由基的清除能力与总还原力(c)Fig.1 The radical scavenging (DPPH and ·OH) activities and total reducing power of BREE in vitro
DPPH自由基清除能力实验是一种常用于检测物质是否具有抗氧化性的体外定性实验[7]。·OH自由基除本身的化学性质活泼之外,还具有极强的生物大分子破坏力。紫芜菁乙醇提取物对DPPH和·OH自由基都具有较好的清除能力,且清除力随提取物质量浓度的增高而增加显著(图1)。其中,较高浓度的紫芜菁乙醇提取物(250 μg/mL 和500 μg/mL)清除DPPH的能力要略强于人工合成抗氧化剂TBHQ。而·OH自由基清除能力方面,紫芜菁乙醇提取物则要弱于 TBHQ(图1b)。
具有较强还原能力的物质依靠自身提供电子与自由基进行配对从而降低自由基活性可以从某种程度上间接反映出其体外抗氧化能力的强弱[8]。随着紫芜菁乙醇提取物浓度的增加,其总还原力也随之增强,并呈现出剂量效应关系(图1C)。但是,紫芜菁乙醇提取物的总还原能力与TBHQ相比较弱。
2.2 紫芜菁乙醇提取物的对H2O2所致Caco-2细胞生存率和细胞LDH释放水平的影响
如表1所示,经4 h的H2O2(150 μmol/L)直接处理后显著造成Caco-2细胞生存率下降(p<0.05)。而紫芜菁乙醇提取物处理可以明显改善受损细胞的生存率(表1)。紫芜菁对受损Caco-2细胞的保护效果随其乙醇提取物的质量浓度增加而增强,并呈现出显著的剂量效应关系(p<0.05)。在经 100 μg/mL 和 200 μg/mL 的紫芜菁乙醇提取物处理后,细胞的生存率分别达到75.6%和83.2%。生存率分别较未经处理的模型细胞生存率增高1.56倍和1.72倍。正常情况下,乳酸脱氢酶(LDH)属于一种稳定存在细胞内部的酶,一旦细胞遭受应激损伤后能迅速释放到细胞外。因此,LDH是一种常用于衡量细胞激损伤后的生物指标物[9]。较正常细胞相比,H2O2(150 μmol/L)处理显著造成Caco-2细胞内的LDH外溢(p<0.05)。而紫芜菁乙醇提取物处理可以显著抑制受损Caco-2细胞中LDH的溢出,且抑制效果存在显著的剂量效应关系(p<0.05)。高浓度紫芜菁乙醇提取物(100 μg/mL和200 μg/mL)分别处理细胞后,细胞 LDH溢出水平分别较未经处理的模型细胞LDH溢出水平降低43%和52%。

表1 紫芜菁乙醇提取物对H2O2所致Caco-2细胞生存率和细胞LDH释放水平的影响Table 1 Effects of BREE on the cell viability and LDH levels in intestinal Caco-2 cells treated with H2O2
2.3 紫芜菁乙醇提取物对H2O2所致Caco-2细胞内ROS水平和MDA含量的影响
细胞内部过度蓄积的 ROS是造成细胞正常生理反应失调,也是引发DNA断裂,造成细胞凋亡,甚至是细胞死亡的重要因素之一[10]。如表2示,H2O2(150 μmol/L)处理能显著造成Caco-2细胞内ROS水平升高(p<0.05)。而经不同浓度紫芜菁乙醇提取物(10 μg/mL、50 μg/mL、100 μg/mL 和 200 μg/mL)处理后,细胞内ROS生成水平呈显著的下降趋势。损伤细胞内 ROS水平在经高浓度芜菁乙醇提取物(200 μg/mL)处理后降至最低(238.98%),即较模型细胞中ROS水平下降了34%。MDA是细胞内不饱和脂肪酸发生过氧化反应生成所产生的氧化终产物,也是常用于评估细胞氧化损伤的程度的生物指示物之一,具有较强的生物毒性[11]。H2O2显著造成Caco-2细胞中MDA含量升高(p<0.05)。经不同浓度紫芜菁乙醇提取物(10 μg/mL、50 μg/mL、100 μg/mL 和 200 μg/mL)处理后,受损细胞中所MDA含量呈递减趋势,且与模型组相比较具有显著性差异(p<0.05)。高浓度紫芜菁乙醇提取物(100 μg/mL和200 μg/mL)分别处理细胞后,细胞中MDA水平分别较未经处理的模型细胞中 MDA水平降低33%和37%。结果提示,紫芜菁乙醇提取物能有效抑制氧化应激所致细胞脂质过氧化反应并降低 ROS水平的升高。

表2 紫芜菁乙醇提取物对H2O2所致Caco-2细胞内ROS水平和MDA含量的影响Table 2 Effects of BREE on the ROS and MDA levels in intestinal Caco-2 cells treated with H2O2
2.4 紫芜菁乙醇提取物对H2O2所致Caco-2细胞内CAT、SOD和GSH-Px酶的影响
许多临床疾病的发生往往与体内过多的活性氧积聚所引发的氧化-抗氧化平衡失衡有关[12]。SOD、CAT和GSH-Px等细胞内源性抗氧化物酶在生命体对抗氧化应激损伤过程中发挥着至关重要的作用[13]。如表 3所示,H2O2处理显著抑制Caco-2细胞中SOD,CAT和GSH-Px的酶活性。相反,经不同浓度紫芜菁乙醇提取物处理24 h后,受损细胞内SOD,CAT和GSH-Px等酶的活性逐渐增高,且较未经紫芜菁乙醇提取物处理过的损伤模型组相比具有显著性差异(p<0.05)。高浓度紫芜菁乙醇提取物(100 μg/mL和200 μg/mL)分别处理细胞后,细胞中SOD水平分别较模型细胞中SOD水平增高1.52倍和1.61倍。SOD除可以直接清除细胞内积聚的自由基,阻断细胞膜多价不饱和脂肪酸发生脂质过氧化反应,以此抑制MDA和4-羟基壬烯酸(4-hydroxynonenal,HNE)等细胞毒性物质的生成[14]。在GHS-Px酶活力方面,高浓度紫芜菁乙醇提取物(100 μg/mL和200 μg/mL)可使处理后细胞中GHS-Px水平分别较模型细胞中 GHS-Px水平增高1.63倍和1.72倍。细胞内非酶性抗氧化物质谷胱甘肽(GSH)则能在GSH-Px的作用下转变为氧化型谷胱甘肽,从而参与将有毒的过氧化物还原成羟基化合物过程。同时,GSH-Px还能与CAT一起促H2O2分解生成水,保障细胞正常生理功能,维持细胞相关结构来对抗氧化应激损伤[15]。此外,高浓度紫芜菁乙醇提取物(100 μg/mL和200 μg/mL)可使处理后细胞中CAT水平分别较模型细胞中CAT水平增高1.86倍和1.87倍。
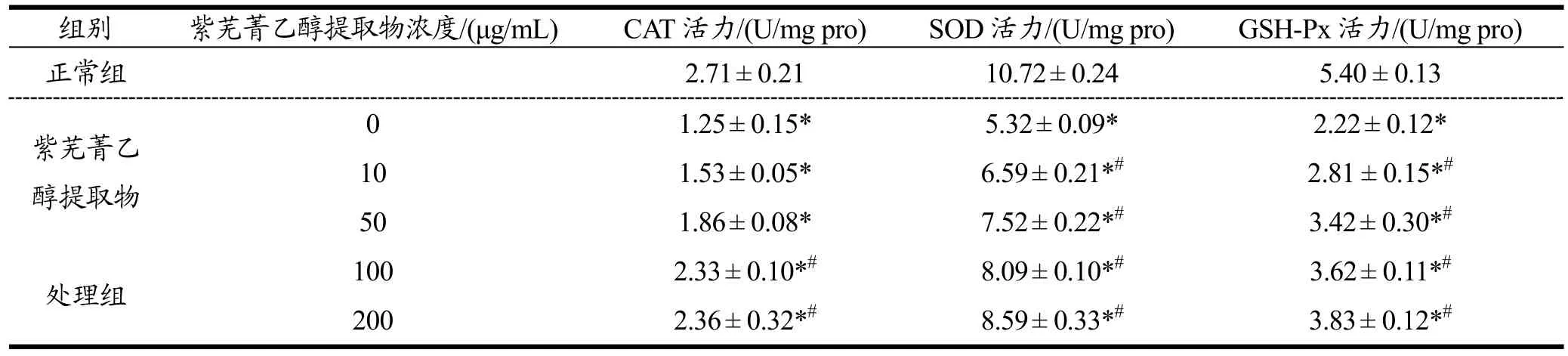
表3 紫芜菁乙醇提取物对H2O2所致Caco-2细胞内CAT、SOD和GSH-Px酶的影响Table 3 Effects of BREE on the CAT, SOD and GSH-Px levels in intestinal Caco-2 cells treated with H2O2
2.5 紫芜菁乙醇提取物对H2O2所致Caco-2细胞内IL-1β和IL-8分泌水平的影响
如图2所示,150 μmol/L的H2O2处理能显著造成Caco-2上皮细胞内炎性细胞因子IL-1β和IL-8的过度分泌(p<0.05)。经不同浓度(10 μg/mL、50 μg/mL、100 μg/mL和200 μg/mL)的紫芜菁乙醇提取物处理后,受损Caco-2细胞中IL-1β与IL-8的分泌被抑制,并呈现一定的剂量效应关系。其中,高浓度紫芜菁乙醇提取物(100 μg/mL和200 μg/mL)可使处理后细胞中IL-1β水平分别较模型细胞中 IL-1β水平降低 45.9%和55.2%。在IL-8水平方面,高浓度紫芜菁乙醇提取物可使处理后细胞中 IL-8水平分别较模型细胞中 IL-8水平降低52.3%和70.6%。IL-1β和IL-8等炎性细胞因子的过度活化是诱发肠道组织内炎症发生的重要因素之一[16,17],同时也在溃疡性结肠(ulcerative colitis)和克罗恩病(Crohn’s disease)这两类主要的肠道炎症疾患(intestinal bowel disease,IBD)及其IBD相关性结肠癌变(IBD associated colorectal carcinogenesis)的病理生理发生过程中扮演着非常重要的角色[18]。抑制IL-1β和IL-8炎症细胞因子的过度表达,可以降低肠道组织炎性环境,缓解IBD症状并能降低IBD相关癌变的发生风险[19~21]。

图2 紫芜菁乙醇提取物对H2O2所致氧化损伤Caco-2细胞中IL-1β与IL-8分泌水平的影响Fig.2 Effects of BREE on the secretion levels of IL-1β and IL-8 levels in intestinal Caco-2 cells treated with H2O2
3 结论
本研究通过体外自由基清除实验和总还原力测定来评估紫芜菁乙醇提取物的体外抗氧化能力。利用H2O2诱发人小肠上皮Caco-2细胞氧化损伤模型来研究紫芜菁乙醇提取物对氧化应激损伤细胞的保护作用。本研究结果提示紫芜菁乙醇提取物对体外自由基(DPPH和·OH)具有较强的清除能力,并具有较强的总还原力。在细胞研究水平上,紫芜菁乙醇提取物能显著抑制H2O2所引起的Caco-2细胞死亡,提高受损细胞的生存率。此外,紫芜菁乙醇提取物不仅能够提高受损细胞中SOD、CAT和GSH-Px等三种重要内源性抗氧化物酶活性,同时还能显著抑制受损细胞中应激损伤标志物MDA和ROS的生成。本研究结果提示,增强细胞内源性抗氧化物酶的活性可能是紫芜菁乙醇提取物对氧化应激损伤细胞具有保护作用的潜在机制之一。在今后的研究中,应从分子层面针对紫芜菁乙醇提取物是否对参与调控特定的信号通路以对抗外源刺激物所诱发的细胞氧化应激损伤展开研究。

