乳制品中A1β-酪蛋白、A2β-酪蛋白含量的测定
袁兆丰,杨秀梅,王 丹
北大荒完达山乳业股份有限公司,黑龙江哈尔滨150000
0 引言
牛乳中主要包含酪蛋白、乳白蛋白、乳球蛋白和乳铁蛋白等。其中酪蛋白是乳蛋白的主要存在形式,占乳蛋白总量的80%,含有人体必需的8 中氨基酸[1];β-酪蛋白是一种主要的酪蛋白,由209 个氨基酸残基组成,磷酸化前的一级结构分子质量为23.6 kDa[2],占牛乳蛋白总量的24%~28%[3]。
A2β-酪蛋白是现代奶牛β-酪蛋白的天然原型。早期所有家养奶牛只含有A2β-酪蛋白,后因自然基因突变,出现了A1β-酪蛋白的变体,经过长期的繁衍,导致全球奶牛普遍出现了A1 型奶牛、A1A2型奶牛和A2型奶牛。A1β-酪蛋白和A2β-酪蛋白的蛋白质结构区别主要是第67位的氨基酸不同[4],A1 β-酪蛋白是组氨酸,分子量155 Da,A2β-酪蛋白是脯氨酸,分子量115.13 Da。A1 β-酪蛋白和 A2 β-酪蛋白的分子量相差39.87 Da,占β-酪蛋白分子量23.6 kDa的0.17 %。A1 β-酪蛋白和 A2 β-酪蛋白的质量分数相差非常小,不到千分之二。
通过消化酶的作用,A1β-酪蛋白可能产生β-酪啡肽-7(BCM-7),而A2β-酪蛋白不会产出或很少产出β-酪啡肽-7(BCM-7)[5]。BCM-7是一种外啡肽,可与机体多种系统相互作用。多项研究表明,A1β-酪蛋白或BCM-7与部分婴儿的I型糖尿病风险升高[6],免疫反应功能性障碍、消化功能紊乱、呼吸功能障碍以及易得自闭症之间存在关联[7]。另有研究表明,A2β-酪蛋白不仅不会生成BCM-7,而且与母乳中的β-酪蛋白相似,更有利于促进婴幼儿的生长发育。
本试验在原有检测方法的基础上,只改变柱温和梯度洗脱中部分时间段的流动相比例,使A1β-酪蛋白和A2β-酪蛋白能够更好的分离,为牛乳中A1β-酪蛋白和A2β-酪蛋白的进一步研究和婴幼儿配方乳粉开发提供参考。
1 原理与方法流程
1.1 原理
乳及其制品加水溶解后,吸取1 mL液态样品加入一定量的蛋白质变性剂盐酸胍和还原剂二硫苏糖醇等化学药品,经前处理后高速低温离心,离心结束后取出离心管,快速除去表层乳脂,取下清液加入盐酸胍溶液后过滤膜上机检测,在柱温50 ℃条件下,使用0.1 %三氟乙酸溶液和乙腈,通过梯度洗脱分离上机样液中的A1β-酪蛋白、A2β-酪蛋白,高效液相紫外色谱仪214 nm波长下检测,外标法定量。
1.2 步骤
1.2.1 试剂耗材
乙腈(C2H3N)(色谱纯),三氟乙酸(色谱纯),双-三羟甲基氨基甲烷(分析纯),盐酸胍(分析纯),柠檬酸钠(分析纯),二硫苏糖醇(分析纯),β-酪蛋白(β-Casein,CAS号:9000-71-9),纯度≥98 %,C8色谱柱,4.6 mm×150 mm,3.6 μm。
1.2.2 试剂配制
试剂I:分别称取双-三羟甲基氨基甲烷0.2092 g,盐酸胍5.7318 g,柠檬酸钠0.0139 g,二硫苏糖醇0.0301 g,加0.1%三氟乙酸溶液5 mL,充分溶解后定容10.0 mL,混匀得双-三羟甲基氨基甲烷0.1 mol/L,盐酸胍6 mol/L,柠檬酸钠5.37 mmol/L,二硫苏糖醇19.5 mmol/L混合溶液。
试剂II:称取盐酸胍4.2989 g,加0.1 %三氟乙酸溶液5.00 mL充分溶解后定容10.0 mL,混匀得4.5 mol/L盐酸胍溶液。
流动相A 0.1 %三氟乙酸水溶液:吸取1.00 mL三氟乙酸于1 000 mL容量瓶中,水定容,混匀;流动相B纯乙腈。
β-酪蛋白标准溶液配制:将大块的β-酪蛋白标准物质分成小片絮状后放入25 mL小烧杯,在使用注射器加水时有助于更好的溶解,水平晃动烧杯,不可涡漩,防止泡沫产生[8],溶解后转移到25 mL容量瓶用超纯水定容,混匀后1.0 mL分装在1.5 mL离心管中,-20 ℃保存,现用现取,避免反复融化冷冻,可稳定保存3 个月。
1.2.3 试样处理
称取1 g固体试样,温水溶解,冷却后定容10 mL,混匀。
液体奶试样不用稀释,吸取液态样品1.00 mL转入2.00 mL离心管中,向2.00 mL离心管中加入1 mL试剂I振荡混匀后,静置1 h,转速6 000 r/min、4 ℃离心10 min,离心结束后取出离心管,快速除去表层乳脂,取底层溶液300.0 μL转移到新的2.00 mL离心管中,加入试剂II 900.0 μL,混匀,过针式滤膜上机备用。
1.2.4 检测条件
检测波长214 nm,柱温50 ℃,流动相A (0.1 %三氟乙酸水溶液),流动相B(乙腈),梯度洗脱条件如表1。

表1 梯度洗脱条件
1.3 线性相关
配制β-酪蛋白系列标准工作液,5 个浓度点3 个平行上机检测,以各浓度为横坐标,各浓度峰面积平均值为纵坐标绘制线性方程。
1.4 正确度、精密度
β-酪蛋白含量做低、中、高三水平加标回收试验,各浓度水平6 个平行,按试样处理方法处理加标样品,计算加标回收率。
1.5 结果计算
A2β-酪蛋白和 A1β-酪蛋白的质量分数相差非常小,不到千分之二,其性质非常接近,两目标峰比较接近(图1),A1β-酪蛋白浓度占比与A1 β-酪蛋白峰面积占比相当,A2β-酪蛋白浓度占比与A2β-酪蛋白峰面积占比相当。β-酪蛋白的主要成分为A1型和A2型,通过面积归一化法,A1β-酪蛋白和 A2β-酪蛋白峰面积和为总峰面积,A1β-酪蛋白峰面积占总峰面积百分比w1,A2β-酪蛋白峰面积占总峰面积百分比w2。计算公式见公式(1),公式(2)。
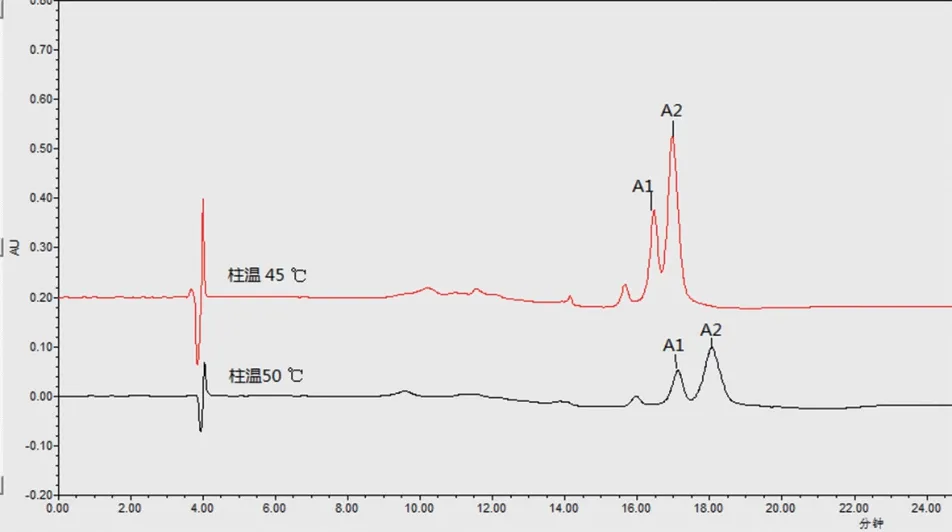
图1 β 酪蛋白标准物质在不同检测条件下的峰型比较
计算公式:
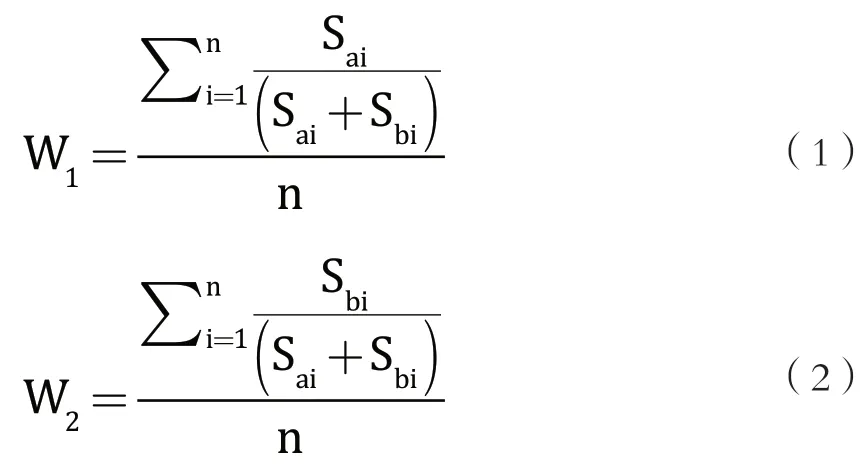
公式(1)、(2)中:
w1----A1 β-酪蛋白浓度修正系数,单位百分比(%);
w2----A2 β-酪蛋白浓度修正系数,单位百分比(%);
i----标准曲线的中第i个浓度级别,(i取1、2、3、···、n);
n----标准曲线中浓度级别的个数,(n取1、2、3、···、n);
Sa----积分得A1 β-酪蛋白峰面积;
Sb----积分得A2 β-酪蛋白峰面积;
Σ----求和函数符号,i从1开始到n取整数。
标准系列工作液β-酪蛋白浓度为A1β-酪蛋白与A2β-酪蛋白浓度的和。则A1β-酪蛋白浓度占比为w1,A2β-酪蛋白浓度占比为w2,β-酪蛋白标准系列工作液各浓度点的w1、w2取平均值分别作为A1 β-酪蛋白和 A2β-酪蛋白的修正系数。
通过标准系列工作液β-酪蛋白浓度计算的A1 β-酪蛋白与A2β-酪蛋白在乘以各自的修正系数后,即为样品中检测的A1β-酪蛋白与A2β-酪蛋白浓度,根据称样质量,定容体积计算样品中A1β-酪蛋白与A2β-酪蛋白的含量。计算公式见公式(3)。

公式(3)中:
X----试样中A1β-酪蛋(A2β-酪蛋白)含量,单位毫克每克(mg/g);
c----由标准曲线得到的试样溶液中β-酪蛋白的浓度,单位毫克每毫升(mg/mL);
V----试样定容体积,单位毫升(mL);
f----稀释倍数;
V1----液态试样取样体积,单位毫升(mL)
V2----加入试剂I的体积,单位毫升(mL);
V3----样液离心后提取澄清液的体积,单位毫升(mL);
V4----加入试剂II的体积,单位毫升(mL);
w----试样中A1 β-酪蛋(A2 β-酪蛋白)浓度修正系数,单位%;
m----样品的称样质量,单位克(g)。
2 检测结果分析
2.1 不同检测条件的检测结果比较
相同条件下,只改变柱温和部分时间段的流动相比例,柱温45 ℃,A流动相占比:12 min时59 %、15 min时61.5 %(图1红色线图谱);柱温50 ℃,A流动相占比:12 min时60 %、15 min时58.5 %(图1黑色线图谱),梯度洗脱中改变乙腈的变化趋势,提高柱温,能够更好的分离A1β-酪蛋白与A2β-酪蛋白。
2.1 线性关系
使用β酪蛋白标准储备液配制标准工作液,流动相B(乙腈),A(0.1 %三氟乙酸水溶液),流速0.5 mL/min梯度洗脱,柱温50 ℃,反相色谱柱进行分离,紫外检测器214 nm检测。A1 β-酪蛋白与A2 β-酪蛋白的出峰时间稳定(图2),回归方程:A1 β-酪蛋白,y=1.25×106x-1.44×105,R2=0.9985,R=0.9992;A2 β-酪蛋白y=3.16×106x-3.16×105,R2=0.9988,R=0.9994。A1 β-酪蛋白在0.16~1.65 mg/mL和A2 β-酪蛋白在0.34~3.35 mg/mL浓度范围内线性关系良好。
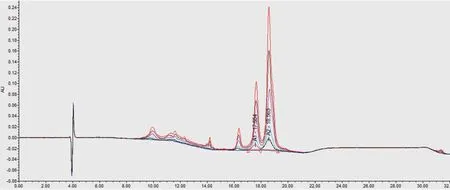
图2、 A1β-酪蛋白、A2β-酪蛋白各浓度点标准工作液
2.2 精密度、正确度
对奶样做三水平加标回收试验,A1β-酪蛋白精密度小于2.0 %,回收率范围96.4%~105.0%;A 2 β-酪蛋白精密度小于2.0 %,回收率范围97.5%~105.0%。图3为β-酪蛋白标准物质和奶样中A1β-酪蛋白和A2β-酪蛋白。

图3 β-酪蛋白标准物质与奶样中A1 β-酪蛋白和A2 β-酪蛋白的峰型及出峰时间比对
3 结论
奶样经前处理后,在低温离心机离心后,吸取下层的酪蛋白,经稀释后上机检测。在柱温50 ℃时,梯度洗脱条件下,在4.6 mm×150 mm,3.6 μm的C8色谱柱中,A1β-酪蛋白和A2β-酪蛋白能够有效的分离,通过β-酪蛋白标准物质定量,再通过A1β-酪蛋白与A2β-酪蛋白修正系数,对A1 β-酪蛋白与A2β-酪蛋白的含量做修正计算。通过分析检测结果,说明检测方法线性关系良好,具有较好的精密度和正确度,可以对乳制品中的A1β-酪蛋白和A2β-酪蛋白做定量分析,具有较高的稳定新。C

