miR-26a与EZH2蛋白的关系及其对肺癌细胞的增殖和凋亡行为的影响
高 阳,陈 红
肺癌是全球最常见的恶性肿瘤之一,总体生存率约15%[1]。肺癌早期诊断取决于胸部X线和痰细胞学检查[2],但是往往患者在确诊时病情已发生进展,所以需要明确肺癌的发病机制,了解其分子生物学的变化。近年,miRNA作为一类极具潜力的分子生物标记物得到了越来越多学者的认可[3],其在肺癌发病机制中起到关键作用,且其表达变化也与肺癌的状态息息相关[4]。有研究报道,组蛋白-赖氨酸N-甲基转移酶(EZH2)由人类EZH2基因所编码,起到细胞调节作用,其高表达能促进肿瘤细胞的转移[5]。本研究探讨miR-26a与EZH2在肺癌中的表达情况及其对细胞生物学行为的影响。现报告如下。
1 材料与方法
1.1组织样品和细胞培养 收集2016年8月—2017年1月在四川省人民医院行手术切除肺癌肿瘤组织和癌旁正常组织21例,病理类型均为非小细胞肺癌,经组织病理学证实。其中男14例,女7例,年龄43~69岁,中位年龄58岁。所有患者术前均未接受放化疗。本研究通过医院的医学伦理委员会的同意。切除的肿瘤组织和正常组织样本立即放入液氮中冷冻并储存在-80℃直至RNA提取。按照Trizol说明书提取组织中总RNA,超微量分光光度计测定RNA浓度,复能基因有限公司设计miR-26a引物,使用U6作为内参,以100 ng总RNA为模版,逆转录cDNA,反应条件为:37℃ 15 min,98℃ 5 min。根据试剂盒说明书进行聚合酶链反应(PCR)。
1.2细胞株和实验试剂 人非小细胞肺癌细胞株A549由上海细胞生物研究所提供。RPMI-1640培养液、10%新生小牛血清、含100 μg/ml青霉素和100 μg/ml链霉素的0.25%胰酶溶液购自Gibco公司,二甲基亚砜(DMSO)购自Sigma公司。细胞在含有10% FBS、100 μg/ml青霉素和100 μg/ml链霉素的培养基中培养,37℃在5% CO2培养箱中培养,生长至80%左右浓度时进行传代和冻存,用于后续的实验。细胞培养瓶和24、96孔板购自杭州四季庆生物工程材料有限公司。脂质体Lipofectamine 2000、miR-26a mimics/inhibitor购自上海吉凯基因,Trizol购自美国Ambion公司,EZH2抗体购于美国abcam公司。逆转录试剂盒购自日本TOYOBO公司,PCR试剂盒购自美国Kapa公司。荧光素酶活性检测试剂盒购自Promega公司。荧光素酶报告载体由Promega公司合成。
1.3PCR miR-26a mimics和inhibitor购自GenePharma(中国上海)。将200 μl含有100 pmol miR-26a mimics的无血清、无抗生素的培养基与5 μl Lipofectamine 2000(Invitrogen)溶解在200 μl相同培养基混合,并使其静置20 min。然后将所得的400 μl转染溶液加入含有1.6 ml培养基的每个孔中。6 h后,用补充有10% FBS和抗生素的2 ml新鲜培养基代替培养物。同样方法处理miR-26a inhibitor和miR-26a control(对照组)。使用Trizol试剂分离非小细胞肺癌细胞株的总RNA,并使用TM miRNA分离试剂盒(Ambion,Austin,TX,USA)进一步纯化miRNA部分。通过光谱测定RNA样品的浓度和纯度。使用实时PCR系统进行实时逆转录PCR(qPCR)。U6管家基因作为对照。反应条件:95℃ 10 min,45个循环;在95℃变性10 s,在60℃下退火和延伸60 s。使用2-ΔΔCt方法计算非小细胞肺癌细胞株的miRNA相对表达量。实验重复3次。本研究中使用的引物如下:miR-26a上游引物,5'-GTGGTTTCAACTTATATTATAAGAACG-3',下游引物,5'-GACGAAAAGACGTCAAAACTCATTT-3';U6内参上游引物,5'-AGAAAATCTGCGCTTGGTCGTCC-3',下游引物,5'-TAGCCGTGATATCGATGTAGCAA-3'。
1.4蛋白免疫印迹检测EZH2蛋白表达水平 细胞用冰冷的PBS洗涤,然后用蛋白质裂解物(Pierce,Rockford,IL,USA)裂解。在4℃下以5000×g离心15 min后,用二亚铬酸(BCA)蛋白测定试剂盒测定蛋白质浓度。按照说明书配制10% SDS-PAGE分离胶,每孔加入20 μg蛋白样品。使用湿转法将蛋白转至PVDF膜上,使用5%脱脂奶粉室温下封闭2 h,TBST充分冲洗后,使用1∶1000稀释一抗孵育(兔单克隆HTN1抗体),4℃过夜;加入辣根过氧化酶物标记羊抗兔IgG(1∶2500)稀释,室温孵育2 h;ECL发光。实验重复3次。
1.5双荧光素酶实验验证miR-26a和EZH2的关系 将24孔板中的miR-26a或NC细胞与0.4 mg萤火虫荧光素酶报告载体和0.1 mg含有海肾萤光素酶的pRL-TK对照载体共转染,根据siPORTneoFX使用方法操作,在转染后48 h制备裂解物。使用双荧光素酶报告基因测定系统,转染24 h后测定荧光素酶活性。对于每个转染的萤火虫萤光素酶活性被检测为海肾萤光素酶活性。实验重复3次。miR-26a上游引物,5'-GTGGTTTCAACTTATATTATAAGAACG-3',下游引物,5'-GACGAAAAGACGTCAAAACTCATTT-3';EZH2克隆的引物如下:上游引物,5'-CGGGGTACCGAGTCATACTTGTGAAG-3';下游引物,3'-GCACTCGAGCCTGTTTTTGTTTGATG-5'。
1.6甲基噻唑基四唑(MTT)实验测定细胞增殖情况 将对数期生长的A549细胞使用胰蛋白酶消化后,制成单细胞悬浮液并以1×103个/孔的密度接种到96孔板中。在细胞培养7 d后,加入20 μl MTT测定液,每孔充分混合均匀,并在37℃下孵育4~6 h。然后使用无菌吸管吸出上清液,每孔加入二甲基亚砜(DMSO)150 μl,在室温下搅拌10 min保证晶体充分溶解。然后在24、48、72、96 h进行MTT测定波长为490 nm时的吸光度,计算A549细胞的增殖情况。实验重复3次。
1.7细胞凋亡实验 使用Annexin V-Fluos染色试剂盒检测细胞凋亡。细胞用PBS洗涤,并根据说明书染色。将载玻片与Permafluor安装介质一起安装,并在荧光显微镜(Axiophot; Olympus,Tokyo,Japan)下观察。
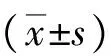
2 结果
2.1miR-26a在肺癌组织中的表达 癌旁正常组织miR-26a表达水平为1.89±0.31,肺癌组织为0.26±0.12。肺癌组织miR-26a表达水平低于癌旁正常组织(P<0.05)。
2.2miR-26a 表达量的检测 miR-26a mimics组中miR-26a相对表达量为5.49±0.81,miR-26a inhibitor组为0.43±0.22,对照组为1.26±0.42。miR-26a mimics组miR-26a相对表达量高于对照组,miR-26a inhibitor组低于对照组(P<0.05)。
2.3miR-26a对A549细胞增殖的影响 转染72 h和96 h时,miR-26a inhibitor组A549细胞增殖活性高于对照组(P<0.05);在96 h时,miR-26a mimics组增殖活性低于对照组(P<0.05);24、48 h 3组A549细胞增殖情况比较差异无统计学意义(P>0.05)。见表1。
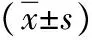
表1 3组A549细胞增殖情况
注:与对照组比较,aP<0.05
2.4miR-26a对A549细胞凋亡的影响 miR-26a mimics组A549细胞凋亡率为(31.06±4.57)%,miR-26a inhibitor组为(8.15±2.03)%,对照组为(19.54±3.98)%。miR-26a mimics组A549细胞凋亡率高于对照组,miR-26a inhibitor组低于对照组(P<0.05)。
2.5miR-26a靶向调控EZH2的表达 双荧光素酶报告基因结果显示,转染miR-26a mimics后可明显抑制EZH2荧光素酶活性。miR-26a mimics组、miR-26a inhibitor组和对照组EZH2蛋白相对表达量分别为0.64±0.09、1.73±0.04和1.05±0.04。miR-26a mimics组EZH2蛋白相对表达量低于对照组,而miR-26a inhibitor组蛋白表达量高于对照组(P<0.05)。见图1。
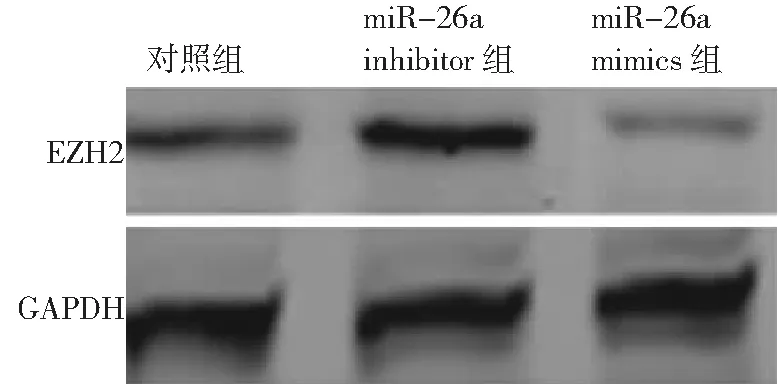

图1 miR-26a对3组EZH2蛋白表达的影响
3 讨论
肿瘤发生是由遗传损伤和表观遗传变化所引起的生物学过程[6],寻找肿瘤差异基因和鉴定新型肿瘤相关基因是研究治疗的重点[7]。miRNA是一类高度保守的短非编码RNA,其通过与3'UTR区域不完全碱基配对,起到转录后调控靶mRNA表达作用[8]。最近,有学者通过肿瘤组织、肿瘤细胞株与正常组织比较,阐明了癌症与miRNA的关系[9]。不同类型恶性肿瘤miRNA的表达也有一定差异[10],且miRNA与肿瘤之间的关系还表现在某些miRNA基因在肿瘤中的扩增和缺失[11-12]。据报道,抑制或上调某些关键的miRNA,能促进肿瘤细胞在体内或体外的生物学行为的改变[13]。因此,miRNA可以作为抑制肿瘤的分子靶点。如在肺癌中,miR-let7、miR-155、miR-29和miR-31已被报道为可以作为肿瘤抑制因子或抑癌基因[14-15]。miR-26a在甲状腺癌、淋巴瘤、横纹肌肉瘤中表现出一定程度的上调[16-17],但是其在肺癌中的作用却鲜有报道。本研究结果显示,肺癌组织中miR-26a 的表达水平低于癌症正常组织,miR-26a mimics组miR-26a表达量高于对照组,miR-26a inhibitor 组低于对照组,提示miR-26a与肺癌有较高的相关性,其表达降低与肿瘤生成有关,同时还影响了肺癌细胞的增殖和凋亡,所以其可能起到了一定的抑癌作用。
越来越多的证据表明,miRNA参与调节各种生物发展过程,包括发育、细胞增殖和细胞分化[18-19]。本研究结果显示,转染72、96 h miR-26a inhibitor 组A549细胞增殖活性高于对照组,96 h miR-26a mimics组低于对照组,miR-26a mimics组细胞凋亡率高于对照组,miR-26a inhibitor 组低于对照组,提示miR-26a可调控肺癌A549细胞的增殖和凋亡。
miRNA与转录网络有密切联系,抑制基因表达,减少肿瘤相关蛋白的生成,以达到抑制肿瘤的作用。EZH2能诱导E-钙黏蛋白沉默,并影响其他靶基因,调控肿瘤细胞生长和转移[20]。EZH2已经在乳腺癌和前列腺癌中被证实与肿瘤生长和转移能力密切相关,且参与了肺癌的进展[21-22]。Breuer等[23]发现EZH2 PcG致癌基因在支气管肺癌中异常表达,且EZH2表达的改变要早于肺癌细胞的增殖。Kikuchi等[24]证实EZH2高表达与肿瘤侵袭性相关,其可能为非小细胞肺癌新的预后标记。Yoon等[25]研究表明EZH2的突变体与肺癌风险降低有关,提出了其可能成为肺癌易感性的标志物。本研究结果显示,miR-26a mimics 组EZH2蛋白相对表达量低于对照组,miR-26a inhibitor 组蛋白表达量高于对照组。
综上所述,miR-26a表达的降低与肿瘤的生成有关,同时其能抑制肺癌细胞增殖和诱导细胞凋亡,与EZH2的3'UTR特异性结合,并可抑制EZH2蛋白的表达活性。miR-26a在肺癌分子病因学中起到重要作用,可成为治疗肺癌的新靶点。
[1] Siegel R L, Miller K D, Jemal A. Cancer statistics, 2016[J].CA cancer J Clin, 2016,66(1):7-30.
[2] Moyer V A. Screening for lung cancer: US Preventive Services Task Force recommendation statement[J].Annals of internal medicine, 2014,160(5):330-338.
[3] Lin S, Gregory R I. MicroRNA biogenesis pathways in cancer[J].Nat Rev Cancer, 2015,15(6):321-333.
[4] Kasinski A L, Kelnar K, Stahlhut C,etal. A combinatorial microRNA therapeutics approach to suppressing non-small cell lung cancer[J].Oncogene, 2015,34(27):3547-3555.
[5] Kim K H, Roberts C W. Targeting EZH2 in cancer[J].Nat Med, 2016,22(2):128-134.
[6] 赵欣,李媛媛,曹丁丁,等.肿瘤表观基因组学研究进展[J].现代生物医学进展,2016,16(1):172-175.
[7] 邓洪新,魏于全.肿瘤基因治疗的研究现状和展望[J].中国肿瘤生物治疗杂志,2015,22(2):170-176.
[8] Ha M, Kim V N. Regulation of microRNA biogenesis[J].Nat Rev Mol Cell Biol, 2014,15(8):509-524.
[9] Hayes J, Peruzzi P P, Lawler S. MicroRNAs in cancer: biomarkers, functions and therapy[J].Trends Mol Med, 2014,20(8):460-469.
[10] Di Leva G, Garofalo M, Croce C M. MicroRNAs in cancer[J].Annual Review of Pathology: Mechanisms of Disease, 2014,9:287-314.
[11] Chen S, Xue Y, Wu X,etal. Global microRNA depletion suppresses tumor angiogenesis[J].Genes development, 2014,28(10):1054-1067.
[12] Adams B D, Kasinski A L, Slack F J. Aberrant regulation and function of microRNAs in cancer[J].Curr Biol, 2014,24(16):R762-776.
[13] Acunzo M, Romano G, Wernicke D,etal. MicroRNA and cancer--a brief overview[J].Adv Biol Regul, 2015,57:1-9.
[14] Ding S, Xu Y, Shen L,etal. MiR-155 promotes proliferation of human non-small cell lung cancer H460 cells via targeting TP53INP1[J].Int J Clin Exp Med, 2017,10(8):11953-11960.
[15] Xu H, Ma J, Zheng J,etal. MiR-31 Functions as a Tumor Suppressor in Lung Adenocarcinoma Mainly by Targeting HuR[J].Clin Lab, 2016,62(4):711-718.
[16] Ren G, Li H, He X,etal. Downregulation of serum miR-26a predicts poor clinical outcome of papillary thyroid carcinoma[J].Int J Clin Exp Pathol, 2017,10(8):9042-9047.
[17] Zhao X, Lwin T, Zhang X,etal. Disruption of the MYC-miRNA-EZH2 loop to suppress aggressive B-cell lymphoma survival and clonogenicity[J].Leukemia, 2013,27(12):2341-2350.
[18] Cheng C J, Bahal R, Babar I A,etal. MicroRNA silencing for cancer therapy targeted to the tumor microenvironment[J].Nature, 2015,518(7537):107.
[19] Farmer D T, McManus M T. MicroRNAs in ectodermal appendages[J].Curr Opin Genet Dev, 2017,43:61-66.
[20] Liu L, Xu Z, Zhong L,etal. Enhancer of zeste homolog 2 (EZH2) promotes tumour cell migration and invasion via epigenetic repression of E-cadherin in renal cell carcinoma[J].BJU international, 2016,117(2):351-362.
[21] Wu C, Jin X, Yang J,etal. Inhibition of EZH2 by chemo-and radiotherapy agents and small molecule inhibitors induces cell death in castration-resistant prostate cancer[J].Oncotarget, 2016,7(3):3440-3452.
[22] Riquelme E, Behrens C, Lin H Y,etal. Modulation of EZH2 expression by MEK-ERK or PI3K-AKT signaling in lung Cancer is dictated by different KRAS oncogene mutations[J].Cancer Res, 2016,76(3):675-685.
[23] Breuer R H, Snijders P J, Smit E F,etal. Increased expression of the EZH2 polycomb group gene in BMI-1-positive neoplastic cells during bronchial carcinogenesis[J].Neoplasia, 2004,6(6):736-743.
[24] Kikuchi J, Kinoshita I, Shimizu Y,etal. Distinctive expression of the polycomb group proteins BMI1 polycomb ring finger oncogene and enhancer of zeste homolog 2 in nonsmall cell lung cancers and their clinical and clinicopathologic significance[J].Cancer, 2010,116(12):3015-3024.
[25] Yoon K A, Gil H J, Han J,etal. Genetic polymorphisms in the polycomb group gene EZH2 and the risk of lung cancer[J].J Thorac Oncol, 2010,5(1):10-16.

