不同双荧光素酶方法对检测胃癌相关miRNAs靶向基因TIAM1的影响
史艳芬,胡高峰,罗 杰,钟定荣,续 薇
(1.中日友好医院 病理科,北京 100029;2.北京医院 国家老年医学中心 国家卫生健康委临床检验中心中国医学科学院老年医学研究院,北京 100730;3.吉林大学第一医院 检验科,长春 130021)
微小RNAs(miRNAs)是一种被广泛研究的稳定性较好的非编码RNA,研究认为,miRNAs 可作为肿瘤标志物应用于不同疾病的诊断和预后[1,2],也可参与肿瘤的治疗如直接抑制肿瘤或调控化疗耐药[3],而miRNAs 调控靶基因表达是miRNA 发挥生物学作用的重要方式,双荧光素酶实验方法是现今最常用的研究miRNA 和靶基因直接作用关系的实验,双荧光素酶实验在荧光素酶质粒选择、抑制物/类似物(inhibitor/mimc)选择等细节方面各有不同[4,5],尚无文献报道这些差异是否会影响其结果判断。为探索适合的双荧光素酶实验方法,本研究从胃癌细胞BGC823 基因组中提取了T-细胞淋巴瘤侵袭转移诱导基因(T-lymphom invasion and metastasis gene,TIAM1)的3’非编码区(3’-UTR)片段全长,将TIAM1-3’UTR 构建在2种不同的荧光素酶基因质粒上,通过在线数据库预测及在前期研究的基础上,选取8 种可能作用于TIAM1-3’UTR 的miRNAs,分别转染其抑制物和类似物进行双荧光素酶实验研究。
1 材料与方法
1.1 材料
细胞系: 人胃癌细胞系BGC823 获赠于吉林大学第一医院检验科单洪丽博士。质粒:荧光素酶质 粒psi-CHECK2、pGL-CMV-promoter、Renilla均获赠于吉林大学第一医院转化研究院艾滋病与病毒研究中心杜娟课题组。
1.2 试剂和仪器
DMEM、RPMI1640 和胰蛋白酶购自美国Hyclone 公司,Opti-MEM、胎牛血清(FBS)购自美国Gibco 公司,限制性内切酶(XbaⅠ、XhoⅠ、NotⅠ、EcoRⅠ) 和T4 DNA 连接酶购自美国New England BioLabs 公司,基因组DNA 提取试剂盒、感受态大肠杆菌细胞和LipofectamineTM3000 购自美国Invitrogen 公司,KD 聚合酶、质粒小提试剂盒和双荧光素酶实验试剂盒购自中国北京Transgene 公司,miRNAs 的类似物和抑制物购自中国广州Ribobio 公司。发光检测仪为Promega 公司的Glo-MaxTM 20/20 Luminometer。
1.3 实验方法
1.3.1 细胞培养
采用含有10%FBS 的RPMI1640,在37℃含5%CO2的细胞培养箱中传代培养。选取miRNAs通过在线数据库(Targetscan、miRDB、miRWalk、miRNet、MicroT-CDS、miRSystem 和miRNAMap)预测及课题组前期研究基础[6],选择影响TIAM1 mRNA 表达且可能作用于TIAM1-3’UTR 的8 种miRNAs(见表1)。
1.3.2 质粒构建
使用基因组DNA 提取试剂盒,从BGC823 细胞系中提取基因组DNA。使用KD 聚合酶,采用普通PCR 的方法,将TIAM1-3’UTR 片段全长(1950bp)从基因组DNA 中扩增出来,根据使用引物不同(见表2),获得2 种TIAM1-3’UTR 片段,一种两端含有XhoⅠ和NotⅠ酶切位点,另一种两端含有XbaⅠ和EcoRⅠ酶切位点,分别酶切后备用。将psi-CHECK2 质粒进行XhoⅠ和NotⅠ双酶切,使用T4 DNA 连接酶,将备用的TIAM1-3’UTR 片段通过酶切位点插入到Renilla 荧光素酶基因下游,构建的质粒命名为psi-TIAM1-3’UTR。对于pGL-CMV-promoter 质粒,首先使用设计的突变引物和KD 聚合酶进行连续3 个碱基的突变,使Firefly 荧光素酶基因下游出现EcoRⅠ酶切位点,再进行XbaⅠ和EcoRⅠ双酶切,使用T4 DNA 连接酶,将备用的TIAM1-3’UTR 片段通过酶切位点插入到Firefly 荧光素酶基因下游,构建的质粒命名为pGL3-TIAM1-3’UTR。将构建的2种质粒转化入感受态大肠杆菌细胞,扩增培养后,挑取单克隆菌落,使用质粒小提试剂盒提取质粒并送测序。测序确认TIAM1-3’UTR 序列均正确插入,2 种质粒构建成功,其结构示意图见图1。
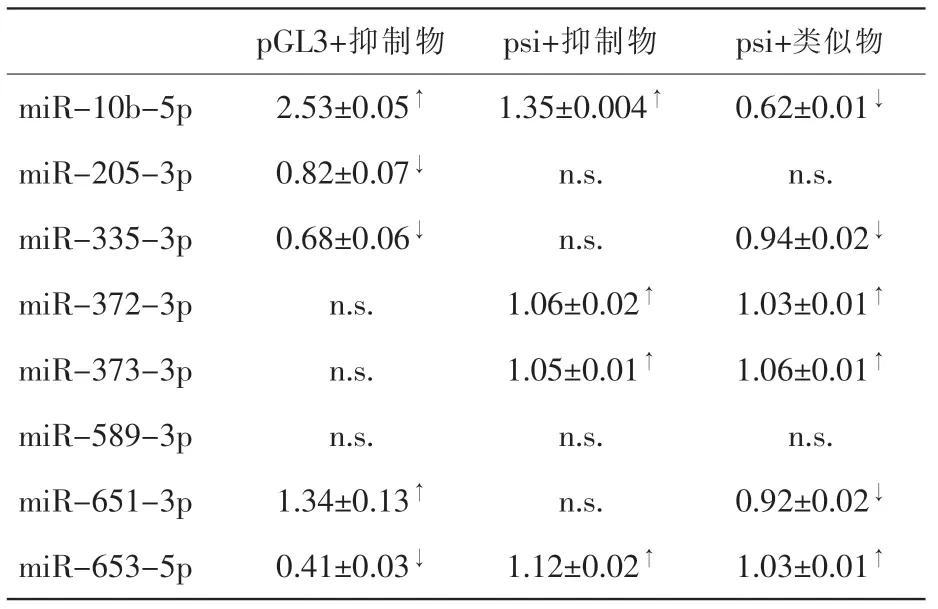
表1 应用2 种双荧光素酶实验方法检测胃癌相关miRNAs 靶向TIAM1 的结果(改变倍数,x±s)

表2 从基因组上扩增出TIAM1-3’UTR 所用引物
1.3.3 转染
将等量待转染细胞铺在24 孔板中,次日细胞贴壁后且密度达80%左右进行转染。将质粒、miR-类似物/抑制物和P3000TM 加入到Opti-MEM 后静置5min,将Lipofectamine 3000 加入另一管Opti-MEM 后静置5min,将稀释后的2 种液体混匀后再静置20min,吸净待转染细胞的旧培养基并加入上述转染液,置入培养箱中2h 后更换普通培养液,48h 后收集细胞进行实验。
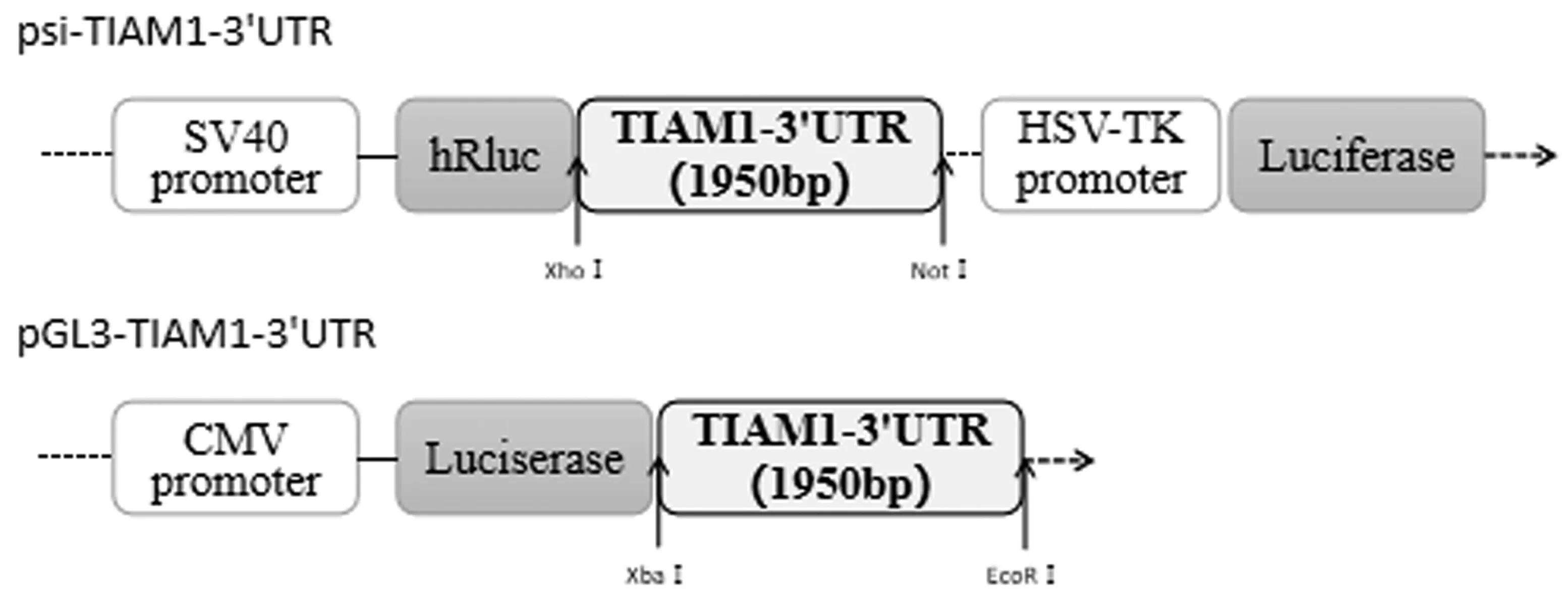
图1 pGL3-TIAM1-3’UTR 和psi-TIAM1-3’UTR质粒结构示意图

图2 双荧光素酶实验时pGL3-TIAM1-3’UTR 和psi-TIAM1-3’UTR 质粒可出现不同的结果
1.3.4 双荧光素酶实验
转染后48h 收获细胞,PBS 润洗2 次后加入裂解液,室温裂解10min,4℃条件下12000g 离心10min,吸取20滋l 上清置于1.5ml EP 管中,该EP管中已提前加入配好的100滋l 荧光素酶底物试剂,混匀后立即在发光检测仪中检测荧光值,该数值即反应荧光素酶的活性。再加入100滋l 另一种荧光素酶底物试剂,检测另一种荧光素酶活性。Firefly 荧光素酶的反应后荧光在波长560nm 处检测,Renilla 荧光素酶的反应后荧光在波长470nm 处检测。由于miRNA 经典作用方式为结合靶基因3’UTR 位点,影响靶基因的翻译过程,本研究中将TIAM1-3’UTR 插入到荧光素酶基因下游,因此试剂盒检测出的相对荧光素酶活性改变将间接反映miRNA 对TIAM1-3’UTR 的作用。
1.4 统计学方法
数据来源于至少3 次独立实验,应用SPSS20.0 软件进行统计学分析。计量资料用x±s描述,组间比较采用t 检验。采用Graphpad 软件作图。
2 结果
2.1 用不同的质粒进行双荧光素酶实验
BGC-823 细胞系中分别转染pGL3-TIAM1-3’UTR 和psi-TIAM1-3’UTR 质粒,观察miR-抑制物处理后荧光素酶活性变化。miR-10b-抑制物处理后,2 种质粒的荧光素酶活性均升高,说明miR-10b-5p 对2 种质粒上荧光素酶基因的调控可能相同;miR-651-抑制物处理后2 种质粒的荧光素酶活性变化完全相反,miR-653-抑制物处理后也是如此,表明miR-651-3p 和miR-653-5p 对2 种质粒上的荧光素酶基因的调控有差异 (见图2)。
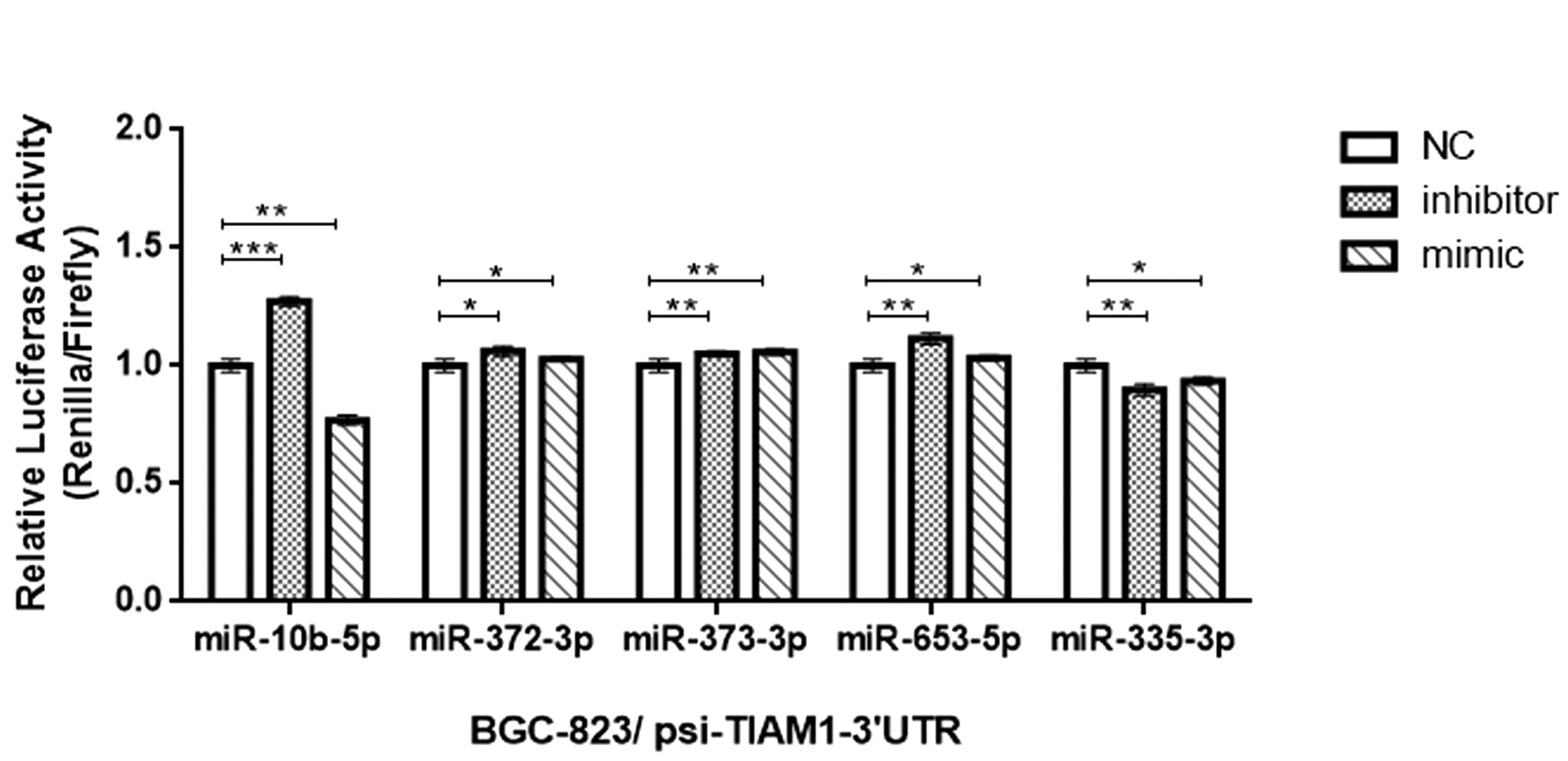
图3 双荧光素酶实验时miR-抑制物和miR-类似物可出现相同结果
2.2 抑制物和类似物同时进行双荧光素酶实验
本研究在BGC823 细胞系中转染psi-TIAM1-3’UTR 质粒后,分别用miR-抑制物和miR-类似物处理,观察荧光素酶活性变化。miR-10b-5p 的抑制物和类似物处理组荧光素酶活性分别增高和减弱,表明miR-10b-5p 通过直接作用于TIAM1-3’UTR 序列影响基因表达;而miR-372-3p、miR-373-3p 和miR-653-5p 的抑制物和类似物处理组荧光素酶活性均升高,miR-335-3p的抑制物和类似物处理组荧光素酶活性均减低(见图3)。
3 讨论
3.1 同种miRNA 在2 种荧光素酶质粒的结果
本文以胃癌相关miRNAs 靶向TIAM1-3’UTR 为例,研究了双荧光素酶实验适合的实验条件,结果显示,同种miR-抑制物分别作用在pGL3-TIAM1-3UTR 和psi-TIAM1-3’UTR 2 种质粒上,可能会产生不同的实验的结果(表1 和图2)。由于pGL3-TIAM1-3’UTR 质粒常共转Renilla 质粒做内参[7],与psi-TIAM1-3UTR 质粒的内参基因不同。有研究报道睾丸受体4(TR4,或称NR2C2)的过表达导致Renilla 的表达降低,说明海肾荧光素酶基因的表达会受到其他物质调控[8],而miRNA 在复杂的生物体内可能会有多个靶基因和调控通路,所以推测某些miRNA 可能会间接影响Renilla 的表达,出现本实验中的结果。而且因为使用pGL3-TIAM1-3UTR 这种质粒时,其内参基因在共转的另一个质粒上,只是理论上认为2 种质粒的转染效率一致,增加了更多的不确定性。因此目前也有研究报道认为这种将2 种荧光素酶合成在同一质粒上的方法更为合适[9]。
3.2 同种荧光素酶质粒使用抑制物/类似物
对于同种荧光素酶质粒,使用抑制物和类似物的双荧光素酶实验结果可能不同。本研究中miR-372-3p、miR-373-3p 和miR-653-5p 在转染抑制物时相对荧光素酶活性增加,表明此3 种miRNAs 能够靶向作用于TIAM1-3’UTR,但是在转染类似物时的结果并不支持这一结论; 类似的miR-335-3p 只在转染类似物时能得出靶向作用于TIAM1-3’UTR 的结论,转染抑制物时则不支持。上述4 种miRNAs 中,有文献报道miR-653-5p 在乳腺癌中能够靶向TIAM1[10],其余miRNAs和TIAM1 的关系均尚无报道,在本实验的条件下,我们的数据不支持其直接靶向作用与TIAM1-3’UTR。因此综合抑制物和类似物两方面的结果来判断,至少对于双荧光素酶实验是很有必要的。
综上,miR-10b-5p 能够直接靶向作用于TIAM1-3’UTR,研究中纳入的其余miRNAs 均不支持与TIAM1-3’UTR 有直接靶向作用关系。本研究有助于优化miRNA 与靶基因关系、miRNA与肿瘤关系的研究。

